-
(12分)实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。某同学取一定量铁铝合金与100mL某浓度的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入4mol·L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示(C>0)。试回答下列问题:
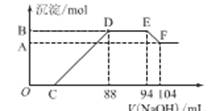
(1)写出反应过程中的离子反应方程式:
OC段________,
DE段,
EF段_____________________________________________________。
(2)硝酸溶液的物质的量浓度为________mol·L-1
(3)B的值为_________mol,C的值为________mL。
【解析】由题意知,金属与硝酸反应时,硝酸的还原产物为NH4NO3,由图又可看出金属与硝酸反应后,硝酸是过量的,故金属的氧化产物为Fe(NO3)3、Al(NO3)3。图中:①O→C:H++OH-===H2O;②C→88:R3++3OH-===R(OH)3↓(R代表Fe或Al);③88→94:NH+OH-===NH3·H2O;④94→104:Al(OH)3+OH-===AlO+2H2O。由④知n[Al(OH)3]=0.01 L×4 mol·L-1=0.04 mol=n(Al)。由③知,n(NH4NO3)=0.006 L×4 mol·L-1=0.024 mol,根据反应中得失电子相等的原则得:3n(R3+)=0.024×8=0.192 mol,则n(R3+)=0.064 mol=n(合金),故混合物中n(Fe)=0.024mol。0→88 mL中,用于沉淀金属离子的OH-有0.064 mol×3=0.192 mol,故C点:(0.088 L×4 mol·L-1-0.192 mol)÷4 mol·L-1=0.04 L,即40 mL。据原子守恒可知硝酸的物质的量是0.094L×4mol/L=0.376mol。其浓度是3.76mol/L。
-
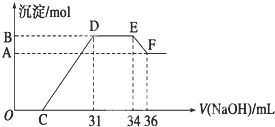
实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低.某同学取一定量的镁铝合金与一定量很稀的硝酸充分反应,反应过程中无气体放出.在反应结束后的溶液中,逐滴加入4mol•L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示.试回答下列问题:
(1)OC段没有沉淀生成,此阶段发生反应的离子方程式为:______.
(2)在DE段,沉淀的物质的量没有变化,则此阶段发生反应的离子方程式为:______
(3)B与A的差值为______mol,C点对应的氢氧化钠溶液的体积为______mL.
-
硝酸发生氧化还原反应的时候,一般硝酸越稀,对应的还原产物中氮的化合价越低。现有一定量的铝、铁合金与一定量稀HNO3充分反应,反应过程中无任何气体放出。在反应结束后的溶液中,逐滴加入4 mol/L NaOH溶液,所加NaOH溶液的体积(V)与产生沉淀的物质的量(n)关系如图所示。下列说法中不正确的是

A.无法求出曲线C点数值
B.合金与硝酸反应时硝酸过量
C.合金中铝的物质的量为0.008 mol
D.合金中金属的物质的量共为0.032 mol
-
硝酸发生氧化还原反应的时候,一般硝酸越稀,对应的还原产物中氮的化合价越低。现有一定量的铝、铁合金与一定量稀HNO3充分反应,反应过程中无任何气体放出。在反应结束后的溶液中,逐滴加入4mol/L NaOH溶液,所加NaOH溶液的体积(V)与产生沉淀的物质的量(n)关系如图所示。下列说法中不正确的是
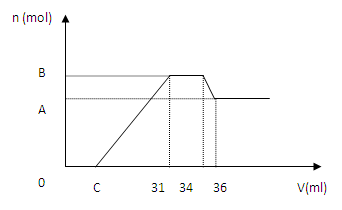
A.合金与硝酸反应时硝酸过量 B.合金中铝的物质的量为0.008mol
C.合金中金属的物质的量共为0.032mol D.无法求出C 点的值
-
将一定质量的镁、铜合金加入到稀硝酸溶液中,两者恰好完全反应,假设反应过程中还原产物全部是NO,向所得溶液中加入物质的量浓度为3 mol·L-1的NaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1g,则下列有关叙述中正确的是( )
A.开始加入合金的质量可能为3.6g
B.参加反应的硝酸的物质的量为0.1mol
C.沉淀完全时消耗NaOH溶液的体积为100mL
D.溶解合金时产生NO的体积为2.24L
-
将一定质量的镁、铜合金加入到稀硝酸中,两者恰好完全反应,假设反应过程中还原产物全是NO,向所得溶液中加入物质的量浓度为3mol·L-1 的NaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1g,则下列有关叙述中正确的是
A. 开始加入合金的质量可能为16.4g
B. 标准状况下产物NO的体积为22.4L
C. 生成沉淀完全时消耗NaOH溶液的体积为100mL
D. 参加反应的硝酸的物质的量为0.1mol
-
将一定质量的镁、铜合金加入到稀硝酸溶液中,两者恰好完全反应,假设反应过程中还原产物全部是NO,向所得溶液中加入物质的量浓度为3mol•L﹣1的NaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1g,则下列有关叙述中正确的是( )
A.开始加入合金的质量可能为3.6g
B.参加反应的硝酸的物质的量为0.1mol
C.沉淀完全时消耗NaOH溶液的体积为100mL
D.溶解合金时产生NO的体积为2.24L
-
将一定质量的镁、铜合金加入到稀硝酸中,两者恰好完全反应,假设反应过程中还原产物全是NO,向所得溶液中加入物质的量浓度为3mol·L-1 的NaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1g,则下列有关叙述中正确的是
A.开始加入合金的质量可能为16.4g
B.标准状况下产物NO的体积为22.4L
C.生成沉淀完全时消耗NaOH溶液的体积为100mL
D.参加反应的硝酸的物质的量为0.1mol
-
将一定质量的镁、铜合金加入到稀硝酸中,两者恰好完全反应,假设反应过程中还原产物全是NO,向所得溶液中加入物质的量浓度为3mol·L-1 的NaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1g,则下列有关叙述中正确的是
A.开始加入合金的质量可能为16.4g
B.标准状况下产物NO的体积为22.4L
C.生成沉淀完全时消耗NaOH溶液的体积为100mL
D.参加反应的硝酸的物质的量为0.1mol
-
某同学在学习元素化合物知识的过程中,发现含有相同元素的物质间在一定条件下存在转化规律,绘制出如下转化关系图(部分反应物或产物略去),并用于研究物质A、B、C、D的性质及其变化。
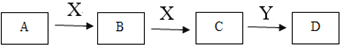
(1)若A是黄绿色气体,X是生活中应用最大量的金属,D是白色固体。
① 组成A的元素在周期表中的位置是______。
② 下列说法正确的是______(填字母)。
a.B的水溶液中加入KSCN溶液,变为红色
b.C只具有还原性
c.若Y是碱,D放置在空气中会迅速变为灰绿色,最终变为红褐色
(2)若A、B、C、D的焰色反应均为黄色,X的固体俗称干冰。
① B转化为C的离子方程式是______。
② A用于呼吸面具或潜水艇中氧气的来源,则A和X反应生成1 mol B时,转移电子数为______。
③ C与Y反应生成X的离子方程式_________________。