-
某兴趣小组设计SO2实验方案做以下化学实验。
Ⅰ.实验方案一
(1)将SO2通入水中形成“SO2 ─ 饱和H2SO3溶液”体系,此体系中存在多个含硫元素的平衡,分别用平衡方程式表示为___________________________________________。
(2)已知:葡萄酒中有少量SO2可以做抗氧化剂[我国国家标准(GB2760-2014)规定葡萄酒中SO2的残留量≤0.25g/L]。利用SO2的漂白性检测干白葡萄酒(液体为无色)中的SO2或H2SO3。设计如下实验:
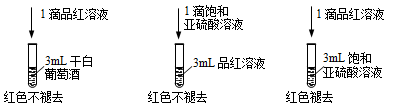
实验结论:干白葡萄酒不能使品红溶液褪色,原因为:_________________________。
Ⅱ.实验方案二
如图是在实验室进行二氧化硫制备与性质实验的组合装置,部分固定装置未画出。
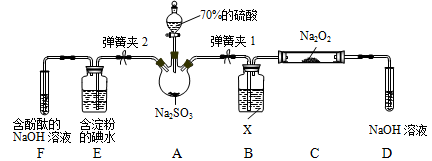
(1)装置B中试剂X是________,装置D中盛放NaOH溶液的作用是_______________。
(2)关闭弹簧夹2,打开弹簧夹1,注入硫酸至浸没三颈烧瓶中固体,检验SO2与Na2O2反应是否有氧气生成的方法是_______________________。
(3)关闭弹簧夹1后,打开弹簧夹2,残余气体进入E、F中,能说明I-还原性弱于SO2的现象为____________________;发生反应的离子方程式是__________________。
Ⅲ.实验方案三
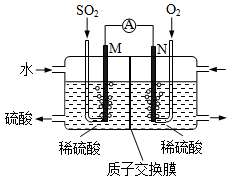
用电化学法模拟工业处理S02。将硫酸工业尾气中的S02通入右图装置(电极均为惰性材料)进行实验,可用于制备硫酸,同时获得电能,:
(1)M极发生的电极反应式为__________________。
(2 ) )若使该装置的电流强度达到2.0A,理论上每分钟应向负极通入标准状况下气体的体积为 L(已知:1个e所带电量为1.6×10-19C)。
-
某兴趣小组根据镁与沸水的反应推测镁也能与饱和碳酸氢钠溶液反应。资料显示:镁与饱和碳酸氢钠溶液反应产生大量气体和白色不溶物。该兴趣小组设计了如下实验方案并验证产物、探究反应原理。
实验Ⅰ:用砂纸擦去镁条表面氧化膜,将其放入盛有适量滴有酚酞的饱和碳酸氢钠溶液的试管中,迅速反应,产生大量气泡和白色不溶物,溶液由浅红变红。
(1)提出假设
该同学对反应中产生的白色不溶物作出如下猜测:
猜测1:可能是____________________。
猜测2:可能是MgCO3。
猜测3:可能是碱式碳酸镁[xMgCO3·yMg(OH)2]。
(2)设计定性实验确定产物并验证猜测:
| 实验序号 | 实验 | 预期现象和结论 |
| 实验Ⅱ | 将实验Ⅰ中收集的气体点燃 | ______________________________________ |
| 实验Ⅲ | 取实验Ⅰ中的白色不溶物,洗涤,加入足量________ | 如果出现______________,则白色不溶物可能是MgCO3 |
| 实验Ⅳ | 取实验Ⅰ中的澄清液,向其中加入少量CaCl2稀溶液 | 如果产生白色沉淀,则溶液中存在______离子 |
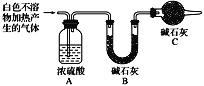
(3)设计定量实验确定实验Ⅰ的产物:称取实验Ⅰ中所得干燥、纯净的白色不溶物31.0 g,充分加热至不再产生气体为止,并使分解产生的气体全部进入装置A和B中。实验前后装置A增重1.8 g,装置B增重13.2 g,试确定白色不溶物的化学式________________________。
(4)请结合化学用语和化学平衡移动原理解释Mg和饱和NaHCO3溶液反应产生大量气泡的原因__________。
-
某兴趣小组根据镁与沸水的反应推测镁也能与饱和碳酸氢钠溶液反应。资料显示:镁与饱和碳酸氢钠溶液反应产生大量气体和白色不溶物。该兴趣小组设计了如下实验方案并验证产物、探究反应原理。
实验1:用砂纸擦去镁条表面氧化膜,将其放人盛有适量滴有酚酞的饱和碳酸氢钠溶液的试管中,迅速反应,产生大量气泡和白色不溶物,溶液由浅红变红。
(1)提出假设
该同学对反应中产生的白色不溶物作出如下假设:
假设1:可能为________。
假设2:可能为MgCO3。
假设3:可能是碱式碳酸镁[xMgCO3·yMg(OH)2]
(2)设计定性实验确定产物并验证猜测:
| 实验序号 | 实验 | 预期现象和结论 |
| 实验II | 将实验I中收集到的气体点燃 | |
| 实验III | 取实验I中的白色不溶物,洗涤,加入足量________________ | ________; 白色不溶物可能含有MgCO3 |
| 实验IV | 取实验I中的澄清液,向其中加入少量CaCl2稀溶液 | 产生白色沉淀;溶液中存在________离子 |
(3)设计定量实验确定实验I的产物:称取实验I中所得干燥、纯净的白色不溶物31.0 g,充分加热至不再产生气体为止,并使分解产生的气体全部进入盛有足量浓硫酸的洗气瓶A、盛有足量碱石灰的干燥管B和盛有足量碱石灰的干燥管C中。实验前后装置A增重1.8 g,装置B增重13.2 g,试确定白色不溶物的化学式________。
(4)请结合化学用语和化学平衡移动原理解释Mg和NaHCO3溶液反应产生大量气泡的原因________。
-
下列实验方案、现象、得出的结论均正确的是
| 选项 | 实验及现象 | 结论 |
| A | 用酸度计测定SO2和CO2饱和溶液的pH,前者pH小 | H2SO3酸性强于H2CO3 |
| B | 向待测液中依次滴入氯水和KSCN溶液,溶液变为红色 | 待测溶液中含有Fe2+ |
| C | 向酸化的KMnO4溶液中通入SO2,向反应后的溶液中加入BaCl2产生白色沉淀 | 证明SO2被氧化为SO42- |
| D | 其他条件相同,测定等浓度的HCOOK和K2S溶液的pH | 比较Ka(HCOOH) 和Ka2(H2S)的大小 |
A.A B.B C.C D.D
-
下列实验方案、现象、得出的结论均正确的是( )
| 选项 | 实验及现象 | 结论 |
| A | 用pH计测定SO2和CO2饱和溶液的pH,前者pH小 | H2SO3酸性强于H2CO3 |
| B | 向待测液中依次滴入氯水和KSCN溶液,溶液变为红色 | 待测溶液中含有Fe2+ |
| C | 向酸化的KMnO4溶液中通入SO2,向反应后的溶液中加入BaCl2产生白色沉淀 | 证明SO2被氧化为SO42- |
| D | 其他条件相同,测定等浓度的HCOOK和K2S溶液的pH | 比较Ka(HCOOH)和Ka2(H2S)的大小 |
A.A B.B C.C D.D
-
(10分)SO2是一种大气污染物,某兴趣小组欲探究SO2的性质及绿色实验方法,设计如下方案:
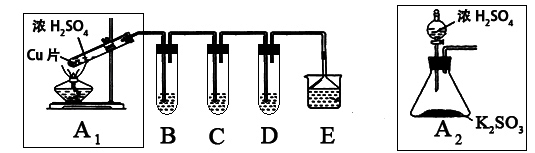
⑴ B、C、D分别用于检验SO2的漂白性、还原性和氧化性。其中C、D分别为碘水和硫化氢的水溶液,则B中所盛试剂为______________,C中反应的离子方程式为:____________________________________________。
⑵ 为了实现绿色实验的目标,某同学重新设计了如上右图A2的制取装置来代替A1装置,与A1装置相比,A2装置的优点是:____________________________________________________(任写一点即可)。
⑶ E中用氨水吸收尾气中的SO2,“吸收液”中可能含有OH-、SO32-、SO42-、HSO3-等阴离子。已知亚硫酸氢盐一般易溶于水,SO2也易溶于水。现有仪器和试剂为:小烧杯、试管、玻璃棒、胶头滴管、过滤装置和滤纸;2mol/L盐酸、2mol/L HNO3、1mol/L BaCl2溶液、1mol/L Ba(OH)2溶液、品红溶液、蒸馏水。请设计实验证明“吸收液”中存在SO32-和HSO3-,完成下表的实验操作、预期现象和结论:
| 实验操作 | 预期现象与结论 |
| 步骤1:取适量“吸收液”于小烧杯中,用胶头滴管取1mol/L BaCl2溶液向小烧杯滴加直至过量。 | 若出现白色浑浊,则溶液中存在SO32-或 SO42-。 |
| 步骤2:将小烧杯中的浊液过滤、洗涤,再用适量水把附在滤纸上的固体冲入另一小烧杯中;向冲下的固体_______________ _______________________________________________________ | _________________________ ____________________________ |
| 步骤3______________________________________________ ____________________________________________________ | _________________________ _________________________ |
-
SO2是一种大气污染物,某兴趣小组欲探究SO2的性质及绿色实验方法,设计如下方案:

⑴ B、C、D分别用于检验SO2的漂白性、还原性和氧化性。其中C、D分别为碘水和硫化氢的水溶液,则B中所盛试剂为______________,C中反应的离子方程式为:____________________________________________。
⑵为了实现绿色实验的目标,某同学重新设计了如上右图A2的制取装置来代替A1装置,与A1装置相比,A2装置的优点是:____________________________________________________(任写一点即可)。
⑶ E中用氨水吸收尾气中的SO2,“吸收液”中可能含有OH-、SO32-、SO42-、HSO3-等阴离子。已知亚硫酸氢盐一般易溶于水,SO2也易溶于水。现有仪器和试剂为:小烧杯、试管、玻璃棒、胶头滴管、过滤装置和滤纸;2mol/L盐酸、2mol/L HNO3、1mol/L BaCl2溶液、1mol/L Ba(OH)2溶液、品红溶液、蒸馏水。请设计实验证明“吸收液”中存在SO32-和HSO3-,完成下表的实验操作、预期现象和结论:
| 实验操作 | 预期现象与结论 |
| 步骤1:取适量“吸收液”于小烧杯中,用胶头滴管取1mol/L BaCl2溶液向小烧杯滴加直至过量。 | 若出现白色浑浊,则溶液中存在SO32-或 SO42-。 |
| 步骤2:将小烧杯中的浊液过滤、洗涤,再用适量水把附在滤纸上的固体冲入另一小烧杯中;向冲下的固体________________________________________________________________ | _____________________ |
| 步骤3____________________________________________ | _________________________ |
-
下列事实或实验可以表明H2SO3的酸性强于H2CO3的是( )
A.硫的非金属性比碳强
B.SO2气体依次通过NaHCO3溶液、澄清石灰水,澄清石灰水变浑浊
C.SO2和CO2气体分别通入水中至饱和,测定两溶液的pH,前者小于后者
D.室温下测定均为0.1mol/L的NaHSO3和NaHCO3溶液的pH,前者小于后者
-
I.某学习小组为了探究“SO2与Fe3+反应的产物”,将过量的SO2通入FeCl3溶液中后,各取10 mL反应液分别加入编号为A、B、C的试管中,并设计以下3种实验方案:
方案①:A中加入少量KMnO4溶液,溶液紫红色褪去,
方案②:B中加入KSCN溶液,溶液不变血红色,再加入新制的氯水,溶液变血红。
方案③:C中加入稀盐酸酸化的BaCl2溶液,产生白色沉淀。
(1)上述实验方案中能证明该反应液有Fe2+生成的是_____________。
Ⅱ.氨气具有还原性,在加热时与氧化铜发生反应的化学方程式为:2NH3+3CuO N2+3Cu+3H2O
N2+3Cu+3H2O
某化学实验小组拟用下列仪器(可重复使用)证明氨气具有还原性,并检验生成的水。现提供浓氨水、氧化铜,若需其他试剂可自选。(连接和固定仪器用的胶管、铁夹、铁架台等装置均略去),请回答下列问题:
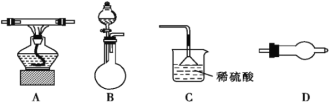
(2)上述仪器从左到右的连接顺序是__→D→__→D→__(填字母)。____________
(3)烧瓶中加入的固体试剂可以是___。
①生石灰 ②五氧化二磷 ③硫酸铜 ④氢氧化钠
(4)装置C中倒扣漏斗的作用是__________________。
(5)需重复使用的仪器D中所选用的固体药品依次是_____。
(6)实验中证明有水生成的现象是_______________________________
-
某课外兴趣小组探究利用废铜屑制取CuSO4溶液,设计了以下几种实验方案。完成下列填空:
(1)方案一:以铜和浓硫酸反应制备硫酸铜溶液。方案二:将废铜屑在空气中灼烧后再投入稀硫酸中。和方案一相比,方案二的优点是________________________;方案二的实验中,发现容器底部残留少量紫红色固体,再加入稀硫酸依然不溶解,该固体为________。
(2)方案三的实验流程如图所示。
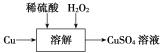
溶解过程中有气体放出,该气体是________。随着反应的进行,生成气体速率加快,推测可能的原因是________________________________________________________________________________。
(3)设计实验证明你的推测:______________________________。
方案四的实验流程如图所示。
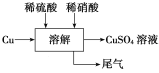
(4)为了得到较纯净的硫酸铜溶液,硫酸和硝酸的物质的量之比应为________;
(5)对方案四进行补充完善,设计一个既能防止污染,又能实现物料循环的实验方案(用流程图表示)__________________________________。








