-
已知25℃时有关弱酸的电离平衡常数见下表:
弱酸化学式
HA
H2B
电离平衡常数(25℃)
Ka=1.7×10-6
K1=1.3×10-3K2=5.6×10-8
则下列有关说法正确的是
A. 等物质的量浓度的各溶液pH关系为:PH(Na2B)>pH(NaHB)>pH(NaA)
B. 将a mol·L-1的HA溶液与a mol·L-1 的NaA溶液等体积混合,混合液中:C(Na+ )>C(A-)
C. 向Na2B溶液中加入足量的HA溶液发生反应的离子方程式为:B2-+2HA==2A- +H2B
D. NaHB溶液中部分微粒浓度的大小为:C(Na+)> C(HB-)> C(B2-)> C(H2B)
高二化学单选题困难题查看答案及解析
-
已知 25℃ 时有关弱酸的电离平衡常数:
弱酸化学式
CH3COOH
HCN
H2CO3
电离平衡常数(25℃)
1.8×10-5
4.9×10-10
Ka1=4.3×10-7
Ka2=5.6×10-11
则下列说法正确的是 ( )
A.等物质的量浓度的各溶液 pH 关系为:pH ( NaCN)>pH(Na2CO3)>pH( CH3COONa)
B.浓度均为0.2mol/LNaHCO3和 Na2CO3溶液中,存在的粒子种类不相同
C.0.4 mol·L-1HCN 溶液与 0.2 mol·L-1NaOH 溶液等体积混合后,所得溶液中:c(Na+)>c(OH-)>c(H+)
D.25℃ 时,pH=4且浓度均为0.1 mol·L-1的 CH3COOH、CH3COONa混合溶液中:
c(Na+)+c(H+)>c(CH3COO-)+c(CH3COOH)
高二化学选择题简单题查看答案及解析
-
已知25 ℃时有关弱酸的电离平衡常数如下表:
弱酸化学式
HF
CH3COOH
HClO
H2CO3
电离常数
6.8×10-4
1.7×10-5
4.7×10-8
K1=4.3×10-7
K2=5.6×10-11
下列推断正确的是
A.弱酸的酸性强弱:HF < HClO
B.同物质的量浓度NaClO与NaHCO3溶液,前者的pH较大
C.将碳酸钠粉末加入到0.1mol·L_1 HClO溶液中,不发生反应
D.中和等体积、等pH的HF和CH3COOH溶液,消耗等量的NaOH
高二化学选择题困难题查看答案及解析
-
下表是25℃时三种弱酸的电离平衡常数:
化学式
HA(A代表某种酸根)
HNO2
H2CO3
Ka
Ka=4.9×10-10
Ka=4.6×10-4
Ka1=4.1×10-7
Ka2=5.6×10-11
回答下列问题:
(1)用离子方程式表示NaNO2溶液呈碱性的原因____________________。
(2)A-、CO32-、HCO3-在水中结合H+的能力由大到小的顺序为____________。
(3)25℃时,等物质的量浓度的HA和NaA的混合溶液呈碱性,则该混合溶液中各离子浓度大小关系为________________,解释混合溶液呈碱性的原因_________________________________。
(4)写出NaA溶液中通少量CO2的离子方程式_______________________________________。
(5)某同学用Na2CO3和NaHCO3溶液进行如下图所示实验:

① 充分反应后a试管中大量存在的离子是_______________________________________。
② 用离子方程式表示b试管中发生的反应_______________________________________。
高二化学综合题中等难度题查看答案及解析
-
下表为25℃的三种弱酸的电离平衡常数:
化学式
HA(A代表某种酸根)
HNO2
H2CO3
Ka
Ka=4.9×10-10
Ka=4.6×10-4
Ka1=4.1×10-7
Ka2=5.6×10-11
回答下列问题:
(1)用离子方程式表示NaNO2溶液呈碱性的原因_________________________。
(2)A-、CO32-、HCO3-在水中结合H+的能力由大到小的顺序为_______________。
(3)写出NaA溶液中通少量CO2的离子方程式____________________。
(4)现有Na2CO3和NaHCO3两种白色固体物质,欲探究Na2CO3和NaHCO3稳定性的相对强弱,设计了以下实验:
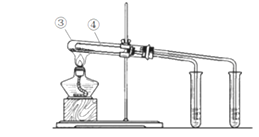
①如上图所示,试管④中装入的固体应该是_________(填化学式)。
②通过上述实验,得出的结论是:Na2CO3比NaHCO3的稳定性更_______(填“强”或“弱”)。
高二化学实验题中等难度题查看答案及解析
-
弱电解质在水溶液中的电离状况可以进行定量计算和推测。
(1)25℃时两种酸的电离平衡常数如表所示。
Ka1
Ka2
HA
1×10-4
H2B
1×10-2
5×10-6
①25℃时,0.100mol·L-1的NaA溶液中H+、OH-、Na+、A-、HA的物质的量浓度由大到小的顺序是:___。pH=8的NaA溶液中由水电离出的c(OH-)=___mol·L-1。
②25℃时,0.100mol·L-1的NaHB溶液pH___7,理由是___。
③25℃时,向0.100mol·L-1的Na2B溶液中滴加足量0.100mol·L-1的HA溶液,反应的离子方程式为___。
(2)已知25℃时,向0.100mol·L-1的H3PO4溶液中滴加NaOH溶液,各含磷微粒的物质的量分数随pH变化的关系如图所示。
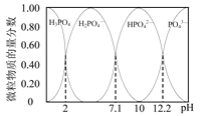
①当溶液pH由11到14时,所发生反应的离子方程式为:___。
高二化学综合题中等难度题查看答案及解析
-
弱酸HA的电离常数Ka=
。25 ℃时,几种弱酸的电离常数如下:
弱酸化学式
HNO2
CH3COOH
HCN
H2CO3
电离常数
5.1×10-4
1.8×10-5
6.2×10-10
K1=4.4×10-7 K2=4.7×10-11
(1)根据上表数据填空:
①物质的量浓度相同的四种酸,其pH由大到小的顺序是 。
②分别向等体积、相同pH的HCl溶液和CH3COOH溶液中加入足量的Zn粉,反应刚开始时产生H2的速率:v(HCl) v(CH3COOH)(填“=”、“>”或“<”下同),反应完全后,所得氢气的质量:m(H2)盐酸 m(H2)醋酸。
③将0.2 mol/L HCN溶液与0.1 mol/L Na2CO3溶液等体积混合,发生反应的化学方程式为__________________。
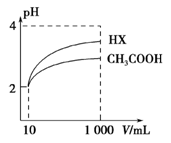
(2)体积均为10 mL、pH均为2的醋酸溶液与一元酸HX分别加水稀释至1 000 mL,稀释过程中溶液pH变化如图所示。稀释后,HX溶液中水电离的c(H+) 比醋酸溶液中水电离的c(H+) ;电离常数Ka(HX) Ka(CH3COOH)(填“>”、“=”或“<”),理由是 。
高二化学填空题困难题查看答案及解析
-
已知常温时下列物质的电离平衡常数和沉淀溶解平衡常数
(1)在等浓度的NaA、NaHB混合溶液 中c(A-)________ c(HB-)(填“>”、“<”或“=”)HA H2B HC MOH H2O Ka Ka1 Ka2 Ka Kb Kw 数值 1.8×10-5 4.3×10-7 5.6×10-11 4.9×10-10 1×10-6 1×10-14
(2)判断下列反应能发生的是________
A.HA+HB-(少量)=A-+H2B B.H2B(少量)+C-=HB-+HC C.HA(少量)+C-=A-+HC
(3)常温时,当MOH和盐酸混合恰好中和生成0.1mol•L-1MCl稀溶液,已知溶液的PH为4,则该溶液中MOH的平衡浓度为________mol•L-1.高二化学填空题中等难度题查看答案及解析
-
已知25℃时有关弱酸的电离平衡常数:
根据上述电离常数分析,下列错误的是( )弱酸化学式 CH3COOH HCN H2CO3 电离平衡常数(25℃) 1.8×10-5 4.9×10-10 K1=4.3×10-7
K2=5.6×10-11
A.25℃时,等物质的量浓度的各溶液pH关系为:pH(HCN)>pH(H2CO3)>pH(CH3COOH)
B.2NaCN+H2O+CO2=2HCN+Na2CO3
C.a mol/L HCN溶液与b mol/L NaOH溶液等体积混合后,所得溶液中c(Na+)=c(CN-),则a一定大于b
D.2CH3COOH+Na2CO3=2 CH3COONa+H2O+CO2↑高二化学选择题中等难度题查看答案及解析
-
已知25℃时有关弱酸的电离平衡常数:
弱酸化学式
CH3COOH
HCN
H2CO3
电离平衡常数(25℃)
1.8×10-5
4.9×l0-10
K1=4.3×10-7 K2=5.6×10-11
则下列有关说法正确的是
A.等物质的量浓度的各溶液pH关系为:pH(NaCN)>pH(Na2CO3)>pH(CH3COONa)
B.a mol·L-1 HCN溶液与b mol·L-1 NaOH溶液等体积混合后,溶液中c(Na+)>c(CN-),则a一定小于b
C.冰醋酸中逐滴加水,则溶液的导电性、n(H+)、pH均先增大后减小
D.NaHCO3和Na2CO3混合溶液中,存在c(Na+)+ c(H+)=c(OH—)+ c(HCO3-) +2c(CO32-)
高二化学选择题简单题查看答案及解析