-
(15分)物质的类别和核心元素的化合价是研究物质性质的两个重要视角。硫及其化合物与价态变化为坐标的二维转化关系如图所示。完成下列填空:
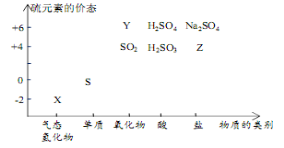
(1)图中X的水溶液在空气中放置易变浑浊,写出反应的化学方程式: ;
(2)下列物质用于Na2S2O3制备,从氧化还原反应的角度
分析,理论上有可能实现的方案是 (选填编号)。
a.Na2S + S b.Z + S c.Na2SO3 + Y d.NaHS + NaHSO3
(3)请补充完整焙烧明矾的化学方程式:
___KAl(SO4)2·12H2O +____S = ____K2SO4 + ____Al2O3 + ____SO2↑ +
(4)研究反应Na2S2O3 + H2SO4 == Na2SO4 + S↓ + SO2↑+ H2O的速率时,下列方案合理的是 (选填编号)。
a.测定一段时间内生成SO2的体积,得出该反应的速率
b.研究浓度、温度等因素对该反应速率的影响,比较反应出现浑浊的时间
c.用Na2S2O3(s)分别与浓、稀硫酸反应,研究浓度对该反应速率的影响
(5)治理含CO、SO2的烟道气,以铝钒土做催化剂,将CO、SO2在380℃时转化为S 和一种无毒气体。已知:①硫的熔点:112.8℃、沸点:444.6℃;
②反应每得到1mol硫,放出270kJ的热量。写出该治理烟道气反应的热化学方程式 。
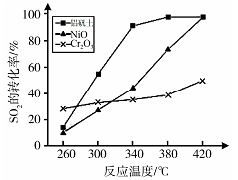
(6)其他条件相同、催化剂不同时,上述反应中SO2 的转化率随反应温度的变化如图。不考虑催化剂价格因素,生产中选铝矾土做催化剂的主要原因是 。
-
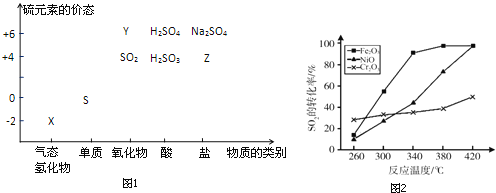
物质的类别和核心元素的化合价是研究物质性质的两个重要视角.硫及其化合物与价态变化为坐标的二维转化关系如图1所示.
完成下列填空:
(1)图中X的电子式为__;其水溶液在空气中放置易变浑浊,写出反应的化学方程式__;该变化说明S的非金属性比O__(填“强”或“弱”),从原子结构的角度解释原因:__.通过__(举两例),也可以判断氧、硫两种元素的非金属性强弱.
(2)下列物质用于Na2S2O3制备,从氧化还原反应的角度,理论上有可能的是__(选填编号).
a Na2S+S b Z+S c Na2SO3+Y d NaHS+NaHSO3
(3)已知反应:Na2S2O3+H2SO4→Na2SO4+S↓+SO2+H2O,研究其反应速率时,下列方案合理的是__(选填编号).
a 测定一段时间内生成SO2的体积,得出该反应的速率
b 研究浓度、温度等因素对该反应速率的影响,比较反应出现浑浊的时间
c 用Na2S2O3固体分别与浓、稀硫酸反应,研究浓度对该反应速率的影响
(4)治理含CO、SO2的烟道气,以Fe2O3做催化剂,将CO、SO2在380℃时转化为S和一种无毒气体.已知:①硫的熔点:112.8℃、沸点:444.6℃;②反应每得到1mol硫,放出270kJ的热量.写出该治理烟道气反应的热化学方程式__.
(5)其他条件相同、催化剂不同时,上述反应中SO2的转化率随反应温度的变化如图2.不考虑催化剂价格因素,生产中选Fe2O3做催化剂的主要原因是__.
-
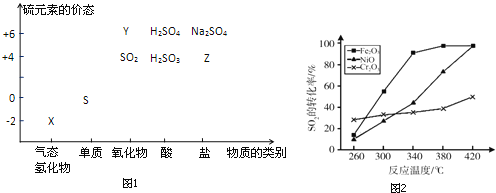
物质的类别和核心元素的化合价是研究物质性质的两个重要视角.硫及其化合物与价态变化为坐标的二维转化关系如图1所示.
完成下列填空:
(1)图中X的电子式为__;其水溶液在空气中放置易变浑浊,写出反应的化学方程式__;该变化说明S的非金属性比O__(填“强”或“弱”),从原子结构的角度解释原因:__.通过__(举两例),也可以判断氧、硫两种元素的非金属性强弱.
(2)下列物质用于Na2S2O3制备,从氧化还原反应的角度,理论上有可能的是__(选填编号).
a Na2S+S b Z+S c Na2SO3+Y d NaHS+NaHSO3
(3)已知反应:Na2S2O3+H2SO4→Na2SO4+S↓+SO2+H2O,研究其反应速率时,下列方案合理的是__(选填编号).
a 测定一段时间内生成SO2的体积,得出该反应的速率
b 研究浓度、温度等因素对该反应速率的影响,比较反应出现浑浊的时间
c 用Na2S2O3固体分别与浓、稀硫酸反应,研究浓度对该反应速率的影响
(4)治理含CO、SO2的烟道气,以Fe2O3做催化剂,将CO、SO2在380℃时转化为S和一种无毒气体.已知:①硫的熔点:112.8℃、沸点:444.6℃;②反应每得到1mol硫,放出270kJ的热量.写出该治理烟道气反应的热化学方程式__.
(5)其他条件相同、催化剂不同时,上述反应中SO2的转化率随反应温度的变化如图2.不考虑催化剂价格因素,生产中选Fe2O3做催化剂的主要原因是__.
-
物质的类别和核心元素的化合价是研究物质性质的两个基本视角。根据下图,完成下列填空:
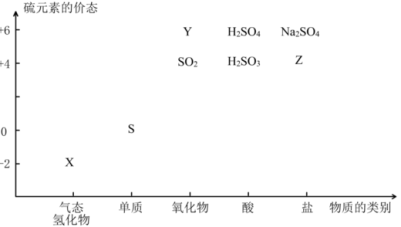
27.上图中X的电子式为 ;其水溶液长期在空气中放置容易变浑浊,用化学方程式表示该变化 ;该变化体现出硫元素的非金属性比氧元素 (填“强”或“弱”)。用原子结构解释原因 。
28.Na2S2O3是一种用途广泛的钠盐。下列物质用于Na2S2O3的制备,从氧化还原反应的角度,理论上有可能的是______(填字母序号)。
a.Na2S + S b.Z + S c.Na2SO3 + Y d.NaHS + NaHSO3
29.SO2是主要大气污染物之一。工业上烟气脱硫的方法之一是用碱液吸收,其流程如图:
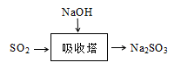 。
。
该法吸收快,效率高。若在操作中持续通入含SO2的烟气,则最终产物为________。室温下,0.1mol/L ①亚硫酸钠 ②亚硫酸氢钠 ③硫化钠 ④硫化氢钠的四种溶液的pH由大到小的顺序是________。(用编号表示)
已知:H2S:Ki1=1.3×10-7 Ki2=7.1×10-15 H2SO3:Ki1=1.3×10-2 Ki2=6.2×10-8
30.治理含CO、SO2的烟道气,也可以将其在催化剂作用下转化为单质S和无毒的气体:
2CO(g) + SO2 (g)  S(s) + 2CO2(g)。一定条件下,将CO与SO2以体积比为4∶1置于恒容密闭容器中发生上述反应,下列选项能说明反应达到平衡状态的是 (填写字母序号)。
S(s) + 2CO2(g)。一定条件下,将CO与SO2以体积比为4∶1置于恒容密闭容器中发生上述反应,下列选项能说明反应达到平衡状态的是 (填写字母序号)。
a.v (CO) ∶v(SO2) = 2∶1 b.平衡常数不变
c.气体密度不变 d.CO2和SO2的体积比保持不变
测得上述反应达平衡时,混合气体中CO的体积分数为 ,则SO2的转化率为 。
,则SO2的转化率为 。
-
物质类别和核心元素的价态是学习元素及其化合物性质的重要认识视角。如图是某元素的“价类二维图”,其中单质b是黄色固体,f、h均为正盐,且焰色都是黄色。下列说法不正确的是

A.d能使品红溶液褪色
B.a和c反应可以生成b
C.e的浓溶液可用铝槽车运输
D.h的水溶液呈碱性
-
物质的类别和核心元素的化合价是研究物质性质的两个基本视角。根据下图,完成下列填空:
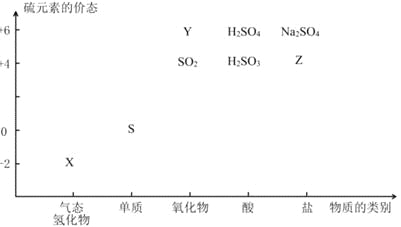
(1)上图中X的电子式为_________;其水溶液长期在空气中放置容易变浑浊,用化学方程式表示该变化__________;该变化体现出硫元素的非金属性比氧元素______(填“强”或“弱”)。用原子结构解释原因____________。
(2)Na2S2O3是一种用途广泛的钠盐。下列物质用于Na2S2O3的制备,从氧化还原反应的角度,理论上有可能的是______(填字母序号)。
a.Na2S+ S b.Z+ S c.Na2SO3 + Y d.NaHS + NaHSO3
(3)SO2是主要大气污染物之一。工业上烟气脱硫的方法之一是用碱液吸收,其流程如图: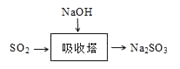 。
。
该法吸收快,效率高。若在操作中持续通入含SO2的烟气,则最终产物为________。室温下,0.1mol/L①亚硫酸钠 ②亚硫酸氢钠 ③硫化钠 ④硫氢化钠的四种溶液的pH由大到小的顺序是________(用编号表示)。
已知:H2S:Ki1=1.3×10-7 Ki2=7.1×10-15 H2SO3:Ki1=1.3×10-2 Ki2=6.2×10-8
(4)治理含CO、SO2的烟道气,也可以将其在催化剂作用下转化为单质S和无毒的气体:2CO(g) + SO2(g) S(s) + 2CO2(g)。一定条件下,将CO与SO2以体积比为4∶1置于恒容密闭容器中发生上述反应,下列选项能说明反应达到平衡状态的是______(填写字母序号)。
S(s) + 2CO2(g)。一定条件下,将CO与SO2以体积比为4∶1置于恒容密闭容器中发生上述反应,下列选项能说明反应达到平衡状态的是______(填写字母序号)。
a.υ (CO) ∶υ(SO2) = 2∶1 b.平衡常数不变
c.气体密度不变 d.CO2和SO2的体积比保持不变
测得上述反应达平衡时,混合气体中CO的体积分数为 ,则SO2的转化率为________。
,则SO2的转化率为________。
-
(16分)物质的类别和核心元素的化合价是研究物质性质的两个基本视角。
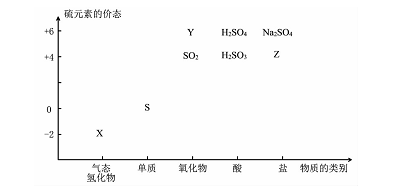
(1)图中X的电子式为 ;其水溶液长期在空气中放置容易变浑浊,该变化体现出:S非金属性比O (填“强”或“弱”)。用原子结构解释原因:同主族元素最外层电子数相同,从上到下, ,得电子能力逐渐减弱。
(2)Na2S2O3是一种用途广泛的钠盐。
①下列物质用于Na2S2O3的从氧化还原反应的角度制备, ,理论上有可能的是 (填字母序号)。
a.Na2S+S b.Z+S c.Na2SO3+Y d.NaHS+NaHSO3
②已知反应:Na2S2O3+H2SO 4Na2SO4+S↓+SO2↑+H2O。研究其反应速率时,下列说法正确的是 (填写字母序号)。
4Na2SO4+S↓+SO2↑+H2O。研究其反应速率时,下列说法正确的是 (填写字母序号)。
a.可通过测定一段时间内生成SO2的体积,得出该反应的速率
b.可通过比较出现浑浊的时间,研究浓度、温度等因素对该反应速率的影响
c.可通过Na2S2O3固体与稀硫酸和浓硫酸的反应,研究浓度对该反应速率的影响
(3)治理含CO、SO2的烟道气,可以将其在催化剂作用下转化为单质S和无毒的气体。
①已知:CO(g)+1/2O2(g)=CO2(g) △H=-283kJ·mol-1
S(s)+O2(g)=SO2(g) △H=-296kJ·mol-1
则治理烟道气反应的热化学方程式为 。
②一定条件下,将CO与SO2以体积比为4∶1置于恒容密闭容器中发生上述反应,下列选项能说明反应达到平衡状态的是 (填写字母序号)。
a.v(CO)∶v(SO2)=2∶1
b.平衡常数不变
c.气体密度不变
d.CO2和SO2的体积比保持不变
测得上述反应达平衡时,混合气体中CO的体积分数为 ,则SO2的转化率为 。
,则SO2的转化率为 。
(4)最近科学家提出“绿色自由”构想:把空气吹入碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使空气中的CO2转变为可再生燃料甲醇。甲醇可制作燃料电池。写出以氢氧化钾为电解质的甲醇燃料电池负极反应式 。
(5)某同学用沉淀法测定含有较高浓度CO2的空气中CO2的含量,经查得一些物质在20℃的数据如下表。
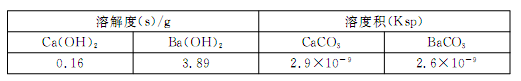
吸收CO2最合适的试剂是 (填“Ca(OH)2”或“Ba(OH)2”)溶液。
-
(14分)物质的类别和核心元素的化合价是研究物质性质的两个基本视角。
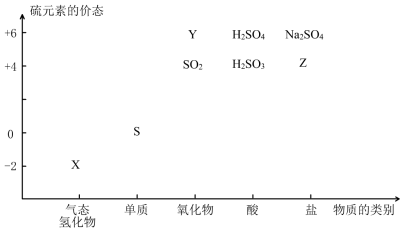
(1)图中X的电子式为 ;其水溶液长期在空气中放置容易变浑浊,该变化体现出:S非金属性比O (填“强”或“弱”)。用原子结构解释原因:同主族元素最外层电子数相同,从上到下, ,得电子能力逐渐减弱。
(2)Na2S2O3是一种用途广泛的钠盐。
①下列物质用于Na2S2O3的制备,从氧化还原反应的角度,理论上有可能的是______(填字母序号)。
a. Na2S + S b. Z + S c. Na2SO3 + Y d. NaHS + NaHSO3
②已知反应:Na2S2O3 + H2SO4 == Na2SO4 + S↓+SO2↑+H2O。研究其反应速率时,下列说法正确的是 (填写字母序号)。
a.可通过测定一段时间内生成SO2的体积,得出该反应的速率
b.可通过比较出现浑浊的时间,研究浓度、温度等因素对该反应速率的影响
c.可通过Na2S2O3固体与稀硫酸和浓硫酸的反应,研究浓度对该反应速率的影响
(3)治理含CO、SO2的烟道气,可以将其在催化剂作用下转化为单质S和无毒的气体。
已知:①CO(g)+ 1/2 O2(g)=CO2(g) △H=-283 kJ·mol-1
②S(s)+ O2(g)=SO2(g) △H=-296 kJ·mol-1
①则治理烟道气反应的热化学方程式为 。
②一定条件下,将CO与SO2以体积比为4∶1置于恒容密闭容器中发生上述反应,下列选项能说明反应达到平衡状态的是 (填写字母序号)。
a.v (CO) ∶v(SO2) = 2∶1
b.平衡常数不变
c.气体密度不变
d.CO2和SO2的体积比保持不变
测得上述反应达平衡时,混合气体中CO的体积分数为 ,则SO2的转化率为 。
,则SO2的转化率为 。
-
元素周期表是人们研究物质性质的重要工具.下表是元素周期表的一部分,A、B、C、D、E、X、Y是该表中给出元素组成的常见单质或化合物.
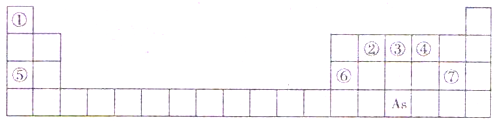
已知A、B、C、D、E、X存在如图所示转化关系(部分生成物和反应条件略去):
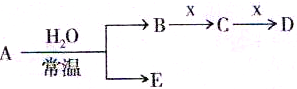
(1)As在周期表中的位置______;
(2)若E为单质气体,D为白色沉淀,A的化学式可能是______,B含有的化学键类型为______,B与X反应的离子方程式为______;
(3)若E为氧化物,X是碱性盐溶液,C为无色无味的气体,且C分子中有22个电子,则A的化学式为______,C的电子式为______,A与水反应的化学方程式为______;
(4)Y由④⑤⑦三种元素组成,它的水溶液是一种生活中常见的消毒剂.As可与Y的水溶液反应,生成As最高价含氧酸,该反应的化学方程式为______.
-
Ⅰ、物质变化观念是化学学科核心素养之一。已知a、b、c、d、e五种物质的相互转化关系如图所示,其中a、d、e为常见的单质,b、c为化合物。
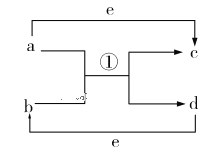
(1)若a、d为短周期非金属单质,且a、d所含元素同主族,a、e所含元素在不同周期。则b、c的沸点:b_________c(填“<”“>”或“=”);a和b反应生成两种氧化物的化学方程式为_________________。
(2)若a是常见的金属单质,点燃发出耀眼白光。d为固态非金属单质,熔点很高,其某种形态单质硬度极大,e为常见的气体单质,则a和b反应的化学方程式为________________________________。
(3)若a、d为常见的金属单质,它们与浓硝酸在加热条件下才能顺利反应。a既可以与强酸反应也可以与强碱反应,d在e中燃烧可以生成b。则足量的d与稀硝酸反应的离子方程式为__________________________________________。
Ⅱ、HNO2是一种弱酸,且不稳定,易分解生成NO和NO2;它能被常见的强氧化剂氧化;在酸性溶液中它也是一种氧化剂,如能把Fe2+氧化成Fe3+。AgNO2是一种难溶于水、易溶于酸的化合物。试回答下列问题:
(4)人体正常的血红蛋白含有Fe2+。若误食亚硝酸盐(如NaNO2)则导致血红蛋白中的Fe2+转化为Fe3+而中毒,服用维生素C可解毒。下列叙述不正确的是________(填字母)。
A.亚硝酸盐被还原 B.维生素C是还原剂
C.维生素C将Fe3+还原为Fe2+ D.亚硝酸盐是还原剂
(5)某同学把新制的氯水加到NaNO2溶液中,观察到氯水褪色,同时生成NaNO3和HCl,请写出反应的离子方程式:________________________________________________。





 。
。

 。
。




