-
下表是几种弱酸常温下的电离平衡常数:
| CH3COOH | H2CO3 | H2S | H3PO4 |
| 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=9.1×10-8 K2=1.1×10-12[ | K1=7.5×10-3 K2=6.2×10-8 K3=2.2×10-13 |
则下列说法中不正确的是( )
A.碳酸的酸性强于氢硫酸
B.多元弱酸的酸性主要由第一步电离决定
C.多元弱酸的各步电离之间无影响
D.向弱酸溶液中加少量NaOH溶液,电离常数不变
-
下表是几种弱酸常温下的电离平衡常数:
| CH3COOH | H2CO3 | H2S | H3PO4 |
| 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=9.1×10-8 K2=1.1×10-12 | K1=7.5×10-3 K2=6.2×10-8 K3=2.2×10-13 |
则下列说法中不正确的是( )
A. 碳酸的酸性强于氢硫酸
B. 常温下,加水稀释醋酸, 增大
增大
C. 多元弱酸的酸性主要由第一步电离决定
D. 向弱酸溶液中加少量NaOH溶液,电离常数不变
-
下表是几种弱酸常温下的电离平衡常数:
| CH3COOH | H2CO3 | H2S | H3PO4 |
| 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=9.1×10-8 K2=1.1×10-12 | K1=7.5×10-3 K2=6.2×10-8 K3=2.2×10-13 |
则下列说法中不正确的是( )
A. 碳酸的酸性强于氢硫酸
B. 多元弱酸的酸性主要由第一步电离决定
C. 常温下,加水稀释醋酸, 增大
增大
D. 向弱酸溶液中加少量NaOH溶液,电离常数不变
-
下表是几种弱酸常温下的电离平衡常数:
| CH3COOH | H2CO3 | H2S | H3PO4 |
| 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=9.1×10-8 K2=1.1×10-12 | K1=7.5×10-3 K2=6.2×10-8 K3=2.2×10-13 |
则下列说法中不正确的是( )
A. 碳酸的酸性强于氢硫酸
B. 多元弱酸的酸性主要由第一步电离决定
C. 常温下,加水稀释醋酸,c(CH3COO-)/c(CH3COOH)∙c(OH-)增大
D. 向弱酸溶液中加少量NaOH溶液,电离常数不变
-
下表是几种弱酸常温下的电离平衡常数:
| CH3COOH | H2CO3 | H2S | H3PO4 |
| 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=9.1×10-8 K2=1.1×10-12 | K1=7.5×10-3 K2=6.2×10-8 K3=2.2×10-13 |
则下列说法中不正确的是( )
A.碳酸的酸性强于氢硫酸
B.多元弱酸的酸性主要由第一步电离决定
C.常温下,加水稀释醋酸,电离平衡常数增大
D.向弱酸溶液中加少量NaOH溶液,电离平衡常数不变
-
下表是几种弱酸常温下的电离平衡常数:
| CH3COOH | H2CO3 | H2S | H3PO4 |
| 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=9.1×10-8 K2=1.1×10-12 | K1=7.5×10-3 K2=6.2×10-8 K3=2.2×10-13 |
则下列说法中不正确的是( )
A.碳酸的酸性强于氢硫酸
B.多元弱酸的酸性主要由第一步电离决定
C.常温下,加水稀释醋酸, 增大
增大
D.向弱酸溶液中加少量NaOH溶液,电离常数不变
-
下表是几种弱酸常温下的电离平衡常数:
| CH3COOH | H2CO3 | H2S | H3PO4 |
| 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=9.1×10-8 K2=1.1×10-12 | K1=7.5×10-3 K2=6.2×10-8 K3=2.2×10-13 |
(1)若把CH3COOH、H2CO3、HCO3-、H2S、HS-、H3PO4、H2PO4-、HPO42-都看成酸,则酸性最强的是 ,最弱的是 。
(2)多元弱酸的二级电离程度远小于一级电离的原因是 。
(3)同浓度的CH3COO-、HCO3—、CO32—、S2-结合H+的能力由强到弱的顺序为 。
(4)在温度相同时,各弱酸的K值不同,K值越大酸越 (填“强”或 “弱”)。
(5)根据K值大小判断下列反应能否发生:CH3COOH + H2PO4- (填“能”或“不能”,下同) H2CO3 + HS-
(填“能”或“不能”,下同) H2CO3 + HS- 。
。

-
I.下表是几种弱酸常温下的电离平衡常数:
| CH3COOH | H2CO3 | H2S | H3PO4 |
| 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=9.1×10-8 K2=1.1×10-12 | K1=7.5×10-3 K2=6.2×10-8 K3=2.2×10-13 |
(1)CH3COOH、H2CO3、H2S、H3PO4四种酸的酸性由强到弱的顺序为_______。
(2)多元弱酸的二级电离程度远小于一级电离的原因是_______。
(3)同浓度的CH3COONa、NaHCO3、Na2CO3、Na2S溶液的pH由大到小的顺序为_____。
II.(l)常温下,0.1 mol/LNaHCO3溶液的pH大于7,则溶液中c(H2CO3)______c(CO32-) (填“>”、“=”或“<”);常温下,己知0.1 mol/LNaHCO3溶液的pH等于8,则溶液中c(H2CO3)-c(CO32-)=______mol/L(写出计算数值结果)。
(2)c(NH4+)相等的①(NH4)2SO4 ②(NH4)HSO4③(NH4)2CO3④ NH4Cl四种溶液,其物质的量浓度由大到小的顺序为________。
(3)等体积等浓度的Ba(OH)2与NH4Cl的混合溶液中各种离子浓度大小关系为(由大到小排列)____________。
-
下表是几种弱酸常温下的电离平衡常数:
| CH3COOH | H2CO3 | H2S | H3PO4 |
| 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=9.1×10-8 K2=1.1×10-12 | K1=7.5×10-3 K2=6.2×10-8 K3=2.2×10-13 |
则下列说法中不正确的是( )
A. 碳酸的酸性强于氢硫酸
B. 多元弱酸的酸性主要由第一步电离决定
C. 常温下,加水稀释醋酸,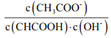 增大
增大
D. 向弱酸溶液中加少量 NaOH 溶液,电离常数不变
-
已知Ksp(CaCO3)=2.8×10-9及表中有关信息:
| 弱酸 | CH3COOH | H2CO3 |
| 电离平衡常数(常温) | Ka=1.8×10-5 | Ka1=4.3×10-7; Ka2=5.6×10-11 |
下列判断正确的是
A. 向Na2CO3溶液中滴入酚酞,溶液变红,主要原因是CO32-+2H2O H2CO3+2OH-
H2CO3+2OH-
B. 常温时,CH3COOH与CH3COONa混合溶液的pH=6,则c(CH3COOH)/c(CH3COO-)=18
C. NaHCO3溶液中:c(OH-)-c(H+)=c(H2CO3)-c(CO32-)
D. 2×10-4 mol/L的Na2CO3溶液与CaCl2溶液等体积混合出现沉淀,则CaCl2溶液的浓度一定是5.6×10-5 mol/L
(填“能”或“不能”,下同) H2CO3 + HS-
。
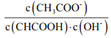 增大
增大