-
已知Ksp(CaCO3)=2.8×10-9及表中有关信息:
| 弱酸 | CH3COOH | H2CO3 |
| 电离平衡常数(常温) | Ka=1.8×10-5 | Ka1=4.3×10-7; Ka2=5.6×10-11 |
下列判断正确的是
A. 向Na2CO3溶液中滴入酚酞,溶液变红,主要原因是CO32-+2H2O H2CO3+2OH-
H2CO3+2OH-
B. 常温时,CH3COOH与CH3COONa混合溶液的pH=6,则c(CH3COOH)/c(CH3COO-)=18
C. NaHCO3溶液中:c(OH-)-c(H+)=c(H2CO3)-c(CO32-)
D. 2×10-4 mol/L的Na2CO3溶液与CaCl2溶液等体积混合出现沉淀,则CaCl2溶液的浓度一定是5.6×10-5 mol/L
-
已知Ksp(CaCO3)=2.8×10-9及表中有关信息:
| 弱酸 | CH3COOH | H2CO3 |
| 电离平衡 常数(常温) | Ka=1.8×10-5 | Ka1=4.3×10-7 Ka2=5.6×10-11 |
下列判断正确的是( )
A. 向Na2CO3溶液中滴入酚酞,溶液变红,原因是CO32-+2H2O H2CO3+2OH-
H2CO3+2OH-
B. 常温时,CH3COOH与CH3COONa混合溶液的pH=6,则 =18
=18
C. NaHCO3溶液中:c(OH-)-c(H+)=c(H2CO3)-c(CO32-)
D. 2×10-4mol·L-1的Na2CO3溶液与CaCl2溶液等体积混合出现沉淀,则CaCl2溶液的浓度一定是5.6×10-5mol·L-1
-
已知Ksp(CaCO3)=2.8×10-9及表中有关信息:
| 弱酸 | CH3COOH | H2CO3 |
| 电离平衡常数(常温) | Ka=1.8×10-5 | Ka1=4.3×10-7; Ka2=5.6×10-11 |
下列判断正确的是
A.向Na2CO3溶液中滴入酚酞,溶液变红,主要原因是CO32-+2H2O H2CO3+2OH-
H2CO3+2OH-
B.常温时,CH3COOH与CH3COONa混合溶液的pH=6,则c(CH3COOH)/c(CH3COO-)=18
C.NaHCO3溶液中:c(OH-)-c(H+)=c(H2CO3)-c(CO32-)
D.2×10-4 mol/L的Na2CO3溶液与CaCl2溶液等体积混合出现沉淀,则CaCl2溶液的浓度一定是5.6×10-5 mol/L
-
已知Ksp(CaCO3)=2.8×10-9及表中有关信息:
| 弱酸 | CH3COOH | H2CO3 |
| 电离平衡常数(常温) | Ka=1.8×10-5 | Ka1=4.3×10-7; Ka2=5.6×10-11 |
下列判断正确的是
A. 向Na2CO3溶液中滴入酚酞,溶液变红,主要原因是CO32-+2H2O H2CO3+2OH-
H2CO3+2OH-
B. 常温时,CH3COOH与CH3COONa混合溶液的pH=6,则 =18
=18
C. NaHCO3溶液中:c(OH-)-c(H+)=c(H2CO3)-c(CO32-)
D. 2×10-4 mol/L的Na2CO3溶液与CaCl2溶液等体积混合出现沉淀,则CaCl2溶液的浓度一定是5.6×10-5 mol/L
-
常温下,几种难溶电解质的溶度积和弱酸的电离常数如下表所示:
| CaSO4 | CaCO3 | MgCO3 | Mg(OH)2 | CuS | BaSO4 | H2S | H2CO3[] |
| KSP或Ka | 9.1х10-6 | 2.8х10-9 | 6.8х10-6 | 1.8х10-11 | 6.3х10-36 | 1.1х10-10 | Ka1=1.3х10-7 Ka2=7.1х10-15 | Ka1=4.4х10-7 Ka2=4.7х10-11 |
则下列说法不正确的是
A.相同温度、相同浓度的钠盐溶液的pH:Na2S>Na2CO3>NaHS>NaCl>NaHSO4
B.在NaHS溶液中滴加硫酸铜溶液,生成黑色沉淀:HS-+Cu2+===CuS↓+H+
C.除去锅炉中的水垢时,通常先加入足量硫酸钠溶液,将碳酸钙转化成硫酸钙,然后再用酸液处理
D.在Mg(HCO3)2溶液中滴加澄清石灰水发生反应的离子方程式为Mg2++2HCO+2Ca2++4OH-===Mg(OH)2↓+2CaCO3↓+2H2O
-
已知25℃时,有关弱酸的电离平衡常数:
| 弱酸 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数 | 1.8×10-5 | 4.9×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 |
则下列有关说法不正确的是
A.25℃时,0.1mol·L-1溶液的pH关系为:pH(NaCN)>pH(Na2CO3)>pH(CH3COONa)
B.25℃时,pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,c(H+)相等
C.25℃时,同浓度的醋酸和氢氧化钠等体积混合,所得溶液pH=8,则c(Na+)-c(CH3COO-)=9.9×10-7
D.NaHCO3和Na2CO3混合溶液中,一定有c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-)
-
已知25℃时,有关弱酸的电离平衡常数:
| 弱酸 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数 | 1.8×10-5 | 4.9×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 |
则下列有关说法不正确的是
A.25℃时,0.1mol·L-1溶液的pH关系为:pH(NaCN)>pH(Na2CO3)>pH(CH3COONa)
B.25℃时,pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,c(H+)相等
C.25℃时,同浓度的醋酸和氢氧化钠等体积混合,所得溶液pH=8,则c(Na+)-c(CH3COO-)=9.9×10-7
D.NaHCO3和Na2CO3混合溶液中,一定有c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-)
-
已知:下表为25℃时某些弱酸的电离平衡常数。
| CH3COOH | HClO | H2CO3 |
| Ka=1.8×10﹣5 | Ka=3.0×10﹣8 | Ka1=4.4×10﹣7Ka2=4.7×10﹣11 |
如图表示常温下,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化.下列说法正确的是( )
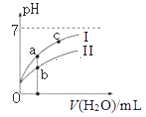
A.Ⅰ曲线代表 HClO,Ⅱ曲线代表CH3COOH
B.向NaClO溶液中通入少量二氧化碳的离子方程式为:ClO﹣+CO2+H2O=HClO+CO32-
C.图象中a、c两点处的溶液中 相等(HR代表CH3COOH或HClO)
相等(HR代表CH3COOH或HClO)
D.图象中a点酸的总浓度大于b点酸的总浓度
-
已知:下表为25℃时某些弱酸的电离平衡常数。
| CH3COOH | HClO | H2CO3 |
| Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.4×10-7 Ka2=4.7×10-11 |
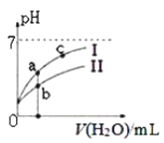
图中表示常温下,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化。下列说法正确的是( )
A. 相同浓度的CH3COONa和NaClO的混合溶液中,各离子浓度的大小关系是:c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+)
B. 向NaClO溶液中通入少量二氧化碳的离子方程式为:2ClO-+CO2+H2O=2HClO+CO32-
C. 图像中a、c两点处的溶液中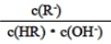 相等(HR代表CH3COOH或HClO)
相等(HR代表CH3COOH或HClO)
D. 图像中a点酸的总浓度大于b点酸的总浓度
-
已知:下表为25℃时某些弱酸的电离平衡常数。
| CH3COOH | HClO | H2CO3 |
| Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.4×10-7 Ka2=4.7×10-11 |
下图表示常温下,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化。下列说法正确的是( )

A.相同浓度的CH3COONa和NaClO的混合溶液中,各离子浓度的大小关系是:c(Na+)> c(ClO-)> c(CH3COO-)> c(OH-)> c(H+)
B.向NaClO溶液中通入少量二氧化碳的离子方程式为:ClO-+CO2+ H2O =HClO+CO32-
C. 图像中a点酸的总浓度大于b点酸的总浓度
D. 图像中a、c两点处的溶液中 相等(HR代表CH3COOH或HClO)
相等(HR代表CH3COOH或HClO)
H2CO3+2OH-


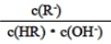 相等(HR代表CH3COOH或HClO)
相等(HR代表CH3COOH或HClO)
 相等(HR代表CH3COOH或HClO)
相等(HR代表CH3COOH或HClO)