-
氮化硅(Si3N4)是一种重要的陶瓷材料,可用石英与焦炭在1400~1450℃的氮气气氛下合成:3SiO2(s)+6C(s)+2N2(g) Si3N4(s)+6CO(g)﹣Q(Q>0),在反应条件下,向10L密闭容器中加入反应物,10min后达到平衡。完成下列填空:
Si3N4(s)+6CO(g)﹣Q(Q>0),在反应条件下,向10L密闭容器中加入反应物,10min后达到平衡。完成下列填空:
(1)上述反应所涉及的元素,原子半径由大到小的顺序是______。其中一种元素的原子核外s电子数与p电子数相等,写出它的最外层电子排布的轨道表示式______。比较碳、硅两种元素的非金属性强弱,可以通过比较______(填:化合物性质的差异)来判断
(2)上述反应混合物中的极性分子是______,写出非极性分子的电子式______。从晶体类型的角度分析用氮化硅制造发动机中耐热部件的原因是______
(3)下列措施可以提高二氧化硅转化率的是______(选填编号)
a.增加二氧化硅用量b.升高反应温度
c.增大气体压强 d.向反应容器中多充入氮气
(4)下列描述中能说明反应已达平衡的是______(选填编号)
a.c(CO)=3c(N2)
b.v (CO)=3v(N2)
c. 保持不变
保持不变
d.气体的压强保持不变
(5)测得平衡时固体质量减少了11.2g,则用氮气表示的平均反应速率为______
-
氮化硅(Si3N4)是一种重要的陶瓷材料,可用石英与焦炭在1400~1450℃的氮气气氛下合成:3SiO2(s)+6C(s)+2N2(g) Si3N4(s)+6CO(g)-Q(Q>0)。在一定条件下,向10L密闭容器中加入反应物,10min后达到平衡。
Si3N4(s)+6CO(g)-Q(Q>0)。在一定条件下,向10L密闭容器中加入反应物,10min后达到平衡。
完成下列填空:
(1)上述反应所涉及的元素,原子半径由大到小的顺序是_____。其中一种元素的原子核外s电子数与p电子数相等,写出它的核外电子排布式______。
(2)上述反应混合物中的极性分子是______,写出非极性分子的电子式______。分析用氮化硅制造轴承和发动机中耐热部件的原因是:______。
(3)下列措施可以提高二氧化硅转化率的是______(选填编号)。
a.增加焦炭用量 b.升高反应温度
c.增大气体压强 d.向反应容器中多充入氮气
(4)下列描述中能说明反应已达平衡的是______(选填编号)。
a.c(CO)=3c(N2) b.v(CO)=3v(N2)
c.容器内气体的密度不变 d.气体的压强保持不变
(5)该反应的平衡常数为____,平衡后增加氮气浓度,平衡向______(填“正反应”或“逆反应”)方向移动,K值____(填“变大”“变小”或“不变”)。若测得平衡时气体质量增加了11.2g,则用氮气表示的平均反应速率为_____。
-
氮化硅(Si3N4)耐高温、硬度大,可用石英与焦炭在1400~1450℃的氮气中合成:3SiO2(s)+6C(s)+2N2(g)=Si3N4(s)+6CO(g)-Q(Q>0),在一定条件下,向10L密闭容器中加入反应物,10min后达到平衡。完成下列问题:
(1)上述反应所涉及的属于第三周期的元素,其原子的最外层电子轨道表示式为______。其中一种元素的原子核外s电子数与p电子数相等,其原子的核外电子能量不同的有_____种。
(2)上述反应混合物中的极性分子是______,写出非极性分子的电子式________。分析用氮化硅制造轴承和发动机中耐热部件的原因是___________。
(3)该反应的平衡常数表达式为__________。可以提高二氧化硅转化率的措施是________(任写一条),该措施对平衡常数的影响为__________(填“增大”、“减小”或“保持不变”)。
(4)测得平衡时固体质量减少了5.6g,则用氮气表示的平均反应速率为__________。
-
【化学—选修3:物质结构与性质】含氮化合物在生活中应用十分广泛。神州飞船外壳使用了氮化硅新型陶瓷结构材料,该材料硬度大、耐磨损。可用石英与焦炭在1400~1450℃的氮气气氛下合成氮化硅,同时生成一种与氮气结构相似的气态分子。
(1)写出上述反应的化学方程式____________________________________。反应原料中涉及的元素电负性由大到小的排列顺序为________________________________。
(2)基态氮原子中的原子轨道形状有 _______________种。
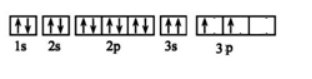
(3)某同学画出了硅原子基态的核外电子排布图如下图,该电子排布违背了 原理。
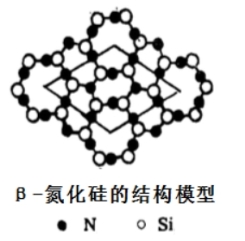
(4)氮化硅有多种型体,其中β-氮化硅层状结构模型如图,以图中所示的平行四边形为基本重复单元无限伸展,则该基本单元中含氮原子______个,硅原子______个。
(5)含氮的有机化合物氨基乙酸H2NCH2COOH中的碳 原子杂化方式有____________,σ与π键的个数比为_______________。
(6)氨分子是一种常见的配体。Cu2+离子在水溶液中以 [Cu (H2O)4]2+形式存在,向含Cu 2+离子的溶液中加入足量氨水,可生成更稳定的[Cu(NH3)4]2+离子,其原因是 。某配合物的化学式为 CoCl3·4NH3, 内界为正八面体构型配离子。0.1 mol该化合物溶于水中,加入过量 AgNO3,有14.35g 白色沉淀生成。则它的中心离子价电子排布式为____________,內界可能的结构有__________种。
-
氮化硅(Si3N4)是一种新型陶瓷材料,它可在高温下的氮气流中由石英与焦炭通过以下反应制得:3SiO2(s) + 6C(s) + 2N2(g) Si3N4(s) + 6CO(g) + Q(Q>0)
Si3N4(s) + 6CO(g) + Q(Q>0)
完成下列填空:
(1)某温度下该反应在一容积为2L的密闭容器中进行,2min后达到平衡,刚好有2mol电子发生转移,则2min内反应的速率为:v(CO) = ________;该反应的平衡常数表达式为 ________。
(2)其它条件不变时仅增大压强,则________。
a.K值减小,平衡向逆反应方向移动
b.K值增大,平衡向正反应方向移动
c.K值不变,平衡向逆反应方向移动
d.K值不变,平衡向正反应方向移动
(3)一定条件下能说明上述反应已达平衡的是 ________。
a.c(N2 ) : c(CO) = 1:3 b.3v(N2 ) = v(CO)
c.固体质量不再改变 d.气体密度不再改变
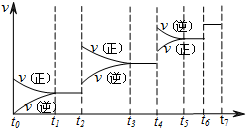
达到平衡后改变某一条件,反应速率v与时间t的关系如图所示。
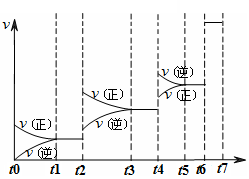
若不改变N2与CO的量,则图中t4时引起变化的原因可能是 ________;图中t6时引起变化的原因可能是________。
由图可知,平衡混合物中CO含量最高的时间段是________。
-
氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:3SiO2(s)+6C(s)+2N2(g)
 Si3N4(s)+6CO(g)
Si3N4(s)+6CO(g)
(1)该反应的平衡常数表达式为K=______;
(2)若知上述反应为放热反应,则升高温度,其平衡常数值______(选填“增大”、“减小”
或“不变”); 若已知CO生成速率为v(CO)=18mol•L-1•min-1,则N2消耗速率为v(N2)=______.
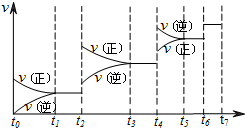
(3)达到平衡后,改变某一外界条件,反应速率v与时间t的关系如图:
若不改变N2、CO的量,则图中t4时引起平衡移动的条件可能是______;图中t6时引起变化的条件是______;图中表示平衡混合物中CO的含量最高的一段时间是______.
-
氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:3SiO2(s)+6C(s)+2N2(g)
 Si3N4(s)+6CO(g)
Si3N4(s)+6CO(g)
(1)该反应的平衡常数表达式为K=______;
(2)若知上述反应为放热反应,则升高温度,其平衡常数值______(选填“增大”、“减小”
或“不变”); 若已知CO生成速率为v(CO)=18mol•L-1•min-1,则N2消耗速率为v(N2)=______.
(3)达到平衡后,改变某一外界条件,反应速率v与时间t的关系如图:
若不改变N2、CO的量,则图中t4时引起平衡移动的条件可能是______;图中t6时引起变化的条件是______;图中表示平衡混合物中CO的含量最高的一段时间是______.
-
氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:
3SiO2(s)+6C(s)+2N2(g) Si3N4(s)+6CO(g)
Si3N4(s)+6CO(g)
(1)该反应的氧化剂是______,其还原产物是______;
(2)该反应的平衡常数表达式为 K=______;
(3)若知上述反应为放热反应,则其反应热△H______0(填“>”、“<”或“=”);升高温度,其平衡常数值______(填“增大”、“减小”或“不变”); 若已知CO生成速率为v(CO)=18mol•L-1•min-1,则N2消耗速率为v(N2)=______.
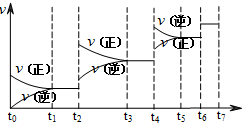
(4)达到平衡后,改变某一外界条件(不改变N2、CO的量),反应速率v与时间t的关系如图.
图中t4时引起平衡移动的条件可能是______;图中表示平衡混合物中CO的含量最高的一段时间是______.
(5)若该反应的平衡常数为K=729,则在同温度下1L密闭容器中,足量的SiO2和C与2mol N2充分反应,则N2的转化率是多少?(写出计算过程) 提示:272=729.
-
(16分)氮化硅(Si3N4)是一种新型陶瓷材料,它可由SiO2与过量焦炭在1300-1700oC的氮气流中反应制得3SiO2(s)+6C(s)+2N2(g) Si3N4(s)+6CO(g)
Si3N4(s)+6CO(g)
(1)已知该反应每转移1mole—,放出132.6kJ的热量,该方程式的∆H =________。
(2)能判断该反应(在体积不变的密闭容器中进行)已经达到平衡状态的是 ________。
A.焦炭的质量不再变化 B.N2 和CO速率之比为1:3
C.生成6molCO同时消耗1mol Si3N4 D.混合气体的密度不再变化
(3)下列措施中可以促进平衡右移的是 ________。
A.升高温度 B.降低压
C.加入更多的SiO2 D.充入N2
(4) 某温度下,测得该反应中N2和CO各个时刻的浓度如下,
| 时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 | 35 | 40 | 45 |
| N2浓度/mol·L-1[ | 4.00 | 3.70 | 3.50 | 3.36 | 3.26 | 3.18 | 3.10 | 3.00 | 3.00 | 3.00 |
| CO浓度/mol·L-1 | 0.00 | 0.90 | 1.50 | 1.92 | 2.22 | 2.46 | 2.70 | — | — | — |
求0—20 min内N2的平均反应速率V(N2 )=________ ,该温度下,反应的平衡常数K=________。
-
(16分) 氮化硅(Si3N4)是一种新型陶瓷材料,它可由SiO2与过量焦炭在1300-1700oC的氮气流中反应制得3SiO2(s)+6C(s)+2N2(g) Si3N4(s)+6CO(g)
Si3N4(s)+6CO(g)
(1)上述反应氧化剂是________,已知该反应每转移1mole—,放出132.6kJ的热量,该方程式的∆H =________。
(2)能判断该反应(在体积不变的密闭容器中进行)已经达到平衡状态的是( )
A.焦炭的质量不再变化 B.N2 和CO速率之比为1:3
C.生成6molCO同时消耗1mol Si3N4 D.混合气体的密度不再变化
(3)下列措施中可以促进平衡右移的是( )
A.升高温度 B.降低压强 C.加入更多的SiO2 D.充入N2
(4)该反应的温度控制在1300-1700oC的原因是________。
(5)某温度下,测得该反应中N2和CO各个时刻的浓度如下,求0—20 min内N2的平均反应速率________ ,该温度下,反应的平衡常数K=________。
| 时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 | 35 | 40 | 45 |
| N2浓度/mol·L-1 | 4.00 | 3.70 | 3.50 | 3.36 | 3.26 | 3.18 | 3.10 | 3.00 | 3.00 | 3.00 |
| CO浓度/mol·L-1 | 0.00 | 0.90 | 1.50 | 1.92 | 2.22 | 2.46 | 2.70 | | | |
Si3N4(s)+6CO(g)-Q(Q>0)。在一定条件下,向10L密闭容器中加入反应物,10min后达到平衡。





