-
碳酸亚铁(FeCO3)是菱铁矿的主要成分,将FeCO3加热到200℃开始分解为FeO和CO2,若在空气中高温煅烧FeCO3则生成Fe2O3。据报道,一定条件下Fe2O3可被甲烷还原为“纳米级”的金属铁。其反应为:Fe2O3(s) + 3CH4(g) 2Fe(s) + 3CO(g) + 6H2(g)-Q
2Fe(s) + 3CO(g) + 6H2(g)-Q
(1)原子序数为26的铁元素位于元素周期表的第________周期__________族。
(2)反应在5L的密闭容器中进行,2min后达到平衡,测得Fe2O3在反应中质量减少4.8g。则该段时间内H2的平均反应速率为____________________。
(3)将固定质量的Fe2O3(s)和CH4(g)置于恒温恒压容器中,在一定条件下反应,能表明该反应达到平衡状态的是__________________。
A、CH4的转化率等于CO的产率
B、混合气体的平均相对分子质量不变
C、v正(CO):v逆(H2)=1︰2
D、固体的总质量不变
(4)FeO可用CO进行还原,已知:t℃时, FeO(s) +CO(g)  Fe(s) + CO2(g) K=0.5若在1 L密闭容器中加入0.04 mol FeO(s),并通入x molCO,t℃时反应达到平衡。此时FeO(s)的转化率为50%,则x=__________________________。
Fe(s) + CO2(g) K=0.5若在1 L密闭容器中加入0.04 mol FeO(s),并通入x molCO,t℃时反应达到平衡。此时FeO(s)的转化率为50%,则x=__________________________。
(5)Fe2O3还可用来制备FeCl3 ,FeCl3在水溶液中的水解分三步:
Fe3+ + H2O Fe(OH)2+ + H+ K1
Fe(OH)2+ + H+ K1
Fe(OH)2+ + H2O Fe(OH)2+ + H+ K2
Fe(OH)2+ + H+ K2
Fe(OH)2+ + H2O Fe(OH)3 + H+ K3
Fe(OH)3 + H+ K3
以上水解反应的平衡常数K1、K2、K3由大到小的顺序是____________________。
(6)通过控制条件,以上水解产物聚合生成聚合物的离子方程式为:xFe3++yH2O Fex(OH)(3x-y)+ y+yH+,欲使平衡正向移动可采用的方法是_________________________(填字母 )。
Fex(OH)(3x-y)+ y+yH+,欲使平衡正向移动可采用的方法是_________________________(填字母 )。
A、加水稀释 B、加入少量NaCl固体
C、升温 D、加入少量Na2CO3固体
-
碳酸亚铁(FeCO3)是菱铁矿的主要成分,将其隔绝空气加热到200℃开始分解为FeO和CO2,若将其在空气中高温煅烧则生成Fe2O3。
(1)已知25℃,101kPa时:①C(s)+O2(g)=CO2(g) △H=-393 kJ·mol-1
②铁及其化合物反应的焓变示意图如右图:

请写出FeCO3在空气中煅烧生成Fe2O3的热化学方程式 。
(2)据报道,一定条件下Fe2O3可被甲烷还原为“纳米级”的金属铁。其反应为:
Fe2O3(s)+3CH4(g)  2Fe(s) + 3CO(g)+6H2(g) △H
2Fe(s) + 3CO(g)+6H2(g) △H
①反应在3L的密闭容器中进行,2min后达到平衡,测得Fe2O3在反应中质量减少4.8g,则该段时间内用H2表示该反应的平均反应速率为 。
②将一定量的Fe2O3(s)和3CH4(g)置于恒温恒容密闭容器中,在一定条件下反应,能说明反应达到平衡状态的是 。
A.CO和H2的物质的量之比为1:2 B.混合气体的密度不再改变
C.铁的物质的量不再改变 D.v正(CO)= 2v逆(H2)
③在容积均为VL的I、II、III三个相同密闭容器中加入足量“纳米级”的金属铁,然后分别充入a mol CO和2a mol H2,三个容器的反应温度分别为T1、T2、T3且恒定不变,在其他条件相同的情况下,实验测得反应均进行到t min时CO的体积分数如图所示,此时I、II、III三个容器中一定处于化学平衡状态的是 ;上述反应的△H 0(填“大于”或“小于”)。
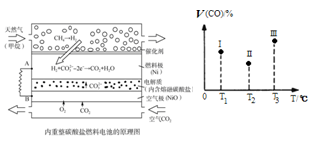
④甲烷经重整催化作用提供反应气的燃料电池如右图(以熔融Li2CO3 和K2CO3为电解质)。则正极电极反应式为 ,以此电池为电源电解精炼铜,当有0.1 mol e- 转移时,有 3.2 g铜溶解(填“>”、“<” 或“=”)。
(3)Fe2O3用CO还原焙烧的过程中,反应物、生成物和温度之 间的关系如右图所示。

若在800 ℃,混合气体中CO2体积分数为40%的条件下,Fe2O3用CO还原焙烧,写出反应的化学方程式为 。
(4)Fe2O3还可以用来制备FeCl3,通过控制条件FeCl3可生成聚合物,其离子方程式为:x Fe3++y H2O Fex(OH)y(3x-y)++y H+下列措施不能使平衡正向移动的是 (填序号)
Fex(OH)y(3x-y)++y H+下列措施不能使平衡正向移动的是 (填序号)
A.加水稀释 B.加入少量铁粉 C.升温 D.加入少量Na2CO3
-
碳酸亚铁(FeCO3)是菱铁矿的主要成分,将其隔绝空气加热到200 ℃开始分解为FeO和CO2,若将其在空气中高温煅烧则生成Fe2O3。
(1)已知25 ℃、101 kPa时:
①C(s)+O2(g)=CO2(g) ΔH=-393 kJ·mol-1
②铁及其化合物反应的焓变示意图如图:
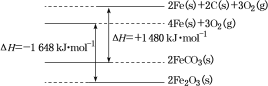
请写出FeCO3在空气中煅烧生成Fe2O3的热化学方程式:___________。
(2)据报道,一定条件下Fe2O3可被甲烷还原为“纳米级”的金属铁。其化学方程式为Fe2O3(s)+3CH4(g) 2Fe(s)+3CO(g)+6H2(g) ΔH
2Fe(s)+3CO(g)+6H2(g) ΔH
①反应在3 L的密闭容器中进行,2 min后达到平衡,测得Fe2O3在反应中质量减少4.8 g,则该段时间内用H2表示该反应的平均反应速率为________________。
②将一定量的Fe2O3(s)和CH4(g )置于恒温恒容密闭容器中,在一定条件下反应,能说明反应达到平衡状态的是____________。
A CO和H2的物质的量之比为1∶2
B 混合气体的密度不再改变
C 铁的物质的量不再改变
D v正(CO)=2v逆(H2)
③在容积均为V L的Ⅰ、Ⅱ、Ⅲ三个相同的密闭容器中加入足量“纳米级”的金属铁,然后分别充入a mol CO和2a mol H2,三个容器的反应温度分别为T1、T2、T3且恒定不变,在其他条件相同的情况下,实验测得反应均进行到t min时,CO的体积分数如图所示,此时Ⅰ、Ⅱ、Ⅲ三个容器中一定处于化学平衡状态的是________;上述反应的ΔH________0(填“大于”或“小于”)。

(3)Fe2O3用CO还原焙烧的过程中,反应物、生成物和温度之间的关系如图所示。
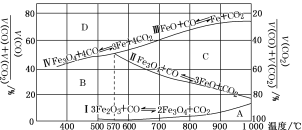
(图中Ⅰ、Ⅱ、Ⅲ、Ⅳ四条曲线是四个化学反应平衡时的气相组成对温度作图得到的;A、B、C、D四个区域分别是Fe2O3、Fe3O4、FeO、Fe稳定存在的区域)
若在800 ℃,混合气体中CO2体积分数为40%的条件下,Fe2O3用CO还原焙烧,写出反应的化学方程式:__________。
(4)Fe2O3还可以用来制备FeCl3,通过控制条件FeCl3可生成聚合物,其离子方程式为xFe3++yH2O Fex(OH)
Fex(OH) +yH+。下列措施不能使平衡正向移动的是________(填字母)。
+yH+。下列措施不能使平衡正向移动的是________(填字母)。
A 加水稀释 B 加入少量铁粉
C 升温 D 加入少量Na2CO3
-
碳酸亚铁(FeCO3)是菱镁矿的主要成分,将FeCO3加热到200℃开始分解为FeO和CO2,若在空气中高温煅烧FeCO3生成Fe2O3。
I.已知25℃,101kPa时:4Fe(s)+3O2(g)=2Fe2O3(s) △H=-1648kJ/mol
C(s)+ O2(g)=CO2(g) △H=-393 kJ/mol 2FeCO3(s)=2Fe(s)+ 3O2(g) △H=+148OkJ/mol
(1)请写出FeCO3在空气中煅烧生成Fe2O3的热化学方程式_______。
Ⅱ.生成的FeO和Fe2O3在一定条件下被还原为金属铁。
(2)据报道一定条件下Fe2O3可被甲烷还原为“纳米级”的金属铁。其反应为:
Fe2O3(s)+3CH4(g)=2Fe(s)+3CO(g)+6H2(g) △H>0
① 原子序数为26的铁元素位于元素周期表的第_______周期。
②反应在5L的密闭容器中进行,2min后达到平衡,测得Fe2O3在反应中质量消耗4.8g。则该段时间内用H2表达的平均反应速率为____________。
③将一定量的Fe2O3(s)和一定量的CH4(g)置于恒温恒压容器中,在一定条件下反应,能表明该反应达到平衡状态的是___________。
a.CH4的转化率等于CO的产率 b.混合气体的平均相对分子质量不变
c.v正(CO):v逆(H2)=1:2 d.固体的总质量不变
(3)FeO可用CO进行还原,已知:t℃时,FeO(s)+CO(g) Fe(s)+CO2(g),K=0.5,若在1L密闭容器中加入0.04mol FeO(s),并通入xmolCO,t℃时反应达到平衡。此时FeO(s)的转化率为50%,则x=_______。
Fe(s)+CO2(g),K=0.5,若在1L密闭容器中加入0.04mol FeO(s),并通入xmolCO,t℃时反应达到平衡。此时FeO(s)的转化率为50%,则x=_______。
Ⅲ. Fe2O3还可用来制备FeCl3,FeCl3在水溶液中的水解分三步:
Fe3++H2O Fe(OH)2++H+ K1
Fe(OH)2++H+ K1
Fe(OH)2++ H2O Fe(OH)2++H+ K2
Fe(OH)2++H+ K2
Fe(OH)2++ H2O Fe (OH)3+H+ K3
Fe (OH)3+H+ K3
(4)以上水解反应的平衡常效K1、K2、K3由大到小的顺序是_______。通过控制条件,以上水解产物聚合生成聚合物的离子方程式为:xFe3++yH2O===Fex(OH)y(3x-y)++yH+
欲使平衡正向移动可采用的方法是__________(填字母)
a.加水稀释 b.加入少量NaCl固体 c.升温 d.加入少量Na2CO3固体
-
利用硫铁矿烧渣(主要成分为Fe2O3、FeO、SiO2等)制备铁红,大致生产过程如下:
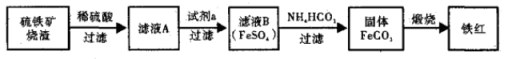
请回答:
⑴检验滤液A 中含有Fe2+的方法是 。
⑵滤液A→B发生反应的离子方程式为 。
⑶在空气中煅烧FeCO3的方程式为 。
-
铁的化合物有广泛用途,如碳酸亚铁(FeCO3)可作为补血剂,铁红(Fe2O3)可作为颜料。利用某硫酸厂产生的烧渣(主要含Fe2O3、FeO,还有一定量的SiO2)制备FeCO3的流程如下:
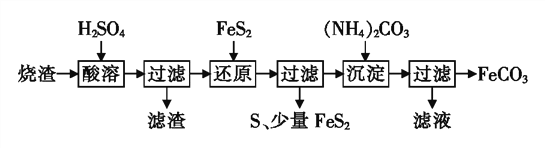
(1)“酸溶”时加快反应速率的方法有______(写出一种)。
(2)①“还原”时,FeS2与H2SO4不反应,Fe3+通过两个反应被还原,其中一个反应如下:
FeS2+14Fe3++8H2O 15Fe2++2S
15Fe2++2S +16H+,则另一个反应的离子方程式为_________。
+16H+,则另一个反应的离子方程式为_________。
②加入FeS2还原后,检验Fe3+是否反应完全的方法是______________________。
(3)①“沉淀”时,需要控制温度在35 ℃以下,其可能原因是___________________。
②所得FeCO3需充分洗涤,检验沉淀已洗净的方法是______________。
(4)FeCO3浊液长时间暴露在空气中,会有部分固体表面变为红褐色,同时释放出CO2,则与FeCO3反应的物质为_______(填化学式)。
(5)写出在空气中煅烧FeCO3制备高纯氧化铁的化学方程式:_________________。FeCO3在空气中煅烧生成Fe2O3时,也会生成FeO。现煅烧23.2 kg的FeCO3,得到Fe2O3和FeO的混合物15.84 kg,则Fe2O3的质量为____kg。
-
铁的化合物有广泛用途,如碳酸亚铁(FeCO3)可作为补血剂,铁红(Fe2O3)可作为颜料。利用某硫酸厂产生的烧渣(主要含Fe2O3、FeO,还有一定量的SiO2)制备碳酸亚铁的流程如下:

(1)“酸溶”时加快反应速率的方法有___________________(写出一种)。
(2)①“还原”时,FeS2与H2SO4不反应,Fe3+通过两个反应被还原,其中一个反应如下:FeS2 +14Fe3+ +8H2O=15Fe2++2SO42-+16H+,则另一个反应的离子方程式为:___________;
②FeS2还原后,检验Fe3+是否反应完全的方法是___________。
(3)①“沉淀”时,需控制pH不宜过高,否则生成的FeCO3中可能混有___杂质;
②写出加入NH4HCO3生成“沉淀”的化学方程式:___________________;
③所得FeCO3需充分洗涤,检验沉淀已洗涤干净的方法是_________________。
(4)FeCO3浊液长时间暴露在空气中,会有部分固体表面变为红褐色,同时释放出CO2,则与FeCO3反应的物质为_________(填化学式)。
(5)FeCO3在空气中煅烧生成Fe2O3时,也会生成FeO。现煅烧34.8g的FeCO3,得到Fe2O3和FeO的混合物23.76g。则Fe2O3的质量为______ g。
-
铁的化合物有广泛用途,如碳酸亚铁(FeCO3)可作为补血剂,铁红(Fe2O3)可作为颜料。利用某硫酸厂产生的烧渣(主要含Fe2O3、FeO,还有一定量的SiO2)制备碳酸亚铁的流程如下:
(1)“酸溶”时加快反应速率的方法有________________________________(写出一种)。
(2)①“还原”时,FeS2与H2SO4不反应,Fe3+通过两个反应被还原,其中一个反应如下:FeS2 +14Fe3+ +8H2O=15Fe2+ +2SO42-+16H+,则另一个反应的离子方程式为:___________________;②FeS2还原后,检验Fe3+是否反应完全的方法是_______________________。
(3)①“沉淀”时,需控制pH不宜过高,否则生成的FeCO3中可能混有____________杂质;
②写出加入NH4HCO3生成“沉淀”的化学方程式:___________________________;
③所得FeCO3需充分洗涤,检验沉淀已洗涤干净的方法是_______________________。
(4)FeCO3浊液长时间暴露在空气中,会有部 分固体表面变为红褐色,同时释放出CO2,则与FeCO3反应的物质为___________________(填化学式)。
分固体表面变为红褐色,同时释放出CO2,则与FeCO3反应的物质为___________________(填化学式)。
(5)FeCO3在空气中煅烧生成Fe2O3时,也会生成FeO.现煅烧23.2kg的FeCO3,得到Fe2O3和FeO的混合物15.84kg.则Fe2O3的质量为___________kg。
-
铁的化合物有广泛用途,如碳酸亚铁(FeCO3)可作为补血剂,铁红(Fe2O3)可作为颜料。利用某硫酸厂产生的烧渣(主要含Fe2O3、FeO,还有一定量的SiO2)制备碳酸亚铁的流程如下:
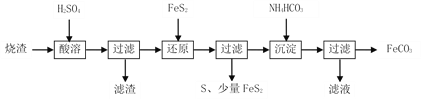
(1)“酸溶”时加快反应速率的方法有___________________(写出一种)。
(2)①“还原”时,FeS2与H2SO4不反应,Fe3+通过两个反应被还原,其中一个反应如下:FeS2 +14Fe3+ +8H2O=15Fe2++2SO42-+16H+,则另一个反应的离子方程式为:___________;
②FeS2还原后,检验Fe3+是否反应完全的方法是___________。
(3)①“沉淀”时,需控制pH不宜过高,否则生成的FeCO3中可能混有___杂质;
②写出加入NH4HCO3生成“沉淀”的化学方程式:___________________;
③所得FeCO3需充分洗涤,检验沉淀已洗涤干净的方法是_________________。
(4)FeCO3浊液长时间暴露在空气中,会有部分固体表面变为红褐色,同时释放出CO2,则与FeCO3反应的物质为_________(填化学式)。
(5)FeCO3在空气中煅烧生成Fe2O3时,也会生成FeO。现煅烧34.8g的FeCO3,得到Fe2O3和FeO的混合物23.76g。则Fe2O3的质量为______ g。
-
高铁酸钠(Na2FeO4)具有很强的氧化性,是一种新型的绿色净水消毒剂。工业上以菱铁矿(主要成分是FeCO3及少量SiO2)为原料制备高铁酸钠生产过程如下:
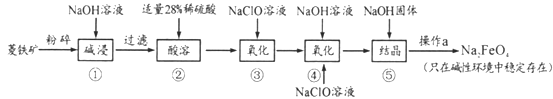
(1)Na2FeO4中铁元素的化合价为___,高铁酸钠用于杀菌消毒时的化学反应类型为____(填“氧化还原反应”、“复分解反应”或“化合反应”)。
(2)按照上述流程,步骤①中碱浸时能否用较便宜的Ca(OH)2替代NaOH_____(填“能”或“不能”),理由是___________。
(3)步骤②中28%的稀硫酸需要用98%的浓硫酸配制,配制时所需玻璃仪器除量筒外,还____(填字母序号)。步骤③中检验Fe2+全部转化成Fe3+的方法是:__________。
A.容量瓶 B.烧杯 C.烧瓶 D.玻璃棒 E.酸式滴定管;
(4)步骤④中除生成Na2FeO4外,还有NaCl生成,其离子方程式为_________;己知步骤⑤是向Na2FeO4溶液中继续加入氢氧化钠固体得到悬浊液,则操作a的名称为_____。
(5)理论上,每获得0.5mol的FeO42-消耗 NaClO的总质量为_____。
2Fe(s) + 3CO(g) + 6H2(g)-Q
Fe(s) + CO2(g) K=0.5若在1 L密闭容器中加入0.04 mol FeO(s),并通入x molCO,t℃时反应达到平衡。此时FeO(s)的转化率为50%,则x=__________________________。
Fe(OH)2+ + H+ K1
Fe(OH)2+ + H+ K2
Fe(OH)3 + H+ K3
Fex(OH)(3x-y)+ y+yH+,欲使平衡正向移动可采用的方法是_________________________(填字母 )。










