-
氮是一种重要的元素,可用来合成NH3与 HNO3等一系列重要化工产品。
(1)在标准状况下,1体积水溶解700体积氨气,所得溶液的密度为0.9g/mL,则该氨水的物质的量浓度是_______(小数点后保留一位)。
(2)合成氨的原料气N2和H2通常是以焦炭、水和空气为原料来制取的。其主要反应是:
①2C + O2 → 2CO ②C + H2O(g) → CO + H2 ③CO + H2O(g) → CO2 + H2
某次生产中将焦炭、H2O(g)和空气(设空气中N2和O2的体积比为4:1,下同)混合反应,所得气体产物经分析,组成如下表:
气体
CO
N2
CO2
H2
O2
体积(m3)(标准状况)
x
20
12
60
1.0
则计算参加反应的H2O(g)和氧气的体积比V(H2O)/V(氧气)=__________上表中x=________m3,实际消耗了___________ kg焦炭。
(3)工业生产硝酸时尾气必须充分处理以避免环境污染,常用NaOH溶液吸收,吸收时发生反应:
①2NO2 + 2NaOH→NaNO3 + NaNO2 + H2O
②NO + NO2 + 2NaOH→2NaNO2 + H2O
现将22.4升(标准状况)NOx(只含NO、NO2,忽略其它成分)气体缓缓通入足量NaOH溶液中,充分反应,气体全部被吸收。则反应中产生NaNO3和NaNO2各多少克?(用含x的代数式表示)____________________
高三化学计算题中等难度题查看答案及解析
-
在标准状况下,1体积水溶解700体积氨气,所得溶液密度为0.9g/cm3,求这种氨水的质量分数和物质的量浓度.
高三化学解答题中等难度题查看答案及解析
-
在标准状况下,1体积水溶解700体积NH3,所得溶液密度为0.9g·cm-3,这种氨水的物质的量浓度和溶质的质量分数分别为
A.18.4mol·L-1、34.7% B.20.4mol·L-1、38.5%
C.18.4mol·L-1、38.5% D.20.4mol·L-1、34.7%
高三化学选择题中等难度题查看答案及解析
-
某温度下,向一洁净干燥的烧杯中加入56gFe粉,然后加入400 mL 16
浓HNO3,反应过程中产生气体的体积和反应时间的关系如图所示,最后固体全部溶解,气体体积均在标准状况下测定。假设反应中HNO3的还原产物只有NO和NO2,那么理论上从哪一时刻开始产生NO( )

A.t1 B.t2 C.t3 D.t4
高三化学选择题中等难度题查看答案及解析
-
(本题共13分)
氨气是重要的化工原料,工业上利用N2和H2合成NH3,方程式如下:N2 +3H2
2NH3
29.已知NH3难溶于CCl4,则下列装置中,不能用于吸收氨气的是
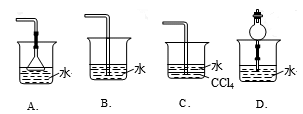
30.某温度下,在一体积恒定为10L的密闭容器内模拟合成氨反应。若开始时充入:0.1mol N2、0.1mol H2和0.2mol NH3,则此时
(填“>”或“<”或“=”,已知该温度下,平衡常数K值为
)。
若要增大反应速率,且平衡向正反应方向移动,下列措施中可行的是 (填字母代号)。
A.压缩容器体积 B.适当升高温度
C.通入适量氮气 D.加适量催化剂
31.能说明上述反应达到平衡状态的是
A.2υ (H2)
3υ(NH3)
B.混合气体的密度不再改变
C.混合气体的平均相对分子质量不再改变
D.单位时间内生成n mol N2的同时生成2n mol NH3
32.氨气溶于水所得溶液在加水稀释的过程中(本小题填“增大”或“减小”或“不变”),NH3·H2O的电离程度 ,电离平衡常数 ,溶液的pH值 。
33.氨气与酸反应得到铵盐,某(NH4)2SO4水溶液的pH=5,原因是溶液中存在平衡 (用离子方程式表示),该稀溶液中水的电离度约为 。
高三化学填空题中等难度题查看答案及解析
-
氨气是一种重要的化工产品,是生产铵盐、尿素等的原料。工业合成氨的反应如下:N2(g) +3H2(g)
2NH3(g) △H=一92. 4 KJ·mol-1
(1)2NH3(g)
N2(g) +3H2(g)在恒容密闭容器中达到平衡的标志有
①单位时间内生成3n mol H2:同时生成2n mol NH3②用NH3、N2、H2表示反应速率比为2∶1∶3 ③混合气体的密度不再改变 ④混合气体压强不再改变 ⑤混合气体平均相对分子质量不再改变
A.①③④ B.①②④⑤ C.①④⑤ D.②③④
(2)工业上常用CO2和NH3通过如下反应合成尿素[CO(NH2)2]。
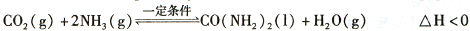
t℃时,向容积恒定为2L的密闭容器中加入0.10 molCO:和0. 40 molNH3 ,70 min开始达到平衡。反应中CO2 ( g)的物质的量随时间变化如下表所示:
时间/min
0
30
70
80
100
n(CO2) /mol
0.10
0.060
0.040
0.040
0.040
①20 min时,υ正(CO2 )_ 80 min时。υ逆(H2O)(填“>”、“=”或“<”)。
②在100 min时,保持其它条件不变,再向容器中充入0. 050 mo1CO2和0. 20 molNH3,重新建立平衡后CO2的转化率与原平衡相比将_________(填“增大”、“不变”或“减小”)。
③上述可逆反应的平衡常数为_________(保留二位小数)。
④根据表中数据在图甲中绘制出在t℃下NH3的转化率随时间变化的图像;保持其它条件不变;则(t+10)℃下正确的图像可能是________(填图甲中的“A”或“B”)。
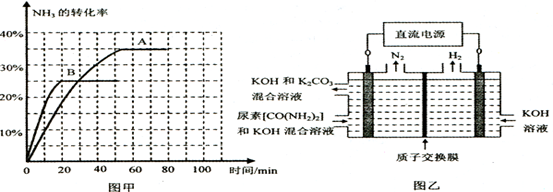
⑤图乙所示装置(阴、阳极均为惰性电极)可用于电解尿素〔CO(NH2)2〕的碱性溶液制取氢气。该装置中阳极的电极反应式为________,若两极共收集到气体22. 4L(标
况),则消耗的尿素为________g(忽略气体的溶解)。
高三化学填空题极难题查看答案及解析
-
(14分)氮及氮的化合物在生产生活中有着重要的用途,NH3、HNO3等是重要化工产品。
(1)合成氨的原料气N2和H2通常是以焦炭、水和空气为原料来制取的。其主要反应是:
① 2C + O2 → 2CO
② C + H2O(g) → CO + H2
③ CO + H2O(g) → CO2 + H2
某次生产中将焦炭、H2O(g)和空气(设空气中N2和O2的体积比为4:1,下同)混合反应,所得气体产物经分析,组成如下表:表中x= m3,实际消耗了_____ kg焦炭。
气体
CO
N2
CO2
H2
O2
体积(m3)(标准状况)
x
20
12
60
1.0
(2)汽车尾气会排放氮的氧化物污染环境。已知气缸中生成NO的反应为:
N2(g)+O2(g)
2NO(g) △H>0
若1mol空气含有0.8molN2和0.2molO2,1300℃时在密闭容器内反应达到平衡。测得NO为8×10-4mol,计算该温度下的平衡常数K= (写出表达式,并计算出结果);汽车启动后,气缸温度越高,单位时间内NO排放量越大,原因是 。
(3)SO2和氮的氧化物都是空气中的有害气体,已知:
2SO2(g)+O2(g)
2SO3(g) ΔH=-196.6 kJ·mol-1
2NO(g)+O2(g)
2NO2(g) ΔH=-113.0 kJ·mol-1
则反应NO2(g)+SO2(g)
SO3(g)+NO(g)的ΔH=________kJ·mol-1。
(4)25℃时,电离平衡常数:
化学式
H2CO3
HClO
H2C4H4O6(酒石酸)
电离平
衡常数
K1=4.3×10-7
K2=5.6×10-11
3.0×10-8
K1=9.1×10-4
K2=4.3×10-5
回答下列问题:
a.常温下,将0.1mol/L的次氯酸溶液与0.1mol/L的碳酸钠溶液等体积混合,所得溶液中各种离子浓度关系正确的是 。
A.c(Na+) > c(ClO-) >c(HCO3-) >c(OH-)
B.c(Na+) > c(HCO3-) >c(ClO-) > c(H+)
C.c(Na+)=c(HClO) +c(ClO-)+ c(HCO3-) + c(H2CO3)+ c(CO32-)
D.c(Na+) + c(H+)=c(ClO-)+ c(HCO3-) + 2c(CO32-)
E.c(HClO) + c(H+)+ c(H2CO3)=c(OH-) + c(CO32-)
b.0.1mol/L的酒石酸溶液与pH=13的NaOH溶液等体积混合,所得溶液的pH为6,则c(HC4H4O6-)+2 c(C4H4O62-)= 。(列出计算式)
高三化学填空题极难题查看答案及解析
-
(9分)氮及氮的化合物在生产生活中有着重要的用途,NH3、HNO3等是重要化工产品。
(1)合成氨的原料气N2和H2通常是以焦炭、水和空气为原料来制取的。其主要反应是:
① 2C + O2 → 2CO
② C + H2O(g) → CO + H2
③ CO + H2O(g) → CO2 + H2
某次生产中将焦炭、H2O(g)和空气(设空气中N2和O2的体积比为4:1,下同)混合反应,所得气体产物经分析,组成如下表:则表中x= m3。
气体
CO
N2
CO2
H2
O2
体积(m3)(标准状况)
x
20
12
60
1.0
(2)汽车尾气会排放氮的氧化物污染环境。已知气缸中生成NO的反应为:
N2(g)+O2(g)
2NO(g)
H>0
若1mol空气含有0.8molN2和0.2molO2,1300℃时在密闭容器内反应达到平衡。测得NO为8×10-4mol.计算该温度下的平衡常数K= ;汽车启动后,气缸温度越高,单位时间内NO排放量越大,原因是 。
(3)SO2和氮的氧化物都是空气中的有害气体,已知:
2SO2(g)+O2(g)
2SO3(g) ΔH=-196.6 kJ·mol-1
2NO(g)+O2(g)
2NO2(g) ΔH=-113.0 kJ·mol-1
则反应NO2(g)+SO2(g)
SO3(g)+NO(g)的ΔH=________kJ·mol-1。
(4)25℃时,电离平衡常数:
化学式
H2CO3
HClO
H2C4H4O6(酒石酸)
电离平衡常数
K1=4.3×10-7 K2=5.6×10-11
3.0×10-8
K1=9.1×10-4 K2=4.3×10-5
回答下列问题:
a.常温下,将0.1mol/L的次氯酸溶液与0.1mol/L的碳酸钠溶液等体积混合,所得溶液中各种离子浓度关系不正确的是
A.c(Na+) > c(ClO-) >c(HCO3-) >c(OH-)
B.c(Na+) > c(HCO3-) >c(ClO-) > c(H+)
C.c(Na+) == c(HClO) +c(ClO-)+ c(HCO3-) + c(H2CO3)+ c(CO32-)
D.c(Na+) + c(H+)== c(ClO-)+ c(HCO3-) + 2c(CO32-)
E.c(HClO) + c(H+)+ c(H2CO3)== c(OH-) + c(CO32-)
b.常温下,0.1mol/L的酒石酸溶液与pH=13的NaOH溶液等体积混合,所得溶液的pH为6,则c(HC4H4O6-)+2 c(C4H4O62-)= (列出计算式)。
高三化学填空题极难题查看答案及解析
-
0.03molCu投入到一定量的浓HNO3中,Cu完全溶解,生成气体颜色越来越浅,共收集到标准状况下672mL气体,将盛有此气体的容器倒扣在水槽中,通入标准状况下一定体积的O2,恰好使气体完全溶于水,则通入O2的体积为
A.504mL B.336mL C.224mL D.168mL
高三化学选择题中等难度题查看答案及解析
-
1.92g铜投人一定盆的浓HNO3中、铜完全溶解,生成的气体颜色越来越浅,共收集到标准状况下672mL气体。将盛有此气休的容器倒扣在水中.通人标准状况下一定体积的.恰好使气体完全被水吸收生成硝酸。则通人O2的体积是
A.504mL B.336mL C.224mL D.168mL
高三化学选择题中等难度题查看答案及解析