-
某同学研究金属锌与氯化铜溶液之间反应,在实验中该同学观察到的现象有:
i.产生少量气泡;ii.有红色固体生成;iii.溶液中产生白色沉淀。
为了解释上述现象,某同学查阅资料,获得如下信息:
| 编号 | 化学反应离子方程式 |
| 1 | Zn+Cu2+ Zn2++Cu Zn2++Cu |
| 2 | Zn+2Cu2+ Zn2++2Cu+ Zn2++2Cu+ |
| 3 | Cu++2Cl- CuCl CuCl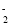 |
| 4 | Cu++Cl- CuCl↓ CuCl↓ |
(1)请结合离子方程式解释产生少量气泡的原因:___。
(2)Zn与CuCl2反应生成白色沉淀的离子方程式是___。
(3)为了探究影响生成白色沉淀的因素,该同学进一步实验。取不同浓度CuCl2溶液,加入锌并振荡,均立刻产生少量气泡和红色固体,其他实验现象如下。
| 
| 编号 | 浓度(rnol/L) | 试剂(锌均过量) | 实验现象 |
| a | 0.5 | 锌片 | 立刻出现少量白色沉淀 |
| b | 1 | 锌片 | 立刻出现白色沉淀 |
| c | 1 | 锌粉 | 立刻出现大量白色沉淀 |
| d | 1 | 锌片、适量NaCl固体 | 少量白色沉淀,振荡迅速溶解 |
①对比实验a、b,实验结论是___。
②某同学从化学平衡的角度分析,d中白色沉淀溶解可能的原因是___(用离子方程式表示)。为证明该同学分析的原因正确,向b试管中加入适量___,振荡,观察到___,证明该同学分析的原因正确。
(4)利用沉淀法除去杂质在实际生产中应用广泛。
①在工业中冶炼锌,为了除去ZnSO4电解液溶液中的C1-,可加入___和___,生成沉淀而除去。
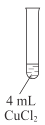
②通过进一步查阅资料得知:CuCl的形成与溶液的pH及Cu2+等离子浓度有关,一定条件下,通过实验得出pH、Cu2+浓度对Cl-沉淀的影响如图所示:
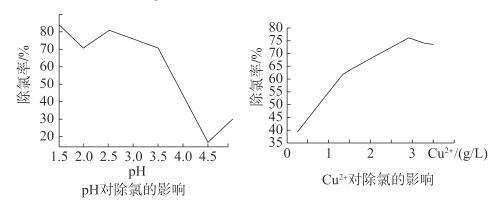
根据图,除去该电解液中Cl-的最佳条件是___。
-
(15分)某课外小组对一些金属单质和化合物的性质进行研究。
(1)下表为“铝与氯化铜溶液反应”实验报告的一部分:
| 实验步骤 | 实验现象 |
| 将打磨过的铝片过量放入一定浓度的CuCl2溶液中 | 产生气泡,析出疏松的红色固体,溶液逐渐变为无色 |
| 反应结束后分离出溶液备用 | |
| 红色固体用蒸馏水洗涤后,置于潮湿空气中 | 一段时间后固体由红色变为绿色[视其主要成分为 |
| Cu2OH2CO3 | |
按反应类型写出实验中发生反应的化学方程式各一个是离子反应的只写离子方程式
置换反应____________,
化合反应____________。
(2)用石墨作电极,电解上述实验分离出的溶液,两极产生气泡。持续电解,在阴极附近的溶液中还可观察到的现象是______________________________________________。
解释此现象的离子方程式是_______________。
(3)工业上可用铝与软锰矿主要成分为MnO2反应来冶炼金属锰。
① 用铝与软锰矿冶炼锰的原理是用化学方程式表示_____________________________。
② MnO2在H2O2分解反应中作催化剂。若将适量MnO2加入酸化后的H2O2溶液中,MnO2溶解产生Mn2+,该反应的离子方程式______________________________。
-
实验小组研究Mg与NH4Cl溶液的反应,实验如下:
| 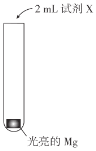
| 实验 | 试剂X | 现象 |
| Ⅰ | H2O | 产生极少气泡,Mg表面逐渐变暗,反应很快停止 |
| Ⅱ | 1mol/LNH4Cl溶液(pH=5) | 数分钟内持续产生较多气泡(经检验含有H2),溶液中出现大量白色固体,试管变热 |
(1)Ⅰ中Mg表面变暗,说明产生了Mg(OH)2固体。反应很快停止的原因是__。
(2)探究实验Ⅰ、Ⅱ产生气泡差异的原因。
假设一:NH4Cl溶液显酸性,c(H+)较大,与Mg反应速率较快。
①用离子方程式表示NH4Cl溶液显酸性的原因:___。
测定实验Ⅱ反应过程中溶液pH随时间的变化,结果如下:
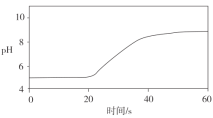
②假设一__(填“是”或“不是”)实验Ⅰ、Ⅱ产生气泡差异的主要原因。
假设二:NH4Cl溶液中的NH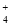 溶解Mg(OH)2固体,使Mg能够持续与水反应。
溶解Mg(OH)2固体,使Mg能够持续与水反应。
进行实验:向1mol/LNH4Cl溶液中加几滴氨水,使溶液pH≈8,得到溶液a。向少量Mg(OH)2固体中加入2mL溶液a,固体溶解。
③有同学认为假设二的实验不严谨,需增加对比实验:__(填操作和现象),说明假设二正确。
④向NH4Cl溶液中加几滴氨水的目的是___。
(3)1min后,实验Ⅱ中还检测到少量NH3。
①检测NH3时要使用湿润的___试纸。
②气体中含有少量NH3的原因是__。
(4)Mg与NH4Cl溶液充分反应后,仍有大量Mg(OH)2固体生成。综合上述实验,解释Mg与NH4Cl溶液的反应比Mg与H2O的反应更剧烈的主要原因:__。
-
某同学将光亮的镁条放入盛有NH4Cl溶液的试管中,有大量气泡产生,为探究该反应原理,该同学做了以下试验并观察到相关现象,由此得出的结论不合理的是
| 选项 | 实验及现象 | 结论 |
| A | 将湿润的红色石蕊试纸放在试管口,试纸变蓝 | 反应中有NH3产生 |
| B | 收集产生的气体并点燃,火焰呈淡蓝色 | 反应中有H2产生 |
| C | 收集气体的同时测得溶液的pH为8.0 | 弱碱性溶液中Mg也可被氧化 |
| D | 将光亮的镁条放入pH为8.6的NaHCO3溶液中,有气泡产生 | 弱碱性溶液中OH-氧化了Mg |
-
某同学做如下实验:
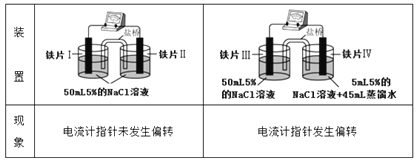
已知K3[Fe(CN)6]遇Fe2+生成深蓝色沉淀,则下列说法正确的是
A. “电流计指针未发生偏转”,说明铁片I、铁片II均未被腐蚀
B. 用K3[Fe(CN)6]溶液检验铁片III、IV附近溶液,可判断电池的正、负极
C. 铁片I、III所处的电解质溶液浓度相同,二者的腐蚀速率相等
D. 铁片IV的电极反应式为Fe-3e-=Fe3+
-
下列试验现象预测正确的是 ( )
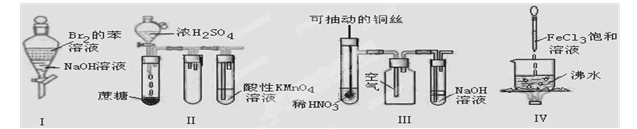
A、实验I:振荡后静置,上层溶液颜色保持不变
B、实验II:酸性KMnO4溶液中出现气泡,且颜色逐渐褪去
C、实验III:微热稀HNO3片刻,溶液中有气泡产生,广口瓶内始终保持无色
D、实验IV:继续煮沸溶液至红褐色,停止加热,当光束通过体系时可产生丁达尔效应
-
下列实验现象预测正确的是

A.实验I:振荡后静置,上层溶液颜色保持不变
B.实验II:酸性KMnO4溶液中出现气泡,且颜色逐渐褪去
C.实验III:微热稀HNO3片刻,溶液中有气泡产生,广口瓶内始终保持无色
D.实验IV:继续煮沸溶液至红褐色沉淀,停止加热,当光束通过体系时一定不可产生丁达尔效应
-
用Pt电解2mol/L CuCl2溶液的实验中出现了和课本实验不同的现象,阳极产生了黄绿色气体,阴极却观察到白色沉淀、少量的红色固体及棕褐色溶液,下列说法不正确的是
A.红色固体可能是Cu
B.棕褐色溶液可能和Cu2+、Cu+ 有关
C.白色固体可能是CuCl
D.棕褐色溶液是由于Cu2+浓度下降引起的
-
用Pt电解2mol/L CuCl2溶液的实验中出现了和课本实验不同的现象,阳极产生了黄绿色气体,阴极却观察到白色沉淀、少量的红色固体及棕褐色溶液,下列说法不正确的是
A. 红色固体可能是Cu
B. 棕褐色溶液可能和Cu2+、Cu+ 有关
C. 白色固体可能是CuCl
D. 棕褐色溶液是由于Cu2+浓度下降引起的
-
某班同学用如下实验探究Fe2+、Fe3+的性质。回答下列问题:
(1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.1mol/L的溶液.在FeCl2液中需加入少量铁属,其目的是________。
(2)甲组同学取2mlFeCl2溶液.加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化。FeCl2溶液与氯水反应的离子方程式为_______。
(3)乙组同学认为甲组的实验不够严谨,该组同学在2mLFeCl2溶液中先加入0.5ml煤油,再于液面下依次加入几滴氯水和l滴KSCN溶液,溶液变红,煤油的作用是______。
(4)丙组同学取10 mL0.1mol/LKI溶液,加入6mL0.1mol/LFeCl3溶液混合。分别取2mL此溶液于3 支试管中进行如下实验:
① 第一支试管中加入1mLCCl4充分振荡、静置,CCl4层呈紫色;
② 第二只试管中加入1滴K3[Fe(CN)6] 溶液,生成蓝色沉淀:
③ 第三支试管中加入1滴KSCN溶液,溶液变红。
实验②检验的离子是_____(填离子符号);实验①和③说明:在I-过量的情况下,溶液中仍含有______(填离子符号),由此可以证明该氧化还原反应为______。
(5)丁组同学向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液·变成棕黄色,发生反应的离子方程式为________;一段时间后.溶液中有气泡出现,并放热.随后有红褐色沉淀生成。产生气泡的原因是______;生成沉淀的原因是______(用平衡移动原理解释)。

 Zn2++Cu
Zn2++Cu



 溶解Mg(OH)2固体,使Mg能够持续与水反应。
溶解Mg(OH)2固体,使Mg能够持续与水反应。

