-
请参考题中图表,已知E1=134 kJ·mol-1、E2=368 kJ·mol-1,根据要求回答问题:
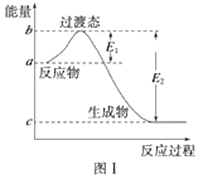
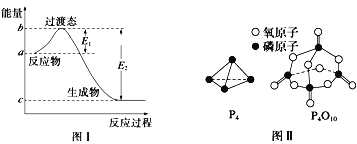
(1)图Ⅰ是1 mol NO2(g)和1 mol CO(g)反应生成CO2和NO过程中的能量变化示意图,若在反应体系中加入催化剂,反应速率增大,E1的变化是________(填“增大”、“减小”或“不变”,下同),ΔH的变化是________。请写出NO2和CO反应的热化学方程式:________________________________。
(2)甲醇质子交换膜燃料电池中将甲醇蒸汽转化为氢气的两种反应的热化学方程式如下:
①CH3OH(g)+H2O(g)===CO2(g)+3H2(g) ΔH=+49.0 kJ·mol-1
②CH3OH(g)+1/2 O2(g)===CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
又知③H2O(g)===H2O(l) ΔH=-44 kJ·mol-1,则甲醇蒸汽燃烧为液态水的热化学方程式为______________________。
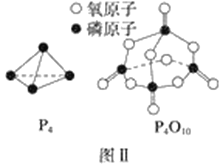
(3)如表所示是部分化学键的键能参数:
| 化学键 | P—P | P—O | O===O | P===O |
| 键能/kJ·mol-1 | a | b | c | x |
已知白磷的燃烧热为d kJ·mol-1,白磷及其完全燃烧的产物的结构如图Ⅱ所示,则表中x=________kJ·mol-1(用含a、b、c、d的代表数式表示)。
-
请参考题中图表,已知E1=134 kJ·mol-1、E2=368 kJ·mol-1,根据要求回答问题:
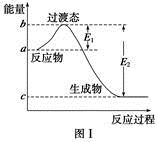
(1)图Ⅰ是1 mol NO2(g)和1 mol CO(g)反应生成CO2和NO过程中的能量变化示意图,若在反应体系中加入催化剂,反应速率增大,E1的变化是 (填“增大”、“减小”或“不变”,下同),ΔH的变化是 。请写出NO2和CO反应的热化学方程式: 。
(2)甲醇质子交换膜燃料电池中将甲醇蒸汽转化为氢气的两种反应的热化学方程式如下:
①CH3OH(g)+H2O(g)===CO2(g)+3H2(g) ΔH=+49.0 kJ·mol-1
②CH3OH(g)+O2(g)===CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
又知③H2O(g)===H2O(l) ΔH=-44 kJ·mol-1,则甲醇蒸汽燃烧为液态水的热化学方程式为 。
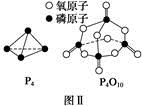
(3)如表所示是部分化学键的键能参数:
| 化学键 | P—P | P—O | O===O | P===O |
| 键能/kJ·mol-1 | a | b | c | x |
已知白磷的燃烧热为d kJ·mol-1,白磷及其完全燃烧的产物的结构如图Ⅱ所示,则表中x= kJ·mol-1(用含a、b、c、d的代表数式表示)。
-
已知E1=134 kJ·mol-1、E2=368 kJ·mol-1,请参考题中图表,根据要求回答问题:
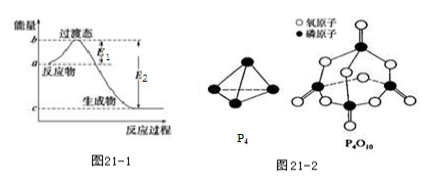
(1)图21-1是1 mol NO2(g)和1 mol CO(g)反应生成CO2和NO过程中的能量变化示意图,若在反应体系中加入催化剂,反应速率增大,E1的变化是_____(填“增大”、“减小”或“不变”,下同),ΔH的变化是______。请写出NO2和CO反应的热化学方程式:______________。
(2)如下表所示是部分化学键的键能参数:
| 化学键 | P—P | P—O | O==O | P==O |
| 键能/kJ·mol-1 | a | b | c | x |
已知白磷的燃烧热为dkJ·mol-1,白磷及其完全燃烧的产物的结构如图21-2所示,则表中x=_________________kJ·mol-1(用含a、b、c、d的代表数式表示)。
-
请参考题中图表,已知E1=134 kJ·mol-1、E2=368 kJ·mol-1,根据要求回答问题:
(1)图Ⅰ是1 mol NO2(g)和1 mol CO(g)反应生成CO2和NO过程中的能量变化示意图,若在反应体系中加入催化剂,反应速率增大,E1的变化是__________(填“增大”、“减小”或“不变”,下同),ΔH的变化是__________。请写出NO2和CO反应的热化学方程式___________________。
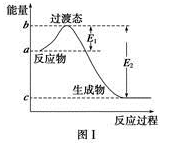
(2)甲醇质子交换膜燃料电池中将甲醇蒸汽转化为氢气的两种反应的热化学方程式如下:
①CH3OH(g)+H2O(g)==CO2(g)+3H2(g) ΔH=+49.0 kJ·mol-1
②CH3OH(g)+ O2(g)==CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
O2(g)==CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
且H2O(g)==H2O(l) ΔH=-44 kJ·mol-1,则甲醇蒸汽燃烧为液态水的热化学方程式为_______________。
(3)如表所示是部分化学键的键能参数:
| 化学键 | P—P | P—O | O===O | P===O |
| 键能/kJ·mol-1 | a | b | c | x |
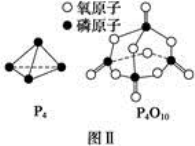
已知白磷的燃烧热为d kJ·mol-1,白磷及其完全燃烧的产物的结构如图Ⅱ所示,则表中x=__________ kJ·mol-1(用含a、b、c、d的代表数式表示)。
-
请参考题中图表,已知E1=134 kJ·mol-1、E2=368 kJ·mol-1,根据要求回答问题:
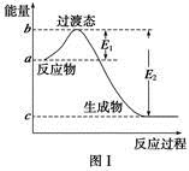
(1)图Ⅰ是1 mol NO2(g)和1 mol CO(g)反应生成CO2和NO过程中的能量变化示意图,若在反应体系中加入催化剂,反应速率增大,E1的变化是 (填“增大”、“减小”或“不变”,下同),ΔH的变化是 。请写出NO2和CO反应的热化学方程式 。
(2)甲醇质子交换膜燃料电池中将甲醇蒸汽转化为氢气的两种反应的热化学方程式如下:
①CH3OH(g)+H2O(g)==CO2(g)+3H2(g) ΔH=+49.0 kJ·mol-1
②CH3OH(g)+ O2(g)==CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
O2(g)==CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
且H2O(g)==H2O(l) ΔH=-44 kJ·mol-1,则甲醇蒸汽燃烧为液态水的热化学方程式为 。
(3)如表所示是部分化学键的键能参数:
| 化学键 | P—P | P—O | O===O | P===O |
| 键能/kJ·mol-1 | a | b | c | x |
已知白磷的燃烧热为d kJ·mol-1,白磷及其完全燃烧的产物的结构如图Ⅱ所示,则表中x= kJ·mol-1(用含a、b、c、d的代表数式表示)。
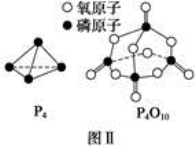
-
请参考题中图表,已知E1=134kJ/mol、E2=368kJ/mol,根据要求回答问题:
(1)图I是1molNO2(g)和1molCO(g)反应生成CO2和NO过程中的能最变化示意图,若在反应体系中加入催化剂,反应速率增大,E1的变化是___ (填“增大” 、“减小”或“不变”下同) ,△H的变化是________。请写出 NO2和CO反应的热化学方程式:__________。
(2)如表所示是部分化学键的键能参数:
| 化学键 | P-P | P-O | O=O | P=O |
| 键能/kJ/mol | a | b | c | x |
已知白磷的燃烧热为d kJ/ mol,白磷及其完全燃烧的产物的结构如图II所示。1个P4O10分子中P-O 的个数为_______,表中x=_____kJ/mol(用含a、b、c、d的代表数式表示)。
-
按要求回答问题:
(1)已知E1=134 kJ/mol、E2=368 kJ/mol,请参考题中图表,按要求填空:
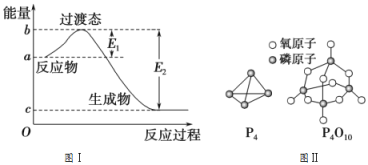
①图Ⅰ是1 mol NO2(g)和1 mol CO(g)反应生成CO2(g)和NO(g)过程中的能量变化示意图,若在反应体系中加入催化剂,反应速率加快,E1的变化是_______(填“增大”、“减小”或“不变”,下同),ΔH的变化是_______。NO2和CO反应的热化学方程式为:______________________________________________________________。
②下表所示是部分化学键的键能参数:
| 化学键 | P—P | P—O | O=O | P=O |
| 键能/(kJ/mol) | a | b | c | x |
已知P4(g)+5O2(g)= P4O10(g) ΔH=-d kJ/mol,P4及P4O10的结构如图Ⅱ所示。表中x=___kJ/mol。(用含a、b、c、d的代数式表示)
(2)肼(N2H4)是一种可燃性的液体,可用作火箭燃料。燃烧时释放大量的热并快速产生大量气体。已知在101kPa,298K时,1mol液态N2H4在O2中完全燃烧生成N2和水蒸气,放出热量624kJ,该反应的热化学方程式是_______________________。
又知:H2O(g)=H2O(l)△H=-44 kJ/mol,若1mol液态N2H4在O2中完全燃烧生成N2和液态水,则放出的热量为__________kJ。
-
请参考题中图表,已知 E1=134 kJ·mol-1、E2=368 kJ·mol-1,根据要求回答问题:
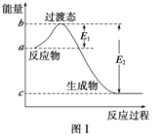
(1)图Ⅰ是 1mol NO2 (g)和 1mol CO (g)反应生成 CO2 (g)和 NO (g)过程中的能量变化示意图, 若在反应体系中加入催化剂,反应速率增大,E1 的变化是 ______(填“增大”、“减小”或“不变”, 下同),△H 的变化是 ______请写出 NO2 和 CO 反应的热化学方程式: ______。
(2)将甲醇蒸汽转化为氢气的两种反应的热化学方程式如下:
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) △H = +49.0 kJ·mol-1
②CH3OH(g)+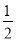 O2(g)=CO2(g)+2H2(g) △H = -192.9 kJ·mol-1
O2(g)=CO2(g)+2H2(g) △H = -192.9 kJ·mol-1
又知③H2O(g) ═ H2O(l) △H = -44 kJ·mol-1,写出表示甲醇蒸 汽燃烧热的热化学方程式为: ______。
-
(1)已知某反应A(g)+B(g) C(g)+D(g)过程中的能量变化如图所示,回答问题。
C(g)+D(g)过程中的能量变化如图所示,回答问题。
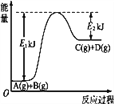
该反应是____(填“吸热”或“放热”)反应,该反应的ΔH=_____ kJ· mol-1(用含E1、E2的代数式表示)。
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g)==2CO2(g)+4H2O(g) ΔH=-1275.6 kJ·mol-1
②H2O(l) =H2O(g) ΔH=+44.0 kJ·mol-1
写出表示甲醇燃烧热的热化学方程式___________________________。
(3)已知:H2(g)+Cl2(g)==2HCl(g) ΔH=-185 kJ/mol,断裂1 mol H—H键吸收的能量为436 kJ,断裂1 mol Cl—Cl键吸收的能量为247 kJ,则形成1 mol H—Cl键放出的能量为______kJ。
(4)FeS2焙烧产生的SO2可用于制硫酸。已知25 ℃、101 kPa时:
2SO2(g)+O2(g) 2SO3(g) ΔH1=-197 kJ·mol-1;
2SO3(g) ΔH1=-197 kJ·mol-1;
H2O(g)===H2O(l) ΔH2=-44 kJ·mol-1;
2SO2(g)+O2(g)+2H2O(g)===2H2SO4(l)ΔH3=-545 kJ·mol-1
则SO3(g)与H2O(l)反应生成H2SO4(l)的热化学方程式是_________________。
-
(8分) 已知某反应A(g)+B(g)⇌C(g)+D(g)进行过程中的能量变化如图所示,请回答下列问题:
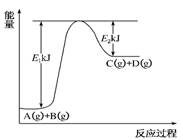
(1)该反应的ΔH=________kJ·mol-1(用含E1、E2的代数式表示)。(1分)
(2)若在反应体系中加入催化剂使逆反应速率增大,则E1________(填“增大”、“减小”或“不变”,下同),ΔH________。(2分)
(3)在相同温度和压强下,对反应A(g)+B(g)C(g)+D(g)进行甲、乙、丙、丁四组实验,实验起始时放入容器内各组分的物质的量见下表:
| A | B | C | D |
| 甲 | a mol | a mol | 0 | 0 |
| 乙 | 2a mol | a mol | 0 | 0 |
| 丙 | a mol | a mol | a mol | a mol |
| 丁 | a mol | 0 | a mol | a mol |
上述四种情况达到平衡后,C(D)的大小顺序是________。(2分)
A.乙=丁>丙=甲 B.乙>丁>甲>丙 C.丁>乙>丙=甲 D.丁>丙>乙>甲
(4)若上述反应达到平衡,为了提高A的转化率,可以采用的措施有(写一条):________________________________________________________________________。(1分)
(5)在恒温恒容条件下进行上述反应。下列情况可以判断该反应达到平衡状态的是____(2分)
A.气体平均摩尔质量不再变化 B. 气体压强不再变化
C. 气体密度不再变化 D. 消耗A的速率等于消耗D的速率
E. 各组分浓度之比为1:1:1:1 F. C生成的速率等于B消耗的速率

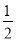 O2(g)=CO2(g)+2H2(g) △H = -192.9 kJ·mol-1
O2(g)=CO2(g)+2H2(g) △H = -192.9 kJ·mol-1











