-
周期表前四周期的元素 A、B、C、D、E,原子序数依次增大。A的核外电子总数与其期序数相同,B和D位于同一周期且未成对电子数等于其周期序数,E为第四周期元素,最外层只有一个电子,次外层的所有轨道均充满电子。
(1)B、C、D三种元素第一电离能由大到小的顺序为___(填元素符号),E基态原子价层电子排布图为_____。
(2)写出由以上元素组成的BD2的等电子体的分子 _________。
(3)已知D可形成D3+离子,该离子中心原子杂化方式为___,立体构型为__。
(4)温度接近沸点时,D的简单氢化物的实测分子量明显高于用原子量和化学式计算出来的分子量,原因是 _______。
(5)无色的[E(CA3)2]+在空气中不稳定、立即被氧化成深蓝色的[E (CA3)4]2+,利用这个性质可除去气体中的氧气,该反应的离子方程为________。
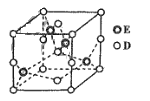
(6)已知E和D形成的一种晶体胞结构如图所示,已知晶胞边长为anm,阿伏加德罗常数为NA,则该晶体的密度为_________ g/cm3(列出计算表达式即可)。
-
短周期元素X、Y、Z、W的原子序数依次增大,X原子的最外层电子数是其内层电子总数的3倍,Y原子的电子层数和最外层电子数相同,Z单质可制成半导体材料,W与X位于同一主族。下列叙述正确的是( )
A. 简单离子的半径:Y>W B. Y和Z的单质均能与强碱溶液反应生成氢气
C. 最高价氧化物对应的水化物的酸性:Z>W D. 简单气态氢化物的热稳定性:W>X
-
现有A、B、C、D、E、F原子序数依次增大的六种元素,它们位于元素周期表的前四周期,B元素原子的价层电子总数是内层电子总数的2倍;D元素原子的L电子层中只有两对成对电子;E元素与F元素处于同一周期相邻的族,它们的原子序数相差3,且E元素的基态原子有4个未成对电子。请回答下列问题:
(1) E元素基态原子的核外价层电子排布式为_________。
(2)用元素符号表示B、C、D三种元素的第一电离能由低到高的排序_________。
(3) A元素与B、C元素可形成化合物B2A4、C2A4。
①B2A4的结构式为_________。
②下列有关C2A4的说法正确的是_________。
a.一个该分子中含有4个σ键
b.该分子可作为配位体形成配位键
c.该分子是非极性分子 d.1mol该分子最多可形成4mol氢键
e.该分子的稳定性与氢键无关
f.该分子中C的原子轨道是sp3杂化
(4)B单质的一种的晶体结构如图甲所示,E单质的一种的晶体结构如图乙所示。
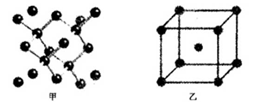
则图中的单质B的名称_________,图甲中B原子的配位数与图乙中E原子的配位数之_________。
E元素与D元素形成的ED晶体与NaCl晶体一样,欲比较ED与NaCl的晶格能大小,需考虑的数据是_______________________________________________________________________________。
(5)据最新资料显示,F单质的晶胞可能有多种,若其晶胞分别以六方紧密堆积和面心立方堆积存在时,其单质的密度之比为_________。
-
短周期主族元素X、Y、Z、W的原子序数依次增大,X与Y位于不同周期,Y与W位于同一主族,Y、Z原子的最外层电子数之和等于它们的内层电子总数之和,W在同周期主族元素的基态原子中第一电离能最大。下列说法中不正确的是
A.与X同主族的元素的基态原子最外层电子所占轨道呈球形
B.Y、Z、W均位于元素周期表的p区
C.仅由Z、W两种元素组成的化合物不止一种
D.Z的最高价氧化物对应的水化物一定为强酸
-
短周期主族元素X、Y、Z、W的原子序数依次增大,X、Y、Z原子的最外层电子数之和为12,Y、Z、W位于同一周期,Z原子的最外层电子数既是X原子内层电子总数的3倍,又是Y原子最外层电子数的3倍。下列说法不正确的是( )
A. 原子半径:Y>X,离子半径Z<W
B. 元素Y的单质能与元素X的最高价氧化物发生置换反应
C. 元素Y和W能形成YW2型离子化合物
D. W的单质有毒,能使湿润的有色布条褪色
-
短周期主族元素X、Y、Z、W的原子序数依次增大,X、Y、Z原子的最外层电子数之和为12,Y、Z、W位于同一周期,Z原子的最外层电子数既是X原子内层电子总数的3倍,又是Y原子最外层电子数的3倍。下列说法不正确的是( )
A.原子半径:Y>X,离子半径Z<W
B.元素Y的单质能与元素X的最高价氧化物发生置换反应
C.元素Y和W能形成YW2型离子化合物
D.W的单质有毒,能使湿润的有色布条褪色
-
E、G、M、Q、T是五种原子序数依次增大的前四周期元素。E、G、M是位于p区的同一周期的元素,M的价层电子排布为ns2np2n,E与M原子核外的未成对电子数相等;QM2与GM2-具有相等的价电子总数;T为过渡元素,其原子核外没有未成对电子。请回答下列问题:
(1)T元素原子的价电子排布式是__________。
(2)E、G、M三种元素的第一电离能由大到小的顺序为__ (用元素符号表示),其原因为________。
(3)E、G、M的最简单氢化物中,键角由大到小的顺序为 (用分子式表示),其中G的最简单氢化物的分子立体构型名称为_____ ___,M的最简单氢化物的分子中中心原子的杂化类型为 。M和Q的最简单氢化物的沸点大小顺序为__________(写化学式)。
(4)EM、GM+、G2互为等电子体,EM的结构式为(若有配位键,请用“→”表示)。E、M电负性相差1.0,由此可以判断EM应该为极性较强的分子,但实际上EM分子的极性极弱,请解释其原因: 。
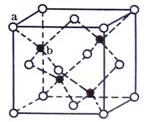
(5) TQ在荧光体、光导体材料、涂料、颜料等行业中应用广泛。立方TQ晶体结构如图所示,该晶体的密度为pg·cm-3。如果TQ的摩尔质量为Mg.mol-1,阿伏加德罗常数为NA mol-1,则a、b之间的距离为_______cm。
-
E、G、M、Q、T是五种原子序数依次增大的前四周期元素。E、G、M是位于p区的同一周期的元素,M的价层电子排布为ns2np2n,E与M原子核外的未成对电子数相等;QM2与GM2−具有相等的价电子总数;T为过渡元素,其原子核外没有未成对电子。请回答下列问题:
(1)T元素原子的价电子排布式是___。
(2)E、G、M三种元素的第一电离能由大到小的顺序为___(用元素符号表示),其原因为___。
(3)G的最简单氢化物的分子立体构型名称为___,M的最简单氢化物的分子中中心原子的杂化类型为___。M和Q的最简单氢化物的沸点大小顺序为___(写化学式)。
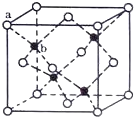
(4)TQ在荧光体、光导体材料、涂料、颜料等行业中应用广泛。立方TQ晶体结构如图所示,该晶体的密度为pg·cm−3。如果TQ的摩尔质量为Mg·mol−1,阿伏加德罗常数为NAmol−1,则a、b之间的距离为___cm。
-
X、Y、Z、W均为短周期主族元素,原子序数依次增大。X与Z位于同一主族,Z的核外电子数是X的2倍,Y、Z、W原子的最外层电子数之和等于Z的核外电子总数。下列说法正确的是
A. 原子半径:r(X)<r(Y)<r(Z)
B. Y的氧化物能与氢氧化钠溶液反应
C. Z的氧化物对应的水化物均为强酸
D. Z的气态氢化物的稳定性比W的强
-
五种短周期元素T、W、X、Y、Z的原子序数依次增大。T的一种核素在考古时常用来鉴定一些文物的年代,W的简单气态氢化物遇Z的氢化物产生白烟。T、Z原子最外层电子数之和等于X的核外电子总数,T和Y位于同一主族。下列推断正确的是( )
A.原子半径:T<W<Z<Y<X
B.简单气态氢化物的热稳定性:Y>T>W
C.氧化物对应水化物的酸性:Y<T<W<Z
D.X3W和XW3都是离子化合物,但所含化学键类型不完全相同



