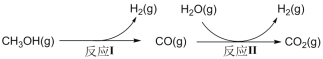-
甲醇不仅是重要的化工原料,而且还是性能优良的能源和车用燃料。
Ⅰ.甲醇水蒸气重整制氢是电动汽车氢氧燃料电池理想的氢源,生产过程中同时也产生CO,CO会损坏燃料电池的交换膜。相关反应如下:
反应①CH3OH(g) + H2O(g)⇌CO2(g) + 3H2(g) △H1
反应②H2(g)+CO2(g)⇌CO(g) + H2O(g) △H2=+41kJ/mol
如图表示恒压容器中0.5mol CH3OH(g)和0.5mol H2O(g)转化率达80%时的能量变化。
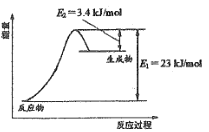
(1)计算反应①的△H1= ________。
(2)反应①能够自发进行的原因是________。升温有利于提高CH3OH转化率,但也存在一个明显的缺点是 _________。
(3)恒温恒容下,向密闭容器中通入体积比为1:1的H2和CO2,能判断反应CH3OH(g) + H2O(g)⇌CO2(g) + 3H2(g)处于平衡状态的是____________。
A.体系内压强保持不变
B.体系内气体密度保持不变
C.CO2的体积分数保持不变
D.断裂3mol H-H键的同时断裂3mol H-O键
(4)250℃,一定压强和催化剂条件下,1.00mol CH3OH 和 1.32mol H2O充分反应,平衡测得H2为2.70mol,CO为 0.030mol,则反应①中CH3OH的转化率_________,反应②的平衡常数是 _________(以上结果均保留两位有效数字)。
Ⅱ.如图是甲醇燃料电池工作示意图:
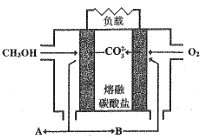
(5)当内电路转移1.5molCO32-时,消耗甲醇的质量是_________g。
(6)正极的电极反应式为 _______。
-
【加试题】甲醇水蒸气重整制氢(SRM)是用于驱动电动汽车的质子交换膜燃料电池的理想氢源,当 前研究主要集中在提高催化剂活性和降低尾气中CO含量,以免使燃料电池Pt电极中毒。重整过程发生的反应如下:
反应I CH3OH(g)+H2O(g)  CO2(g)+3H2(g) ΔH1
CO2(g)+3H2(g) ΔH1
反应Ⅱ CH3OH(g)  CO(g)+2H2(g) ΔH2
CO(g)+2H2(g) ΔH2
反应Ⅲ.CO(g)+H2O(g)  CO2(g)+H2(g) ΔH3
CO2(g)+H2(g) ΔH3
其对应的平衡常数分别为K1、K2、K3,其中K2、K3随温度变化如下表所示:
| 125℃ | 225℃ | 325℃ |
| K2 | 0.5535 | 185.8 | 9939.5 |
| K3 | 1577 | 137.5 | 28.14 |
请回答:
(1)反应Ⅱ能够自发进行的条件_______ (填 “低温”、“高温”或“任何温度”), ΔH1____ΔH3 (填 “>”、“<”或 “=” )。
(2)相同条件下,甲醇水蒸气重整制氢较甲醇直接分解制氢(反应Ⅱ)的先进之处在于_________。
(3)在常压、CaO催化下,CH3OH和H2O混和气体(体积比1∶1.2,总物质的量2.2mol)进行反应,tl时刻测得 CH3OH转化率及CO、CO2选择性随温度变化情况分别如图所示(CO、CO2的选择性:转化的CH3OH中生成CO、CO2的百分比)。
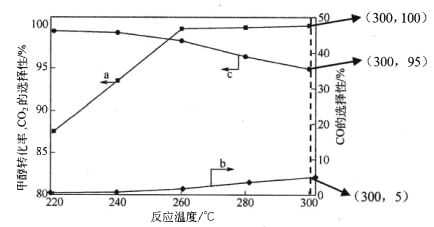
注:曲线a表示CH3OH的转化率,曲线b表示CO的选择性,曲线c表示 CO2的选择性
① 下列说法不正确的是_____。
A.反应适宜温度为300℃
B.工业生产通 常在负压条件下进行甲醇水蒸气重整
C.己知 CaO催化剂具有更高催化活性,可提高甲醇平衡转化率
D.添加CaO的复合催化剂可提高氢气产率
② 260℃ 时H2物质的量随时间的变化曲线如图所示。画出300℃时至t1时刻H2物质的量随时间的变化曲线_____。
(4)副产物CO2可以在酸性水溶液中电解生成甲酸,生成甲酸的电极反应式是_________。
-
甲醇水蒸气重整制氢(SRM)系统简单,产物中H2 含量高、CO含量低(CO会损坏燃料电池的交换膜),是电动汽车氢氧燃料电池理想的氢源。反应如下:
反应Ⅰ(主) :CH3OH(g)+ H2O(g)  CO2(g)+ 3H2(g) ΔH1=+49kJ/mol
CO2(g)+ 3H2(g) ΔH1=+49kJ/mol
反应Ⅱ(副) :H2(g)+ CO2(g)  CO(g)+ H2O(g) ΔH2=+41kJ/mol
CO(g)+ H2O(g) ΔH2=+41kJ/mol
温度高于300℃则会同时发生反应Ⅲ: CH3OH(g)  CO(g)+2H2(g) ΔH3
CO(g)+2H2(g) ΔH3
(1)计算反应Ⅲ的ΔH3= _________。
(2)反应1能够自发进行的原因是_______________,升温有利于提高CH3OH转化率,但也存在一个明显的缺点是__________。
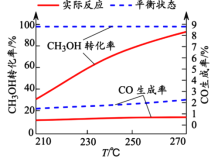
(3)右图为某催化剂条件下,CH3OH转化率、CO生成率与温度的变化关系。
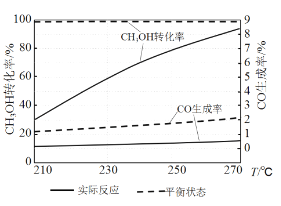
①随着温度的升高,CO的实际反应生成率没有不断接近平衡状态生成率的原因是____________ (填标号)。
A.反应Ⅱ逆向移动
B.部分CO 转化为CH3OH
C.催化剂对反应Ⅱ的选择性低
D.催化剂对反应Ⅲ的选择性低
②随着温度的升高,CH3OH 实际反应转化率不断接近平衡状态转化率的原因是______。
③写出一条能提高CH3OH转化率而降低CO生成率的措施_________。
(4)250℃,一定压强和催化剂条件下,1.00molCH3OH 和1.32molH2O 充分反应(已知此条件下可忽略反应Ⅲ ),平衡时测得H2为2.70mol,CO有0.030mol,试求反应Ⅰ中CH3OH 的转化率_________,反应Ⅱ的平衡常数_________(结果保留两位有效数字)
-
甲醇水蒸气重整制氢(SRM)系统简单,产物中H2 含量高、CO含量低(CO会损坏燃料电池的交换膜),是电动汽车氢氧燃料电池理想的氢源。反应如下:
反应Ⅰ(主) :CH3OH(g)+ H2O(g)  CO2(g)+ 3H2(g) ΔH1=+49kJ/mol
CO2(g)+ 3H2(g) ΔH1=+49kJ/mol
反应Ⅱ(副) :H2(g)+ CO2(g)  CO(g)+ H2O(g) ΔH2=+41kJ/mol
CO(g)+ H2O(g) ΔH2=+41kJ/mol
温度高于300℃则会同时发生反应Ⅲ: CH3OH(g)  CO(g)+2H2(g) ΔH3
CO(g)+2H2(g) ΔH3
(1)计算反应Ⅲ的ΔH3= _________。
(2)反应1能够自发进行的原因是_______________,升温有利于提高CH3OH转化率,但也存在一个明显的缺点是__________。
(3)右图为某催化剂条件下,CH3OH转化率、CO生成率与温度的变化关系。
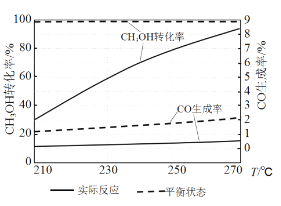
①随着温度的升高,CO的实际反应生成率没有不断接近平衡状态生成率的原因是____________ (填标号)。
A.反应Ⅱ逆向移动
B.部分CO 转化为CH3OH
C.催化剂对反应Ⅱ的选择性低
D.催化剂对反应Ⅲ的选择性低
②随着温度的升高,CH3OH 实际反应转化率不断接近平衡状态转化率的原因是______。
③写出一条能提高CH3OH转化率而降低CO生成率的措施_________。
(4)250℃,一定压强和催化剂条件下,1.00molCH3OH 和1.32molH2O 充分反应(已知此条件下可忽略反应Ⅲ ),平衡时测得H2为2.70mol,CO有0.030mol,试求反应Ⅰ中CH3OH 的转化率_________,反应Ⅱ的平衡常数_________(结果保留两位有效数字)
-
甲醇水蒸气重整制氢(SRM)系统简单,产物中H2 含量高、CO含量低(CO会损坏燃料电池的交换膜),是电动汽车氢氧燃料电池理想的氢源。反应如下:
反应Ⅰ(主) :CH3OH(g)+ H2O(g)  CO2(g)+ 3H2(g) ΔH1=+49kJ/mol
CO2(g)+ 3H2(g) ΔH1=+49kJ/mol
反应Ⅱ(副) :H2(g)+ CO2(g)  CO(g)+ H2O(g) ΔH2=+41kJ/mol
CO(g)+ H2O(g) ΔH2=+41kJ/mol
温度高于300℃则会同时发生反应Ⅲ: CH3OH(g)  CO(g)+2H2(g) ΔH3
CO(g)+2H2(g) ΔH3
(1)计算反应Ⅲ的ΔH3= _________。
(2)反应1能够自发进行的原因是_______________,升温有利于提高CH3OH转化率,但也存在一个明显的缺点是__________。
(3)右图为某催化剂条件下,CH3OH转化率、CO生成率与温度的变化关系。
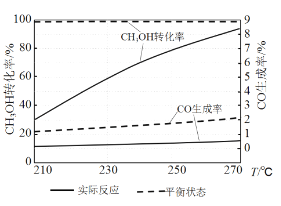
①随着温度的升高,CO的实际反应生成率没有不断接近平衡状态生成率的原因是____________ (填标号)。
A.反应Ⅱ逆向移动
B.部分CO 转化为CH3OH
C.催化剂对反应Ⅱ的选择性低
D.催化剂对反应Ⅲ的选择性低
②随着温度的升高,CH3OH 实际反应转化率不断接近平衡状态转化率的原因是______。
③写出一条能提高CH3OH转化率而降低CO生成率的措施_________。
(4)250℃,一定压强和催化剂条件下,1.00molCH3OH 和1.32molH2O 充分反应(已知此条件下可忽略反应Ⅲ ),平衡时测得H2为2.70mol,CO有0.030mol,试求反应Ⅰ中CH3OH 的转化率_________,反应Ⅱ的平衡常数_________(结果保留两位有效数字)
-
甲醇水蒸气重整制氢(SRM)系统简单,产物中H2 含量高、CO含量低(CO会损坏燃料电池的交换膜),是电动汽车氢氧燃料电池理想的氢源。反应如下:
反应Ⅰ(主) :CH3OH(g)+ H2O(g)  CO2(g)+ 3H2(g) ΔH1=+49kJ/mol
CO2(g)+ 3H2(g) ΔH1=+49kJ/mol
反应Ⅱ(副) :H2(g)+ CO2(g)  CO(g)+ H2O(g) ΔH2=+41kJ/mol
CO(g)+ H2O(g) ΔH2=+41kJ/mol
温度高于300℃则会同时发生反应Ⅲ: CH3OH(g)  CO(g)+2H2(g) ΔH3
CO(g)+2H2(g) ΔH3
(1)计算反应Ⅲ的ΔH3= _________。
(2)反应1能够自发进行的原因是_______________,升温有利于提高CH3OH转化率,但也存在一个明显的缺点是__________。
(3)右图为某催化剂条件下,CH3OH转化率、CO生成率与温度的变化关系。
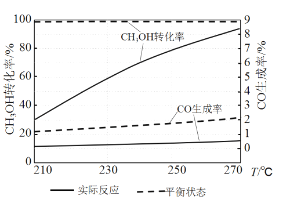
①随着温度的升高,CO的实际反应生成率没有不断接近平衡状态生成率的原因是____________ (填标号)。
A.反应Ⅱ逆向移动
B.部分CO 转化为CH3OH
C.催化剂对反应Ⅱ的选择性低
D.催化剂对反应Ⅲ的选择性低
②随着温度的升高,CH3OH 实际反应转化率不断接近平衡状态转化率的原因是______。
③写出一条能提高CH3OH转化率而降低CO生成率的措施_________。
(4)250℃,一定压强和催化剂条件下,1.00molCH3OH 和1.32molH2O 充分反应(已知此条件下可忽略反应Ⅲ ),平衡时测得H2为2.70mol,CO有0.030mol,试求反应Ⅰ中CH3OH 的转化率_________,反应Ⅱ的平衡常数_________(结果保留两位有效数字)
-
以高纯H2为燃料的质子交换膜燃料电池具有能量效率高、无污染等优点,但燃料中若混有CO将显著缩短电池寿命。
(1)以甲醇为原料制取高纯H2是重要研究方向。甲醇水蒸气重整制氢主要发生以下两个反应:
主反应:CH3OH(g)+H2O(g) CO2(g)+3H2(g) △H=+49 kJ•mol-1
CO2(g)+3H2(g) △H=+49 kJ•mol-1
副反应:H2(g)+CO2(g) CO(g)+H2O(g) △H=+41 kJ•mol-1
CO(g)+H2O(g) △H=+41 kJ•mol-1
①甲醇在催化剂作用下裂解可得到H2和CO,则该反应的化学方程式为_________________________,既能加快反应速率又能提高CH3OH平衡转化率的一种措施是_________________________。
②分析适当增大水醇比(nH2O∶nCH3OH)对甲醇水蒸气重整制氢的好处_________________________。
③某温度下,将nH2O∶nCH3OH =1∶1的原料气充入恒容密闭容器中,初始压强为p1,反应达到平衡时总压强为p2,则平衡时甲醇的转化率为_________________________。(忽略副反应)
(2)工业常用CH4 与水蒸气在一定条件下来制取H2,其原理为:
CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH=+203kJ·mol-1
①该反应的逆反应速率表达式为; V逆=k·c(CO)·c3(H2),k为速率常数,在某温度下,测得实验数据如表:
| CO浓度(mol·L-1) | H2浓度(mol·L-1) | 逆反应速率(mol·L-1·min-1) |
| 0.05 | C1 | 4.8 |
| c2 | C1 | 19.2 |
| c2 | 0.15 | 8.1 |
由上述数据可得该温度下,上述反应的逆反应速率常数k 为__________L3·mol-3·min-1。
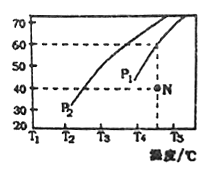
②在体积为3L的密闭容器中通入物质的量均为3mol 的CH4和水蒸气,在一定条件下发生上述反应,测得平衡时H2的体积分数与温度及压强的关系如图所示,则压强Pl_____P2(填“大于”或“小于”)温度T3_______T4(填“大于”或“小于”);压强为P1时,在N点; v正_______v逆(填“大于”或“小于”或“等于”)。求N点对应温度下该反应的平衡常数 K=_____________________。
-
以高纯H2为燃料的质子交换膜燃料电池具有能量效率高、无污染等优点,但燃料中若混有CO将显著缩短电池寿命。
(1)以甲醇为原料制取高纯H2是重要研究方向。甲醇水蒸气重整制氢主要发生以下两个反应:
主反应:CH3OH(g) + H2O(g) ==CO2(g) + 3H2(g) △H = +49 kJ•mol-1
副反应:H2(g) + CO2(g) ==CO(g) + H2O(g) △H=+41 kJ•mol-1
①甲醇蒸气在催化剂作用下裂解可得到H2和CO,则该反应的热化学方程式为_________________,既能加快反应速率又能提高CH3OH平衡转化率的一种措施是_________________。
②分析适当增大水醇比 对甲醇水蒸气重整制氢的好处是_______________。
对甲醇水蒸气重整制氢的好处是_______________。
③某温度下,将n(H2O)∶n(CH3OH) = 1∶1的原料气充入恒容密闭容器中,初始压强为P1,反应达平衡时总压强为P2,则平衡时甲醇的转化率为____________(忽略副反应)。
(2)工业上用CH4与水蒸气在一定条件下制取H2,原理为:CH4(g) + H2O(g)=CO(g) + 3H2(g) ΔH = + 203 kJ•mol-1
①该反应逆反应速率表达式为:v逆=k•c(CO) •c3(H2),k 为速率常数,在某温度下测得实验数据如表:
| CO浓度(mol•L-1) | H2浓度(mol•L-1) | 逆反应速率(mol•L-1•min-1) |
| 0.05 | c1 | 4.8 |
| c2 | c1 | 19.2 |
| c2 | 0.15 | 8.1 |
由上述数据可得该温度下,该反应的逆反应速率常数 k为_________L3•mol-3•min-1。

②在体积为3 L的密闭容器中通入物质的量均为3 mol的CH4和水蒸气,在一定条件下发生上述反应,测得平衡时H2的体积分数与温度及压强的关系如图所示:则压强Pl_______P2(填“大于”或“小于”);N点v正_______M点v逆(填“大于”或“小于”);求Q点对应温度下该反应的平衡常数K=________。平衡后再向容器中加入1 mol CH4和1 mol CO,平衡_______移动(填“正反应方向”或“逆反应方向”或“不”)。
-
以高纯H2为燃料的质子交换膜燃料电池具有能量效率高、无污染等优点,但燃料中若混有CO将显著缩短电池寿命。
(1)以甲醇为原料制取高纯H2是重要研究方向。甲醇水蒸气重整制氢主要发生以下两个反应:
主反应:CH3OH(g) + H2O(g) ==CO2(g) + 3H2(g) △H = +49 kJ•mol-1
副反应:H2(g) + CO2(g) ==CO(g) + H2O(g) △H=+41 kJ•mol-1
①甲醇蒸气在催化剂作用下裂解可得到H2和CO,则该反应的热化学方程式为_________________,既能加快反应速率又能提高CH3OH平衡转化率的一种措施是_________________。
②分析适当增大水醇比 对甲醇水蒸气重整制氢的好处是_______________。
对甲醇水蒸气重整制氢的好处是_______________。
③某温度下,将n(H2O)∶n(CH3OH) = 1∶1的原料气充入恒容密闭容器中,初始压强为P1,反应达平衡时总压强为P2,则平衡时甲醇的转化率为____________(忽略副反应)。
(2)工业上用CH4与水蒸气在一定条件下制取H2,原理为:CH4(g) + H2O(g)=CO(g) + 3H2(g) ΔH = + 203 kJ•mol-1
①该反应逆反应速率表达式为:v逆=k•c(CO) •c3(H2),k 为速率常数,在某温度下测得实验数据如表:
| CO浓度(mol•L-1) | H2浓度(mol•L-1) | 逆反应速率(mol•L-1•min-1) |
| 0.05 | c1 | 4.8 |
| c2 | c1 | 19.2 |
| c2 | 0.15 | 8.1 |
由上述数据可得该温度下,该反应的逆反应速率常数 k为_________L3•mol-3•min-1。
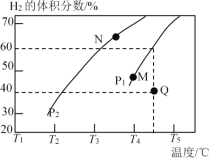
②在体积为3 L的密闭容器中通入物质的量均为3 mol的CH4和水蒸气,在一定条件下发生上述反应,测得平衡时H2的体积分数与温度及压强的关系如图所示:则压强Pl_______P2(填“大于”或“小于”);N点v正_______M点v逆(填“大于”或“小于”);求Q点对应温度下该反应的平衡常数K=________。平衡后再向容器中加入1 mol CH4和1 mol CO,平衡_______移动(填“正反应方向”或“逆反应方向”或“不”)。
-
甲醇、水蒸气重整制氢(SRM)系统简单,产物中H2含量高,是电动汽车氢氧燃料电池理想的氢源。其部分主要反应过程如下流程所示:
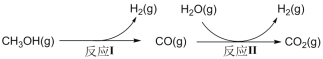
请回答下列问题:
I.对反应ICH3OH(g)  CO(g) + 2H2(g)的单独研究:
CO(g) + 2H2(g)的单独研究:
(1) 已知CO(g)的热值为10.1 kJ·g-1;CH3OH(g)、H2(g)的燃烧热分别为760 kJ·mol-1、286 kJ·mol-1;计算反应I的ΔH1=______kJ·mol-1 (保留三位有效数字)。
(2) 原料进气比对反应I的选择性(某产物的选择性越大,则其含量越多)的影响较为复杂,其关系如图甲。 当n(O2)/n(CH3OH)=0.2~0.3时,CH3OH与O2发生的主要反应为______。
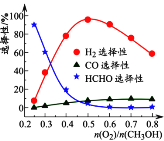
图甲 图乙 图丙
II.对反应II CO(g) + H2O(g)  H2(g) + CO2(g)ΔH<0的单独研究:
H2(g) + CO2(g)ΔH<0的单独研究:
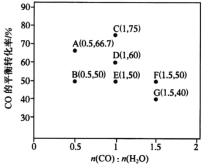
(3) 在进气比n(CO)/n(H2O)不同时,测得相应的CO的平衡转化率如图乙(各点对应温度可能不同)。图乙中D、G两点对应的反应温度分别为TD和TG,其中相对低温的是______(填TD或TG)。
(4) 实验发现,其他条件不变,向反应II平衡体系中投入一定量纳米CaO可明显提高H2的体积分数,原因是______。
III.对反应I和II的综合研究:
(5)某催化剂条件下,体系中CH3OH转化率、中间产物CO生成率与温度变化关系如图丙所示。
① 随着温度升高,CH3OH实际转化率不断接近平衡转化率的原因可能是______;但是,CO的实际生成率并没有不断接近平衡生成率,其原因可能是______ (填标号)。
A.反应Ⅱ正向移动 B.部分CO转化为CH3OH
C.催化剂对反应Ⅱ的选择性低 D.催化剂对反应I的选择性低
② 写出能提高CH3OH转化率而降低CO生成率的一条措施______。