-
由 H、B、C、N、O、F 等元素通过共价键形成的物质在工业生产中有广泛的应用。回答下列问题:
(1)氧原子核外有_____种不同运动状态的电子,有_______ 种不同能量的原子轨道。
(2)Bi 是 N 的同主族元素,与 N 原子相差 4 个电子层,基态 Bi 原子的价电子轨道排布图为______。
(3)C2H4 与N2H4 在水中的溶解度相差很大, 出现这种现象的主要原因是 __________。
(4)H2C2O4 分子中碳原子的杂化类型是 _________,写出一种与 C2O42-互为等电子体的分子的化学式_______________。
(5)NaHF2 可用于制无水氟化氢和雕刻玻璃、木材防腐等。常温常压下为白色固体,易溶于水,160℃分解,NaHF2 中所含作用力的类型有___________(填字母)。
a 离子键 b 共价键 c 配位键 d 氢键
(6)六方氮化硼晶体结构如图 I 所示,氮化硼的化学式为______在其晶胞(图Ⅱ所示)中层内 BN 核间距为 apm,层间 BN 核间距为bpm,其密度为______g·cm -3(阿伏加德罗常数的值为 NA,用含 a、b、NA 的代数式表示)
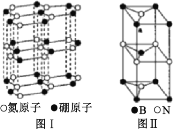
-
已知N、S、Cl元素可形成多种物质,在工业生产上有着广泛的应用。回答下列问题:
(1)Fe3+可与SCN-形成多种配离子,其中一种为[Fe(SCN)6]3-,该配离子中的SCN-会使铁的剩余价电子压缩配对,则每个配离子中铁的单电子个数为_______个。
(2)Se与S是同族元素,请写出基态Se原子电子排布式______。N与S是不同族元素,请解释NH3比H2S在水中溶解度大的原因:__________________。
(3)有一种由1~9号元素中的部分元素组成,且与SCl2互为等电子体的共价化合物,它的分子式为__________。借助等电子体原理可以分析出SCN-中σ键和π键的个数比为__________。
(4)已知S4O62-的结构为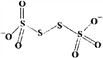 ,其中S原子的杂化方式是______。 N、P可分别形成多种三角锥型分子,已知NH3的键角大于PH3,原因是____________。
,其中S原子的杂化方式是______。 N、P可分别形成多种三角锥型分子,已知NH3的键角大于PH3,原因是____________。
(5)离子晶体中阳离子和阴离子的半径比不同可形成不同的晶胞结构,见下表:

已知某离子晶体RA,其阴阳离子半径分别为184pm和74pm,摩尔质量为Mg/mol,则阳离子配位数为_________,晶体的密度为_________g/cm3(列出计算式,无需化简,设NA为阿伏加德罗常数的值)。
-
镁、铁、铜等在工农业生产中有着广泛的应用。回答下列问题:
(1)铜元素位于元素周期表中的___区,其基态原子的价电子排布图为_________。
(2)往硫酸铜溶液中加入过量氨水,可形成[Cu(NH3)4]SO4溶液,该溶液可用于溶解纤维素。
①[Cu(NH3)4]SO4中阴离子的立体构型是_______。
②在[Cu(NH3)4]SO4中,配离子所含有的化学键为________,提供孤电子对的成键原子是_______。
③ 除硫元素外,[Cu(NH3)4]SO4中所含元素的电负性由小到大的顺序为_______。
④NF3与NH3的空间构型相同,中心原子的轨道杂化类型均为_____。但NF3不易与Cu2+形成化学键,其原因是____________。
(3)铁镁合金是目前已发现的储氢密度最高的储氢材料之一,其晶胞结构如图所示。则铁镁合金的化学式为________,若该晶胞的参数为dnm,则该合金的密度为____ g/cm3(不必化简,用NA表示阿伏加德罗常数)。
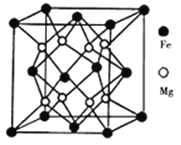
-
【化学一选修3:物质结构与性质】铜及其化合物在化工生产中有着广泛的应用。回答下列问题:
(1)铜元素在元素周期表中的位置为_________________,基态Cu原子核外电子占据的原子轨道数为____________________。
(2)向硫酸铜溶液中加入乙二胺(H2N-CH2-CH2-NH3)溶液后,每个Cu2+可与两个乙二胺分子形成四配位离子,导致溶液由蓝色变为紫色。
①乙二胺分子中C、N原子的杂化轨道类型分别为_______________、_________________。
②与硫酸根离子互为等电子体的分子为___________(任写一种)。
③四配位离子的结构式为_____________________,该离子中所有元素的电负性由大到小的顺序为____________________________。
(3)硫化亚铜和氧化亚铜均为离子晶体,其中熔点较高的为___________(填化学式),原因为________________________________________________。
(4)下图为铜与氧(O)、钇(Y)、钡(Ba)形成的一种超导体材料的长方体晶胞结构,其晶胞参数如图(i)所示,该结构中有平面正方形(CuO4)和四方锥(CuO6)结构单元如图(ii)所示。
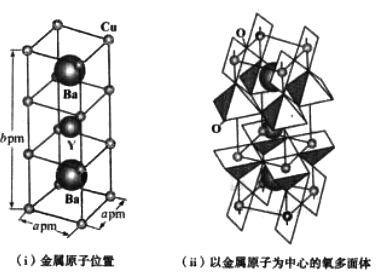
①该超导体材料的化学式为____________________________。
②已知该化合物的摩尔质量为Mg·mol-1,阿伏加德罗常数的值为NA,其密度为____g·cm-3(列出表达式即可)。
-
Ni元素在生产、生活中有着广泛的应用。 回答下列问题:
(1)基态Ni原子价层电子的排布式为 ____。
(2)科学家在研究金属矿物质组分的过程中,发现了Cu-Ni-Fe等多种金属互化物。确定某种金属互化物是晶体还是非晶体最可靠的科学方法是对固体进行_____。
(3)Ni能与类卤素(SCN)2反应生成Ni(SCN)2。Ni(SCN)2中,第一电离能最大的元素是____;(SCN)2分子中,硫原子的杂化方式是____ ,σ键和π键数目之比为_____。
(4)[Ni(NH3)6](NO3)2中,不存在的化学键为____ (填标号)。
a.离子键 b.金属键 c.配位键 d.氢键
(5)镍合金储氢的研究已取得很大进展。
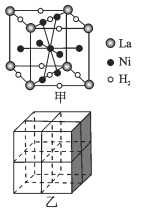
①图甲是一种镍基合金储氢后的晶胞结构示意图。 该合金储氢后,含1molLa的合金可吸附H2的数目为_____。
②Mg2NiH4是一种贮氢的金属氢化物。在Mg2NiH4晶胞中,Ni原子占据如图乙的顶点和面心,Mg2+ 处于乙图八个小立方体的体心。Mg2+位于Ni原子形成的 ___ (填“八面体空隙”或“四面体空隙”)。 若晶体的密度为dg/cm3,Mg2NiH4的摩尔质量为Mg/mol,则Mg2+和Ni原子的最短距离为 ___ nm(用含d、M、NA 的代数式表示)。
-
Ni元素在生产、生活中有着广泛的应用。 回答下列问题:
(1)基态Ni原子价层电子的排布式为 ____。
(2)科学家在研究金属矿物质组分的过程中,发现了Cu-Ni-Fe等多种金属互化物。确定某种金属互化物是晶体还是非晶体最可靠的科学方法是对固体进行_____。
(3)Ni能与类卤素(SCN)2反应生成Ni(SCN)2。Ni(SCN)2中,第一电离能最大的元素是____;(SCN)2分子中,硫原子的杂化方式是____ ,σ键和π键数目之比为_____。
(4)[Ni(NH3)6](NO3)2中,不存在的化学键为____ (填标号)。
a.离子键 b.金属键 c.配位键 d.氢键
(5)镍合金储氢的研究已取得很大进展。
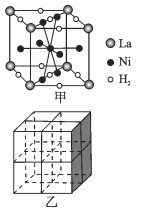
①图甲是一种镍基合金储氢后的晶胞结构示意图。 该合金储氢后,含1molLa的合金可吸附H2的数目为_____。
②Mg2NiH4是一种贮氢的金属氢化物。在Mg2NiH4晶胞中,Ni原子占据如图乙的顶点和面心,Mg2+ 处于乙图八个小立方体的体心。Mg2+位于Ni原子形成的 ___ (填“八面体空隙”或“四面体空隙”)。 若晶体的密度为dg/cm3,Mg2NiH4的摩尔质量为Mg/mol,则Mg2+和Ni原子的最短距离为 ___ nm(用含d、M、NA 的代数式表示)。
-
Ni元素在生产、生活中有着广泛的应用。回答下列问题:
(1)基态Ni原子价层电子的排布式为_______。
(2)科学家在研究金属矿物质组分的过程中,发现了Cu-Ni-Fe等多种金属互化物。确定某种金属互化物是晶体还是非晶体最可靠的科学方法是对固体进行______。
(3)Ni能与类卤素(SCN)2反应生成Ni(SCN)2。Ni(SCN)2中,第一电离能最大的元素是____;(SCN)2分子中,硫原子的杂化方式是___,σ键和π键数目之比为_____。
(4)[Ni(NH3)6](NO3)2中,不存在的化学键为_____(填标号)。
a.离子键 b.金属键 c.配位键 d.氢键
(5)解释CO比N2的熔沸点高的原因___。
(6)镍合金储氢的研究已取得很大进展。
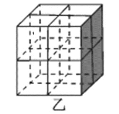
①图甲是一种镍基合金储氢后的晶胞结构示意图。该合金储氢后,含1 mol La的合金可吸附H2的数目为___。
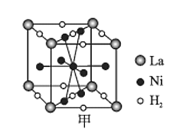
②Mg2NiH4是一种贮氢的金属氢化物。在Mg2NiH4晶胞中,Ni原子占据如图乙的顶点和面心,Mg2+处于乙图八个小立方体的体心。Mg2+位于Ni原子形成的___(填“八面体空隙”或“四面体空隙”)。若晶体的密度为d g/cm3,Mg2NiH4的摩尔质量为M g/mol,则Mg2+和Ni原子的最短距离为___nm(用含d、M、NA的代数式表示)。
-
【化学-选修3:物质结构与性质】
铁、铜及其化合物在日常生产、生活有着广泛的应用。请回答下列问题:
(1)铁在元素周期表中的位置是______________,基态铜原子的核外电子排布式为________________。
(2)配合物Fe(CO)x常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于____________(填晶体类型)。
(3)CO和CO的一种生活中常见等电子体分子,两者相比较沸点较高的为__________(填化学式)。CN-中碳原子杂化轨道类型为_______________,C、N、O三元素的第一电离能最大的为_______________(用元素符号表示)。
(4)铜晶体中铜原子的堆积方式如图1所示。每个铜原子周围距离最近的铜原子数目__________。
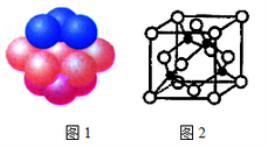
(5)M原子的价电子排布式为3s23p5,铜与M形成化合物的晶胞如图2所示(黑点代表铜原子)。
①该晶体的化学式为_____________。
②已知铜和M的电负性分别为1.9和3.0,则铜与M形成的化合物属于________________(填“离子”、“共价”)化合物。
③已知该晶体的密度为ρg·cm-3,阿伏伽德罗常数为NA,已知该晶体中铜原子和M原子之间的最短距离为体对角线的1/4,则该晶体中铜原子和M原子之间的最短距离为_______________pm(只写计算式)。
-
[化学——选修3:物质结构与性质]
铜、镓、砷等元素形成的化合物在现代工业中有广泛的用途,回答下列问题:
(1)基态铜原子的核外电子占有的能级数为________,轨道数为________。
(2)根据元素周期律,原子半径Ga________As,第一电离能Ga________As。(填“大于”或“小于”)
(3)AsCl3分子的立体构型为________,其中As的杂化轨道类型为________。
(4)铜与CN-可形成络合离子[Cu(CN-)4]2-,写出一种与CN-等电子体的分子化学式________;若将[Cn(CN-)4]2-中二个CN-换为Cl-,只有一种结构,则[Cu(CN-)4]2-中4个氮原子所处空间位置关系为________。
(5)GaAs的熔点为1238ºC,密度为p g·cm-3,其晶胞结构如图所示。该晶体的类型为________,Ga与As以________键键合。Ga和As的摩尔质量分别为MGag·mol-1和MAsg·mol-1,原子半径分别为rGa pm和rAs pm,阿伏加德罗常数值为NA,则GaAs晶胞中原子的体积占晶胞体积的百分率为________。
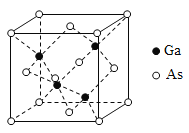
-
[化学——选修3:物质结构与性质]
铜、镓、砷等元素形成的化合物在现代工业中有广泛的用途,回答下列问题:
(1)基态铜原子的核外电子占有的能级数为________,轨道数为________。
(2)根据元素周期律,原子半径Ga________As,第一电离能Ga________As。(填“大于”或“小于”)
(3)AsCl3分子的立体构型为________,其中As的杂化轨道类型为________。
(4)铜与CN-可形成络合离子[Cu(CN-)4]2-,写出一种与CN-等电子体的分子化学式________;若将[Cn(CN-)4]2-中二个CN-换为Cl-,只有一种结构,则[Cu(CN-)4]2-中4个氮原子所处空间位置关系为________。
(5)GaAs的熔点为1238ºC,密度为p g·cm-3,其晶胞结构如图所示。该晶体的类型为________,Ga与As以________键键合。Ga和As的摩尔质量分别为MGag·mol-1和MAsg·mol-1,原子半径分别为rGa pm和rAs pm,阿伏加德罗常数值为NA,则GaAs晶胞中原子的体积占晶胞体积的百分率为________。
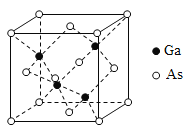

 ,其中S原子的杂化方式是______。 N、P可分别形成多种三角锥型分子,已知NH3的键角大于PH3,原因是____________。
,其中S原子的杂化方式是______。 N、P可分别形成多种三角锥型分子,已知NH3的键角大于PH3,原因是____________。








