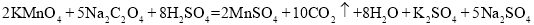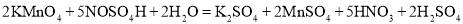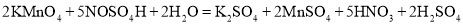-
亚硝酰硫酸(NOSO4H)纯品为棱形结晶,溶于硫酸,遇水易分解,常用于制染料。SO2和浓硝酸在浓硫酸存在时可制备NOSO4H,反应原理为:SO2 + HNO3 = SO3 + HNO2、SO3 + HNO2 = NOSO4H。
(1)亚硝酰硫酸(NOSO4H)的制备。
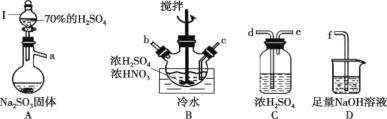
①仪器I的名称为______________,打开其旋塞后发现液体不下滴,可能的原因是_________________。
②按气流从左到右的顺序,上述仪器的连接顺序为__________________(填仪器接口字母,部分仪器可重复使用)。
③A中反应的方程式为___________。
④B中“冷水”的温度一般控制在20℃,温度不宜过高或过低的原因为________。
(2)亚硝酰硫酸(NOSO4H)纯度的测定。
称取1.500 g产品放入250 mL的碘量瓶中,并加入100.00 mL浓度为0.1000 mol·L-1的KMnO4标准溶液和10 mL 25%的H2SO4,摇匀;用0.5000 mol·L-1的Na2C2O4标准溶液滴定,滴定前读数1.02 mL, 到达滴定终点时读数为31.02 mL。
已知:i:□KMnO4 + □NOSO4H + □______ = □K2SO4 + □MnSO4 + □HNO3 + □H2SO4
ii:2KMnO4 + 5Na2C2O4 + 8H2SO4 = 2MnSO4 +10CO2↑+ 8H2O
①完成反应i的化学方程式:_____________
□KMnO4 + □NOSO4H + □______ = □K2SO4 + □MnSO4 + □HNO3 + □H2SO4
②滴定终点的现象为____________________。
③产品的纯度为__________________。
-
亚硝酰硫酸(NOSO4H)纯品为棱形结晶,溶于硫酸,遇水易分解,常用于制染料。制备NOSO4H的反应原理为: 、
、 。
。
(1)亚硝酰硫酸(NOSO4H)的制备。

①仪器Ⅰ的名称为_________。
②按气流从左到右的顺序,上述仪器的连接顺序为____(填仪器接口字母,部分仪器可重复使用)。
③为了控制B中通入SO2的速率,可以采取的措施是_____。
④NOSO4H遇水分解的化学方程式为______,若去掉装置C会使NOSO4H的产量____(填“增大”、“减少”或“无影响”)。
(2)亚硝酰硫酸(NOSO4H)纯度的测定。
准确称取1.337g产品加入250mL碘量瓶中,加入60.00mL浓度为0.1000mol·L-1KMnO4标准溶液和10mL25%H2SO4溶液,然后摇匀。用0.2500mol·L-1Na2C2O4标准溶液滴定,消耗Na2C2O4溶液的体积20.00mL。
己知:ⅰ.  + NOSO4H+
+ NOSO4H+  、 +
、 +  +
+  +
+ 
ⅱ.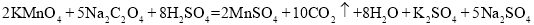
①完成反应ⅰ的离子方程式:
____ +____
+____ ____
____ ____+____
____+____ +____
+____ +____
+____
②滴定终点的现象为________。
③产品的纯度为_____%(保留两位有效数字)。
-
亚硝酰硫酸(NOSO4H)主要用于染料、医药等工业。实验室用如图装置(夹持装置略)制备少量NOSO4H,并测定产品的纯度。已知:NOSO4H遇水分解,但溶于浓硫酸而不分解。
(1)装置A制取SO2,反应的化学方程式为___。
(2)装置B中浓HNO3与SO2在浓H2SO4作用下反应制得NOSO4H。
①装置B应该使用的是___(填“冷水”或“温水”)浴。
②开始反应缓慢,待生成少量NOSO4H后,温度变化不大,但反应速度明显加快,其原因是__。
(3)该实验装置存在可能导致NOSO4H产量降低的缺陷是__。
(4)测定亚硝酰硫酸的纯度:
准确称取1.380g产品放入250mL的碘量瓶中,加入0.1000mol·L-1、60.00mL的KMnO4标准溶液和10mL25%H2SO4溶液,然后摇匀。用0.2500mol·L-1草酸钠标准溶液滴定,消耗草酸钠溶液的体积为20.00mL。
已知:2KMnO4+5NOSO4H+2H2O=K2SO4+2MnSO4+5HNO3+2H2SO4
①配平:__MnO4-+__C2O42-+__=__Mn2++__+__H2O
②滴定终点时的现象为__。
③亚硝酰硫酸的纯度=__。[M(NOSO4H)=127g·mol-1]
-
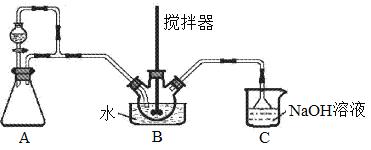
亚硝酰硫酸(NOSO4H)主要用于染料、医药等工业。实验室用如图装置(夹持装置略)制备少量NOSO4H,并测定产品的纯度。已知:NOSO4H遇水分解,但溶于浓硫酸而不分解。
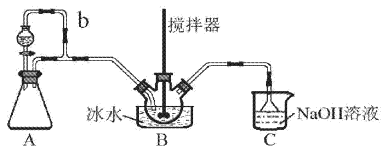
(1)装置A制取SO2
①A中反应的化学方程式为___。
②导管b的作用是___。
(2)装置B中浓HNO3与SO2在浓H2SO4作用下反应制得NOSO4H。
①该反应必须维持体系温度不得高于20℃,采取的措施除了冷水浴外,还可以是___(只写1种)。
②开始反应缓慢,待生成少量NOSO4H后,温度变化不大,但反应速度明显加快,其原因是___。
(3)装置C的主要作用是___(用离子方程式表示)。
(4)该实验装置存在可能导致NOSO4H产量降低的缺陷是___。
(5)测定亚硝酰硫酸NOSO4H的纯度
准确称取1.380g产品放入250mL的碘量瓶中,加入0.1000mol·L-1、60.00mL的KMnO4标准溶液和10mL25%H2SO4溶液,然后摇匀。用0.2500mol·L-1草酸钠标准溶液滴定,消耗草酸钠溶液的体积为20.00mL。
已知:2KMnO4+5NOSO4H+2H2O=K2SO4+2MnSO4+5HNO3+2H2SO4
①配平:__MnO4-+__C2O42-+__=__Mn2++__+__H2O
②滴定终点时的现象为___。
③亚硝酰硫酸的纯度=___。(精确到0.1%)[M(NOSO4H)=127g·mol-1]
-
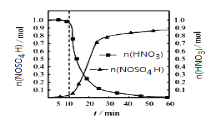
亚硝酰硫酸(NOSO4H)主要用于染料、医药等工业。实验室制备亚硝酰硫酸的方法如下:将SO2通入盛有浓硫酸和浓硝酸的混合液中,维持体系温度略低于20℃,搅拌,使其充分反应。反应过程中,亚硝酰硫酸的物质的量和硝酸的物质的量随时间的变化如图所示。
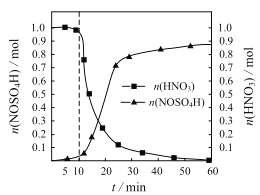
(1)①实验室制备NOSO4H的化学反应方程式为___。
②反应进行到10min后,反应速度明显加快,其可能的原因是___。
③反应过程中,硝酸减少的物质的量大于NOSO4H生成的物质的量的可能原因是___
(2)为了测定亚硝酰硫酸的纯度,进行如下实验:。
准确称取1.200g产品放入锥形瓶中,加入50.00mL0.1000mol·L-1的KMnO4标准溶液和足量稀H2SO4,摇匀,使其充分反应。再将反应后溶液加热至60~70℃(使生成的HNO3挥发逸出),冷却至室温,用0.2500mol·L-1Na2C2O4标准溶液滴定至终点,消耗Na2C2O4溶液的体积为16.00mL。
已知:2KMnO4+5NOSO4H+2H2O=K2SO4+2MnSO4+5HNO3+2H2SO4;KMnO4在酸性条件下被还原为Mn2+。
根据以上实验数据计算亚硝酰硫酸的纯度。(写出计算过程)___
-
亚硝酰硫酸[M(NOSO4H)=127g·mol-1]主要用于分散染料重氮反应中取代亚硝酸钠,从而降低成本,提高产品质量。实验室用如图装置(夹持装置略)制备少量NOSO4H,并测定产品的纯度。已知:NOSO4H遇水分解,但溶于浓硫酸而不分解。
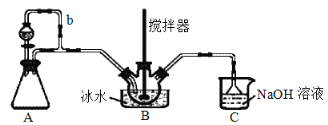
(1)装置A制取SO2,则A中反应的化学方程式为___,导管b的作用是___。
(2)SO2与装置B中盛有的浓硫酸和浓硝酸的混合液在维持体系温度不得高于20℃的条件下,反应制得NOSO4H。反应过程中,亚硝酰硫酸和硝酸的物质的量随时间的变化如图所示。反应进行到10min后,反应速度明显加快,其可能的原因是___。
(3)装置C的主要作用是__。
(4)该实验装置存在可能导致NOSO4H产量降低的缺陷是__。
(5)测定亚硝酰硫酸NOSO4H的纯度
准确称取1.500g产品放入250mL的碘量瓶中,加入0.1000mol·L-1、60.00mL的KMnO4标准溶液和10mL25%H2SO4溶液,然后摇匀。用0.2500mol·L-1草酸钠标准溶液滴定,消耗草酸钠溶液的体积为20.00mL。
已知:2KMnO4+5NOSO4H+2H2O=K2SO4+2MnSO4+5HNO3+2H2SO4
2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O
达到滴定终点时的现象为__,亚硝酰硫酸的纯度为__。
-
亚硝酰硫酸 是染料、医药等工业的重要原料;溶于浓硫酸,可在浓硫酸存在时用
是染料、医药等工业的重要原料;溶于浓硫酸,可在浓硫酸存在时用 和浓硝酸反应制得。实验室用如图装置制备少量亚硝酰硫酸(夹持装置略),并测定产品的纯度。
和浓硝酸反应制得。实验室用如图装置制备少量亚硝酰硫酸(夹持装置略),并测定产品的纯度。
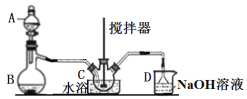
(1)仪器B的名称____________。
(2)B中产生SO2,其化学方程式为_______________________________________。
(3)三颈烧瓶C中浓硝酸与 在浓硫酸作用下反应制得
在浓硫酸作用下反应制得
①实验前浓硝酸和浓硫酸混合的操作为______________________________________。
②C中反应温度不能太高的原因为___________________________________。
③用冷水浴维持C温度不变,开始反应较慢,待生成少量 后,反应明显加快,其原因可能是______________________。
后,反应明显加快,其原因可能是______________________。
(4)测定产品的纯度
准确称取1.5g产品放入锥形瓶中,加入 、100.00mL的
、100.00mL的 溶液和足量稀硫酸,摇匀充分反应。然后用0.5000mol/L草酸钠标准溶液滴定,消耗草酸钠溶液的体积为30.00mL。
溶液和足量稀硫酸,摇匀充分反应。然后用0.5000mol/L草酸钠标准溶液滴定,消耗草酸钠溶液的体积为30.00mL。
已知: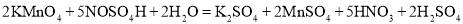
①草酸钠与高锰酸钾溶液反应的离子方程式为__________________________________。
②滴定终点的现象为______________________________________________。
③亚硝酰硫酸的纯度 ________。[保留三位有效数字,M(NOSO4H)=127g/mol]
________。[保留三位有效数字,M(NOSO4H)=127g/mol]
-
亚硝酰硫酸 是染料、医药等工业的重要原料;溶于浓硫酸,可在浓硫酸存在时用
是染料、医药等工业的重要原料;溶于浓硫酸,可在浓硫酸存在时用 和浓硝酸反应制得。实验室用如图装置制备少量亚硝酰硫酸(夹持装置略),并测定产品的纯度。
和浓硝酸反应制得。实验室用如图装置制备少量亚硝酰硫酸(夹持装置略),并测定产品的纯度。
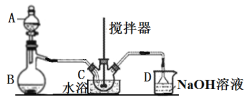
(1)仪器B的名称____________。
(2)B中产生SO2,其化学方程式为_______________________________________。
(3)三颈烧瓶C中浓硝酸与 在浓硫酸作用下反应制得
在浓硫酸作用下反应制得
①实验前浓硝酸和浓硫酸混合的操作为______________________________________。
②C中反应温度不能太高的原因为___________________________________。
③用冷水浴维持C温度不变,开始反应较慢,待生成少量 后,反应明显加快,其原因可能是______________________。
后,反应明显加快,其原因可能是______________________。
(4)测定产品的纯度
准确称取1.5g产品放入锥形瓶中,加入 、100.00mL的
、100.00mL的 溶液和足量稀硫酸,摇匀充分反应。然后用0.5000mol/L草酸钠标准溶液滴定,消耗草酸钠溶液的体积为30.00mL。
溶液和足量稀硫酸,摇匀充分反应。然后用0.5000mol/L草酸钠标准溶液滴定,消耗草酸钠溶液的体积为30.00mL。
已知: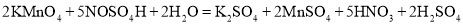
①草酸钠与高锰酸钾溶液反应的离子方程式为__________________________________。
②滴定终点的现象为______________________________________________。
③亚硝酰硫酸的纯度 ________。[保留三位有效数字,M(NOSO4H)=127g/mol]
________。[保留三位有效数字,M(NOSO4H)=127g/mol]
-
溴化亚铜可用于彩色照相,是一种白色结晶状粉末,见光分解,在空气中会慢慢氧化成绿色,溶于氢溴酸、盐酸、硝酸和氨水,在热水中也会发生分解。实验室制备CuBr的装置示意图和步骤如下:
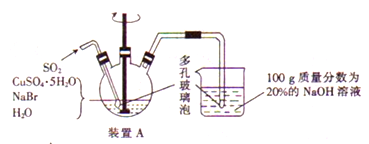
实验步骤:
①在装置A中加人50.0 g CuSO4o5H2O、30.9 g NaBr、150 mL蒸馏水,60℃时不断搅拌,以适当流速通入SO2;
②溶液冷却后倾去上层清液,在避光的条件下过滤;
③依次用溶有少量SO2的水、溶有少量SO2的乙醇、纯乙醚洗涤;
④在双层干燥器(分别装有浓硫酸和氢氧化钠)中干燥3〜4h,再经氢气流干燥,最后进行真空干燥,得到产品21.6 g。
回答下列问题:
(1)步骤②中过滤需要避光的原因是________________________________________________。
(2)步骤①中实验所用蒸馏水事先要进行的处理操作是_______________,控制反应在60℃条件下进行,实验中可采取的措施是________________________。
(3)步骤③中洗涤剂需“溶有SO2”的原因是__________________________________;最后洗涤剂改用乙醚的目的是_____________________________________。
(4)装置A中反应生成CuBr的离子方程式为__________________________;说明反应已完成的现象是_____________________________________________________。
(5)本实验产品的产率是_____________________。
-
溴化亚铜可用于彩色照相,是一种白色结晶状粉末,见光分解,在空气中会慢慢氧化成绿色,溶于氢溴酸、盐酸、硝酸和氨水,在热水中也会发生分解。实验室制备CuBr的装置示意图和步骤如下:
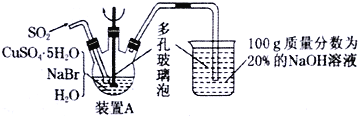
实验步骤:
①在装置A中加入50.0gCuSO4·5H2O、30.9gNaBr、150 mL蒸馏水,60℃时不断搅拌,以适当流速通入SO2;
②溶液冷却后倾去上层清液,在避光的条件下过滤;
③依次用溶有少量SO2的水、溶有少量SO2的乙醇、纯乙醚洗涤;
④在双层干燥器(分别装有浓硫酸和氢氧化钠)中干燥3~4 h,再经氢气流干燥,最后进行真空干燥,得到产品21.6g。
回答下列问题:
(1)步骤②中过滤需要避光的原因是___________。
(2)步骤①中实验所用蒸馏水事先要进行的处理操作是___________,控制反应在60℃条件下进行,实验中可采取的措施是___________。
(3)步骤③中洗涤剂需“溶有SO2”的原因是___________;最后洗涤剂改用乙醚的目的是___________。
(4)装置A中反应生成CuBr的离子方程式为___________;说明反应已完成的现象是___________。
(5)本实验产品的产率是___________。