-
硫化氢气体在资源利用和环境保护等方面均有重要应用。
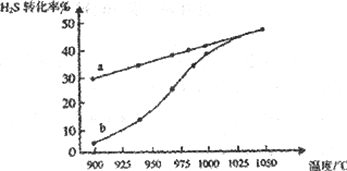
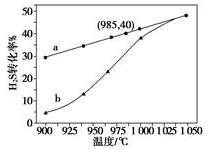
(1)工业采用高温分解H2S制取氢气,2H2S(g)  2H2(g) + S2(g),在膜反应器中分离出H2。在容积为 2L 的恒容密闭容器中,控制不同温度进行此反应。H2S的起始物质的量均为 1mol,实验过程中测得H2S的转化率如图所示。曲线 a 表示H2S的平衡转化率与温度的关系,曲线 b 表示不同温度下反应经过相同时间时H2S的转化率。
2H2(g) + S2(g),在膜反应器中分离出H2。在容积为 2L 的恒容密闭容器中,控制不同温度进行此反应。H2S的起始物质的量均为 1mol,实验过程中测得H2S的转化率如图所示。曲线 a 表示H2S的平衡转化率与温度的关系,曲线 b 表示不同温度下反应经过相同时间时H2S的转化率。

①反应2H2S(g)  2H2(g) + S2(g)的ΔH_________(填“>”“<”或“=”)0。
2H2(g) + S2(g)的ΔH_________(填“>”“<”或“=”)0。
②985℃时,反应经过5 s达到平衡状态,此时H2S的转化率为40%,则用H2表示的反应速率为v(H2) =___________。
③随着H2S分解温度的升高,曲线b向曲线a逐渐靠近,其原因是___________。
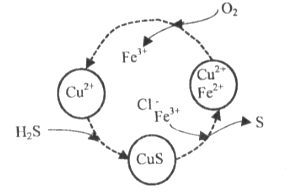
(2)将H2S和空气的混合气体通入FeCl3 、FeCl2 、CuCl2的混合溶液中反应回收S,其物质转化如下图所示。
①在图示的转化中,化合价不变的元素是____________。
②在温度一定和不补加溶液的条件下,缓慢通入混合气体,并充分搅拌。欲使生成的硫单质中不含CuS,可采取的措施有____________。

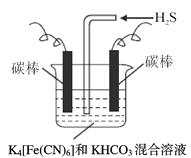
(3)工业上常采用上图电解装置电解K4[Fe(CN)6]和KHCO3混合溶液,电解一段时间后,通入H2S 加以处理。利用生成的铁的化合物K3[Fe(CN)6]将气态废弃物中的H2S 转化为可利用的S,自身转化为K4[Fe(CN)6]。
①电解时,阳极的电极反应式为___________。
②当有16 g S析出时,阴极产生的气体在标准状况下的体积为___________。
③通入H2S 时发生如下反应,补全离子方程式:_________________

-
硫化氢气体在资源利用和环境保护等方面均有重要应用。
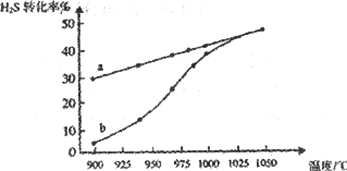
(1)工业上采用高温分解H2S制取氢气,2H2S(g) 2H2(g)+S2(g),在膜反应器中分离出H2。在容积为2L的恒容密闭容器中,控制不同温度进行此反应。H2S的起始物质的量均为1mol,实验过程中测得H2S的转化率如图所示。曲线a表示H2S的平衡转化率与温度的关系,曲线b表示不同温度下反应经过相同时间时H2S的转化率。
2H2(g)+S2(g),在膜反应器中分离出H2。在容积为2L的恒容密闭容器中,控制不同温度进行此反应。H2S的起始物质的量均为1mol,实验过程中测得H2S的转化率如图所示。曲线a表示H2S的平衡转化率与温度的关系,曲线b表示不同温度下反应经过相同时间时H2S的转化率。
①反应2H2S(g) 2H2(g)+S2(g)的
2H2(g)+S2(g)的 H___________(填“>”“<’或“=”)0。
H___________(填“>”“<’或“=”)0。
②985℃时,反应经过5s达到平衡状态,此时H2S的转化率为40%,则用H2表示的反应速率为v(H2)=____________。
③随着H2S分解温度的升高,曲线b向曲线a逐渐靠近,其原因是____________。
(2)将H2S和空气的混合气体通入FeCl3、FeCl2、CuCl2的混合溶液中反应回收S,其物质转化如下图所示。
①在图示的转化中,化合价不变的元素是____________。
②在温度一定和不补加溶液的条件下,缓慢通入混合气体,并充分搅拌。欲使生成的硫单质中尽可能不含CuS,可采取的措施有________。
-
硫化氢气体在资源利用和环境保护等方面均有重要应用。
(1)工业上采用高温分解H2S制取氢气,2H2S(g) 2H2(g)+S2(g),在膜反应器中分离出H2。在容积为2L的恒容密闭容器中,控制不同温度进行此反应。H2S的起始物质的量均为1mol,实验过程中测得H2S的转化率如图所示。曲线a表示H2S的平衡转化率与温度的关系,曲线b表示不同温度下反应经过相同时间时H2S的转化率。
2H2(g)+S2(g),在膜反应器中分离出H2。在容积为2L的恒容密闭容器中,控制不同温度进行此反应。H2S的起始物质的量均为1mol,实验过程中测得H2S的转化率如图所示。曲线a表示H2S的平衡转化率与温度的关系,曲线b表示不同温度下反应经过相同时间时H2S的转化率。
①反应2H2S(g) 2H2(g)+S2(g)的
2H2(g)+S2(g)的 H___________(填“>”“<’或“=”)0。
H___________(填“>”“<’或“=”)0。
②985℃时,反应经过5s达到平衡状态,此时H2S的转化率为40%,则用H2表示的反应速率为v(H2)=____________。
③随着H2S分解温度的升高,曲线b向曲线a逐渐靠近,其原因是____________。
(2)将H2S和空气的混合气体通入FeCl3、FeCl2、CuCl2的混合溶液中反应回收S,其物质转化如下图所示。
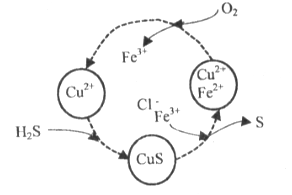
①在图示的转化中,化合价不变的元素是____________。
②在温度一定和不补加溶液的条件下,缓慢通入混合气体,并充分搅拌。欲使生成的硫单质中尽可能不含CuS,可采取的措施有________。
-
硫化氢是一种有臭鸡蛋气味的剧毒气体,在生产、生活及科研中均有重要应用。
(1)工业上采用高温热分解H2S的方法制取H2,在膜反应器中分离出H2,发生的反应为2H2S(g) 2H2(g)+S2(g)△H
2H2(g)+S2(g)△H
已知:①H2S(g) H2(8)+S(g)△H1
H2(8)+S(g)△H1
②2S(g) S2(g)△H2
S2(g)△H2
则△H=________(用含△H1、△H2的式子表示)。
(2)在容积2 L的恒容密闭容器中,控制不同温度进行H2S分【解析】
2H2S(g) 2H2(g)+S2(g)。H2S的起始物质的量均为1mol,实验过程中测得H2S的转化率如图1所示。曲线a表示H2S的平衡转化率与温度的关系,曲线b表示不同温度下反应经过相同时间时H2S的转化率。
2H2(g)+S2(g)。H2S的起始物质的量均为1mol,实验过程中测得H2S的转化率如图1所示。曲线a表示H2S的平衡转化率与温度的关系,曲线b表示不同温度下反应经过相同时间时H2S的转化率。
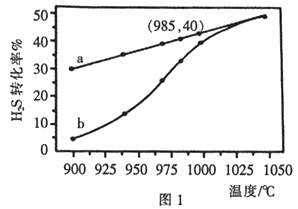
①反应2H2S (g) 2H2(g)+S2(g)是放热还是吸热,判断并说理由________。
2H2(g)+S2(g)是放热还是吸热,判断并说理由________。
②随着H2S分解温度的升高,曲线b向曲线a逐渐靠近,其原因是________ 。
③在985℃时,该反应经过5 s达到平衡,则该反应的平衡常数为________。在图2中画出985℃时,0~6s 体系中S2(g)浓度随时间的变化曲线。___________________
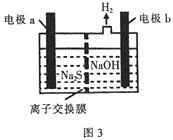
(3)工业上常用NaOH溶液吸收H2S废气,吸收后所得溶液进行电解(装置如图3所示),在阳极区可生成Sx2-,写出生成Sx2-离子的电极反应式:________。
-
硫化氢分解制取氢气和硫黄的反应原理为2H2S(g) S2(g)+2H2(g),在2.0 L恒容密闭容器中充入0.1 mol H2S,不同温度下测得H2S的转化率与时间的关系如图所示。下列说法不正确的是
S2(g)+2H2(g),在2.0 L恒容密闭容器中充入0.1 mol H2S,不同温度下测得H2S的转化率与时间的关系如图所示。下列说法不正确的是
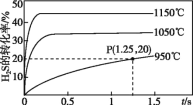
A.正反应为吸热反应
B.图中P点:v正>v逆
C.950 ℃时,0~1.25 s生成H2的平均反应速率为0.008 mol·L-1·s-1
D.950 ℃时,该反应的平衡常数的值小于3.125×10-4
-
废气中的H2S通过高温热分解可制取氢气:2H2S(g) 2H2(g)+S2(g)。现在3L密闭容器中,控制不同温度进行H2S分解实验。
2H2(g)+S2(g)。现在3L密闭容器中,控制不同温度进行H2S分解实验。
(1)某温度时,测得反应体系中有气体1.3lmol,反应1 min后,测得气体为l.37mol,则tmin 内H2的生成速率为___________。
(2)某温度时,H2S的转化率达到最大值的依据是_____________(选填编号)。
a.气体的压强不发生变化 b.气体的密度不发生变化
c. 不发生变化 d.单位时间里分解的H2S和生成的H2一样多
不发生变化 d.单位时间里分解的H2S和生成的H2一样多
(3)实验结果如下图。图中曲线a表示H2S的平衡转化率与温度关系,曲线b表示不同温度下、反应经过相同时间且未达到化学平衡时H2S的转化率。该反应为_____反应(填“放热”或“吸热”)。曲线b随温度的升高,向曲线a通近的原因是_________。在容器体积不变的情况下,如果要提高H2的体积分数,可采取的一种措施是________。
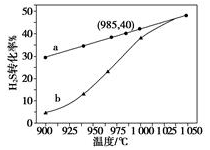
(4)使1LH2S与20L空气(空气中O2体积分数为0.2)完全反应后恢复到室温,混合气体的体积是______L 。若2gH2S完全燃烧后生成二氧化硫和水蒸气,同时放出29.4 kJ的热量,该反应的热化学方程式是__________________。
-
废气中的H2S通过高温热分解可制取氢气:2H2S(g) 2H2(g)+S2(g)。现在3L密闭容器中,控制不同温度进行H2S分解实验。
2H2(g)+S2(g)。现在3L密闭容器中,控制不同温度进行H2S分解实验。
(1)某温度时,测得反应体系中有气体1.3lmol,反应1 min后,测得气体为l.37mol,则tmin 内H2的生成速率为___________。
(2)某温度时,H2S的转化率达到最大值的依据是_____________(选填编号)。
a.气体的压强不发生变化 b.气体的密度不发生变化
c.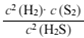 不发生变化 d.单位时间里分解的H2S和生成的H2一样多
不发生变化 d.单位时间里分解的H2S和生成的H2一样多
(3)实验结果如下图。图中曲线a表示H2S的平衡转化率与温度关系,曲线b表示不同温度下、反应经过相同时间且未达到化学平衡时H2S的转化率。该反应为_____反应(填“放热”或“吸热”)。曲线b随温度的升高,向曲线a通近的原因是_________。在容器体积不变的情况下,如果要提高H2的体积分数,可采取的一种措施是________。
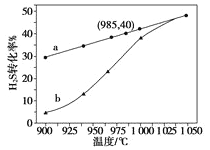
(4)使1LH2S与20L空气(空气中O2体积分数为0.2)完全反应后恢复到室温,混合气体的体积是______L 。若2gH2S完全燃烧后生成二氧化硫和水蒸气,同时放出29.4 kJ的热量,该反应的热化学方程式是__________________。
-
废气中的H2S通过高温热分解可制取氢气:2H2S(g) 2H2(g)+S2(g)。现在3L密闭容器中,控制不同温度进行H2S分解实验。
2H2(g)+S2(g)。现在3L密闭容器中,控制不同温度进行H2S分解实验。
(1)某温度时,测得反应体系中有气体1.3lmol,反应1 min后,测得气体为l.37mol,则tmin 内H2的生成速率为___________。
(2)某温度时,H2S的转化率达到最大值的依据是_____________(选填编号)。
a.气体的压强不发生变化 b.气体的密度不发生变化
c. 不发生变化 d.单位时间里分解的H2S和生成的H2一样多
不发生变化 d.单位时间里分解的H2S和生成的H2一样多
(3)实验结果如下图。图中曲线a表示H2S的平衡转化率与温度关系,曲线b表示不同温度下、反应经过相同时间且未达到化学平衡时H2S的转化率。该反应为_____反应(填“放热”或“吸热”)。曲线b随温度的升高,向曲线a通近的原因是_________。在容器体积不变的情况下,如果要提高H2的体积分数,可采取的一种措施是________。
(4)使1LH2S与20L空气(空气中O2体积分数为0.2)完全反应后恢复到室温,混合气体的体积是______L 。若2gH2S完全燃烧后生成二氧化硫和水蒸气,同时放出29.4 kJ的热量,该反应的热化学方程式是__________________。
-
氢气是一种清洁能源,氢气的制取和储存是氢能源利用领域的研究热点。
(1)H2S 热分解制氢的原理: 2H2S(g)=2H2(g) + S2(g) △H= 169.8 kJ/mol,分解时常向反应器中通入一定比例空气,使部分H2S 燃烧,其目的是______;燃烧生成的SO2与H2S 进一步反应,硫元素转化为S2,写出反应的化学方程式:________。
(2)氨硼烷(NH3BH3) 是储氢量最高的材料之一,其受热时固体残留率随温度的变化如图甲所示。氨硼烷还可作燃料电池,其工作原理如图乙所示。

①110℃时残留固体的化学式为_________。
②氨硼烷电池工作时负极的电极反应式为_________。
(3)十氢萘(C10H18)是具有高储氢密度的氢能载体,经历“C10H18- C10H12-C10H8”的脱氢过程释放氢气。己知:
C10H18(l) C10H12(l) +3H2(g) △H1
C10H12(l) +3H2(g) △H1
C10H12(l) C10H8(l)+2H2(g) △H2
C10H8(l)+2H2(g) △H2
温度335℃、高压下,在恒容密闭反应器中进行液态十氢萘( 1.00 mol) 催化脱氢实验,测得C10H12和C10H8的物质的量n1 和n2随时间的变化关系如图丙所示。图丁表示催化剂对反应活化能的影响。
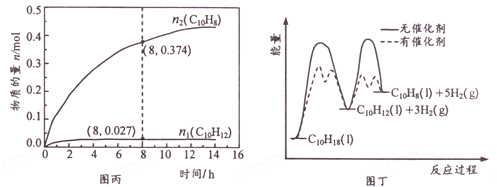
①△H1___△H2(选填“>”、“=”或“<”)。
② 8 h 时,反应体系内氢气的物质的量为_____mol(忽略其他副反应)。
③ n1 显著低于n2 可能的原因是__________。
-
氢气是一种清洁能源,氢气的制取和储存是氢能源利用领域的研究热点。
(1)H2S 热分解制氢的原理: 2H2S(g)=2H2(g) + S2(g) △H= 169.8 kJ/mol,分解时常向反应器中通入一定比例空气,使部分H2S 燃烧,其目的是______;燃烧生成的SO2与H2S 进一步反应,硫元素转化为S2,写出反应的化学方程式:________。
(2)氨硼烷(NH3BH3) 是储氢量最高的材料之一,其受热时固体残留率随温度的变化如图甲所示。氨硼烷还可作燃料电池,其工作原理如图乙所示。

①110℃时残留固体的化学式为_________。
②氨硼烷电池工作时负极的电极反应式为_________。
(3)十氢萘(C10H18)是具有高储氢密度的氢能载体,经历“C10H18- C10H12-C10H8”的脱氢过程释放氢气。己知:
C10H18(l) C10H12(l) +3H2(g) △H1
C10H12(l) +3H2(g) △H1
C10H12(l) C10H8(l)+2H2(g) △H2
C10H8(l)+2H2(g) △H2
温度335℃、高压下,在恒容密闭反应器中进行液态十氢萘( 1.00 mol) 催化脱氢实验,测得C10H12和C10H8的物质的量n1 和n2随时间的变化关系如图丙所示。图丁表示催化剂对反应活化能的影响。

①△H1___△H2(选填“>”、“=”或“<”)。
② 8 h 时,反应体系内氢气的物质的量为_____mol(忽略其他副反应)。
③ n1 显著低于n2 可能的原因是__________。
2H2(g) + S2(g),在膜反应器中分离出H2。在容积为 2L 的恒容密闭容器中,控制不同温度进行此反应。H2S的起始物质的量均为 1mol,实验过程中测得H2S的转化率如图所示。曲线 a 表示H2S的平衡转化率与温度的关系,曲线 b 表示不同温度下反应经过相同时间时H2S的转化率。

2H2(g) + S2(g)的ΔH_________(填“>”“<”或“=”)0。











 不发生变化 d.单位时间里分解的H2S和生成的H2一样多
不发生变化 d.单位时间里分解的H2S和生成的H2一样多
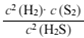 不发生变化 d.单位时间里分解的H2S和生成的H2一样多
不发生变化 d.单位时间里分解的H2S和生成的H2一样多
 不发生变化 d.单位时间里分解的H2S和生成的H2一样多
不发生变化 d.单位时间里分解的H2S和生成的H2一样多



