-
过氧乙酸(CH3COOOH)是一种高效消毒剂,性质不稳定遇热易分解,可利用高浓度的双氧水和冰醋酸反应制得,某实验小组利用该原理在实验室中合成少量过氧乙酸。装置如图所示。回答下列问题:
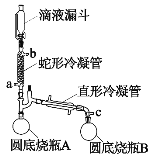
已知:①常压下过氧化氢和水的沸点分别是158℃和100℃。
②过氧化氢易分解,温度升高会加速分解。
③双氧水和冰醋酸反应放出大量的热。
(1)双氧水的提浓:蛇形冷凝管连接恒温水槽,维持冷凝管中的水温为60℃,c口接抽气泵,使装置中的压强低于常压,将滴液漏斗中低浓度的双氧水(质量分数为30%)滴入蛇形冷凝管中。
①蛇形冷凝管的进水口为___________。
②向蛇形冷凝管中通入60℃水的主要目的是________。
③高浓度的过氧化氢最终主要收集在______________(填圆底烧瓶A/圆底烧瓶B)。
(2)过氧乙酸的制备:向100mL的三颈烧瓶中加入25mL冰醋酸,滴加提浓的双氧水12mL,之后加入浓硫酸1mL,维持反应温度为40℃,磁力搅拌4h后,室温静置12h。
①向冰醋酸中滴加提浓的双氧水要有冷却措施,其主要原因是__________。
②磁力搅拌4h的目的是____________。
(3)取V1mL制得的过氧乙酸溶液稀释为100mL,取出5.0mL,滴加酸性高锰酸钾溶液至溶液恰好为浅红色(除残留H2O2),然后加入足量的KI溶液和几滴指示剂,最后用0.1000mol/L的Na2S2O3溶液滴定至终点,消耗标准溶液V2mL(已知:过氧乙酸能将KI氧化为I2;2Na2S2O3+I2=Na2S4O6+2NaI)。
①滴定时所选指示剂为_____________,滴定终点时的现象为___________。
②过氧乙酸与碘化钾溶液反应的离子方程式为_________。
③制得过氧乙酸的浓度为________mol/L。
-
过氧乙酸(CH3COOOH)不仅在卫生医疗、食品消毒及漂白剂领域有广泛应用,也应用于环境工程、精细化工等领域。实验室利用醋酸(CH3COOH)与双氧水(H2O2)共热, 在固体酸的催化下制备过氧乙酸(CH3COOOH),其装置如下图所示。请回答下列问题:
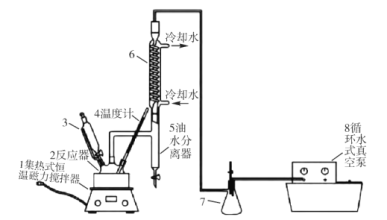
实验步骤:
I.先在反应瓶中加入冰醋酸、乙酸丁酯和固体酸催化剂,开通仪器1和8,温度维持为55℃;
II.待真空度达到反应要求时,打开仪器3的活塞,逐滴滴入浓度为35%的双氧水,再通入冷却水;
Ⅲ.从仪器 5定期放出乙酸丁酯和水的混合物,待反应结束后分离反应器2中的混合物,得到粗产品。
(1)仪器 6的名称是______,反应器 2中制备过氧乙酸(CH3COOOH)的化学反应方程式为_____。
(2)反应中维持冰醋酸过量,目的是提高_____;分离反应器 2中的混合物得到粗产品,分离的方法是_________。
(3)实验中加入乙酸丁酯的主要作用是_________(选填字母序号)。
A 作为反应溶剂,提高反应速率
B 与固体酸一同作为催化剂使用,提高反应速率
C 与水形成沸点更低的混合物,利于水的蒸发,提高产率
D 增大油水分离器 5的液体量,便于实验观察
(4)从仪器 5定期放出乙酸丁酯和水的混合物,待观察到___________(填现象)时,反应结束。
(5)粗产品中过氧乙酸(CH3COOOH)含量的测定:取一定体积的样品 VmL,分成 6等份,用过量 KI溶液与过氧化物作用,以 0.1mol• L-1的硫代硫酸钠溶液滴定碘(I2+2S2O32-=2I-+S4O62-);重复 3次,平均消耗量为 V1mL。再以 0.02mol• L-1的酸 性高锰酸钾溶液滴定样品,重复 3次,平均消耗量为 V2mL。则样品中的过氧乙酸的浓度为 ______mol• L-1。
-
过氧乙酸(CH3COOOH)是一种高效消毒剂,具有很强的氧化性和腐蚀性,可以迅速杀灭多种微生物,包括多种病毒(如SARS病毒)、细菌、真菌及芽孢。过氧乙酸可由冰醋酸与过氧化氢在一定条件下作用制得,有关过氧乙酸的叙述中正确的是( )
A.过氧乙酸与羟基乙酸(HOCH2COOH)互为同分异构体
B.过氧乙酸与有杀菌作用的苯酚混合使用,可增强过氧乙酸杀菌效果
C.由下列过氧乙酸的制取原理可以看出,过氧乙酸是酯的同系物
CH3COOH+H—O—O—H—→CH3—C—O—O—H+H2O
D.浓过氧乙酸溶液中加入少许紫色石蕊试液一定呈红色
-
过氧乙酸(CH3COOOH)是一种高效消毒剂,具有很强的氧化性和腐蚀性,它可由冰醋酸与过氧化氢在一定条件下制得;它可以迅速杀灭多种微生物,包括多种病毒(如:SARS病毒)、细菌、真菌及芽孢。有关过氧乙酸的叙述正确的是
A.过氧乙酸不能使品红褪色
B.过氧乙酸可与苯酚混合使用
C.过氧乙酸分子中只含有极性键
D.过氧乙酸与羟基乙酸(HOCH2COOH)互为同分异构体
-
过氧乙酸(CH3COOOH)是一种高效消毒剂,具有很强的氧化性和腐蚀性,它可由冰醋酸与过氧化氢在一定条件下制得;它可以迅速杀灭多种微生物,包括多种病毒(如:SARS病毒、禽流感病毒)、细菌、真菌及芽孢。下面是市售过氧乙酸商品标签:

有关资料:H2O2是极弱的电解质,在酸性介质中才能稳定存在,是一种强氧化剂。过氧乙酸消毒液是由H2O2、H2O、CH3COOH及少量H2SO4混合后,反应生成过氧乙酸(CH3COOOH)。CH3COOOH容易放出氧原子,它与空气中微生物机体作用,达到灭菌目的,是消毒液的主要成分。
(1)某研究性学习小组为了弄清配制过氧乙酸消毒液的甲、乙溶液的主要成分各是什么?进行以下科学探究,请你完成下列相关内容:
①提出假设:甲溶液的主要成分为_________,乙溶液的主要成分为_________。
②实验验证:取甲、乙两种溶液少许,分别加入几滴_________试液,若①中假设正确,则甲溶液的现象为_____________________,乙溶液的现象为__________。
(2)有关过氧乙酸的叙述正确的是_________ (填编号)
A.过氧乙酸与羟基乙酸(HOCH2COOH)互为同分异构体
B.过氧乙酸与苯酚混合使用可增强消毒效果
C.过氧乙酸与乙酸属于同系物
D.氧元素的化合价为-2价
(3)实验室制备少量过氧乙酸,可由冰醋酸和过氧化氢在浓硫酸催化作用下制得,实验装置和步骤如下:
①在三颈烧瓶中加入一定量冰醋酸与浓H2SO4的混合液体,再缓缓加入适量30%的双氧水。
②不断搅拌并控制B中混合液的温度为20~30℃至反应结束。
③接入冷凝管和抽气泵,在锥形瓶中收集得到产品。
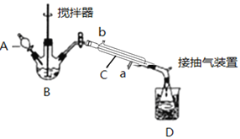
请回答下列问题:
①仪器C的名称是_______________;
②为更好地控制反应温度,应采用方法是_________________;
③生成过氧乙酸的化学方程式为________________________________________;
④碘量法取2.00mL过氧乙酸试样稀释成100mL,从中取出5.00mL,滴加酸性KMnO4溶液至恰好粉红色以除去残余H2O2,再加入10mL 10%KI溶液和几滴淀粉溶液,摇匀,反应完全后再用0.1000mol/L的Na2S2O3标准液滴定至终点(反应方程式为2Na2S2O3+I2=Na2S4O6+2NaI),共消耗14.30mL Na2S2O3标准液。该样品中过氧乙酸的物质的量浓度是_____mol/L。(结果保留小数点后两位)(提示:CH3COOOH+2I−+2H+ =I2+CH3COOH +H2O)
-
过氧乙酸( ),是一种高效消毒剂,它可由冰醋酸和过氧化氢在浓硫酸催化作用下制得,实验装置和步骤如下
),是一种高效消毒剂,它可由冰醋酸和过氧化氢在浓硫酸催化作用下制得,实验装置和步骤如下
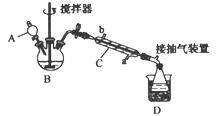
①在三颈烧瓶中加入一定量冰醋酸与浓硫酸的混合物,再缓缓加入适量30%的双氧水;
②不断搅拌并控制装置B中混合液的温度为20~30℃至反应结束;
③接入仪器C和抽气泵,在锥形瓶中收集得到产品。
回答下列问题:
(1)仪器C的名称是_______,仪器C中冷水流入口是_______ (填“a”或“b”)。
(2)为更好地控制反应温度,应采用的加热方法是______________。
(3)生成过氧乙酸的化学方程式为_________________。
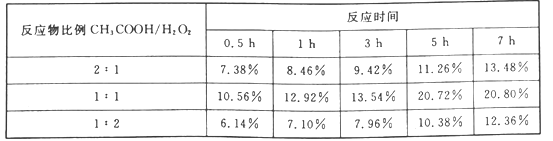
(4)实验测得产物过氧乙酸的百分含量随反应物比例和反应时间的变化数据如下表。由表中数据可知,反应物最佳比例(CH3COOH/H2O2)是_______,最佳反应时间约_______。
(5)产品中过氧乙酸浓度的测定:取2.00mL过氧乙酸产品试样,加水稀释成100mL;从中取出5.00mL,逐滴滴加酸性KMnO4溶液至溶液恰好呈粉红色,以除去残余的H2O2;再加入稍过量的KI溶液,发生反应CH3COOOH+2I-+2H+=I2+CH3COOH+H2O;反应完全后,滴入几滴淀粉溶液,用0.1000mol·L-1的Na2S2O3标准液滴定至终点(反应式为2S2O32-+I2=S4O62-+2I-),消耗14.30mLNa2S2O3标准液。则产品中过氧乙酸的物质的量浓度是________mol·L-1 (保留2位小数)。
-
过氧乙酸( ),是一种高效消毒剂,它可由冰醋酸和过氧化氢在浓硫酸催化作用下制得,实验装置和步骤如下:
),是一种高效消毒剂,它可由冰醋酸和过氧化氢在浓硫酸催化作用下制得,实验装置和步骤如下:
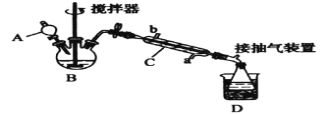
①在三颈烧瓶中加入一定量冰醋酸与浓硫酸的混合物,再缓缓加入适量30%的双氧水;
②不断搅拌并控制装置B中混合液的温度为20~30℃至反应结束;
③接入仪器C和抽气泵,在锥形瓶中收集得到产品。
回答下列问题:
(1)仪器C的名称是____,仪器C中冷水流入口是____(填“a”或“b”)。
(2)为更好地控制反应温度,应采用的加热方法是_____。
(3)生成过氧乙酸的化学方程式为____。
(4)实验测得产物过氧乙酸的百分含量随反应物比例和反应时间的变化数据如下表。由表中数据可知,反应物最佳比例(CH3COOH/H2O2)是_____,最佳反应时间约_____。
| 反应物比例CH3COOH/H2O2 | 反应时间 |
| 0.5h | 1h | 3h | 5h | 7h |
| 2:1 | 7.38% | 8.46% | 9.42% | 11.26% | 13.48% |
| 1:1 | 0.56% | 12.92% | 13.54% | 20.72% | 20.80% |
| 1:2 | 6.14% | 7.10% | 7.96% | 10.38% | 12.36% |
(5)产品中过氧乙酸浓度的测定:取2.00mL过氧乙酸产品试样,加水稀释成100mL;从中取出5.00mL,逐滴滴加酸性KMnO4溶液至溶液恰好呈粉红色,以除去残余的H2O2;再加入稍过量的KI溶液,发生反应CH3COOOH+2I-+2H+=I2+CH3COOH+H2O;反应完全后,滴入几滴淀粉溶液,用0.1000mol·L-1的Na2S2O3标准液滴定至终点(反应式为2S2O32-+I2=S4O62-+2I-),消耗14.30mLNa2S2O3标准液。则产品中过氧乙酸的物质的量浓度是____mol·L-1(保留2位小数)。
-
过氧乙酸(CH3COOOH)是无色透明液体,易溶于水、易挥发,见光易分解,具有强氧化性的高效消毒剂,使用过氧乙酸消毒剂时通常先用水稀释工业品过氧乙酸,然后用喷雾法对空气与地面进行消毒.
(1)配制220mL0.05mol/L的过氧乙酸溶液,需使用的仪器有:烧杯、量筒、玻璃棒及__________________、____________________;
(2)配制过程中,可能引起浓度偏高的操作有__________________
A.容量瓶用蒸馏水洗涤后未干燥,含有少量蒸馏水
B.转移溶液时,不慎有少量溶液洒在容量瓶外
C.定容时,俯视容量瓶刻度线进行定容
D.定容后,把容量瓶倒置摇匀后发现液面低于刻度线,补充几滴水至刻度线
(3)过氧乙酸半小时内会完全分解成乙酸(CH3COOH)和一种常见的气体单质,检验该气体单质的实验方法是_____________________________.
(4)如果生产过氧乙酸的原料CH3COONa中混有了SO42﹣,要想除掉SO42﹣请选择下列试剂按照加入先后顺序填空__________________________________________(试剂不必选完,填序号即可)
①盐酸;②醋酸钡溶液;③氯化钡溶液;④醋酸;⑤碳酸钠溶液;⑥NaHCO3溶液.
(5)制取过氧乙酸反应原理为:H2O2+CH3COOH CH3COOOH(过氧乙酸)+H2O,现称取5.0g用上述方法制取的过氧乙酸试样(液体),稀释至100mL备用.取上述稀释后过氧乙酸试样5.0mL,用0.01mol/L KMnO4溶液以除去其中的H2O2,随即加入10% KI溶液10 mL,摇匀(化学反应方程式为CH3COOOH+2KI=CH3COOK+I2+KOH)再将0.05mol/L Na2S2O3标准溶液加入到上述混合溶液中(化学反应方程式为:I2+2Na2S2O3=2NaI+Na2S4O6),消耗Na2S2O3标准溶液的总体积为20mL.通过计算确定原试样中过氧乙酸的质量分数为____________________.
CH3COOOH(过氧乙酸)+H2O,现称取5.0g用上述方法制取的过氧乙酸试样(液体),稀释至100mL备用.取上述稀释后过氧乙酸试样5.0mL,用0.01mol/L KMnO4溶液以除去其中的H2O2,随即加入10% KI溶液10 mL,摇匀(化学反应方程式为CH3COOOH+2KI=CH3COOK+I2+KOH)再将0.05mol/L Na2S2O3标准溶液加入到上述混合溶液中(化学反应方程式为:I2+2Na2S2O3=2NaI+Na2S4O6),消耗Na2S2O3标准溶液的总体积为20mL.通过计算确定原试样中过氧乙酸的质量分数为____________________.
-
(共11分)抗击“非典”期间,过氧乙酸(CH3COOOH)是广为使用的消毒剂。它可由H2O2和冰醋酸反应制取,所以在过氧乙酸中常含有残留的H2O2。测定产品中过氧乙酸浓度c0。涉及下列反应:
①□MnO4-+□H2O2+□H+ =□Mn2++□O2↑十□H2O
②H2O2+2 +2H+ = I2+2H2O
+2H+ = I2+2H2O
③CH3COOOH+2 +2H+ = CH3COOH+I2+H2O
+2H+ = CH3COOH+I2+H2O
④I2 + 2S2O32- =2I- + S4O62-
请回答以下问题:
(l)配平反应①的离子方程式(配平系数填入以下方框内):
□MnO4-+□H2O2+□H+ = □Mn2++□O2↑十□H2O
(2)用单线桥法在下面已配平的化学方程式上标出电子转移的方向和数目:
□MnO4-+□H2O2+□H+ = □Mn2++□O2↑十□H2O
(3)用Na2S2O3标准溶液滴定I2时(反应④)选用的指示剂是____________________。
(4)取b0 L待测液,用硫酸使溶液酸化,再用浓度为a1 mol· 的KMnO4标准溶液滴定其中的H2O2,耗用的KMnO4体积为b1 L(反应①,滴定过程中KMnO4不与过氧乙酸反应)。另取b0 L待测液,加入过量的KI,并用硫酸使溶液酸化,此时过氧乙酸和残留的H2O2都能跟 KI反应生成 I2(反应②和③)。再用浓度为a2 mol·
的KMnO4标准溶液滴定其中的H2O2,耗用的KMnO4体积为b1 L(反应①,滴定过程中KMnO4不与过氧乙酸反应)。另取b0 L待测液,加入过量的KI,并用硫酸使溶液酸化,此时过氧乙酸和残留的H2O2都能跟 KI反应生成 I2(反应②和③)。再用浓度为a2 mol· 的Na2S2O3标准溶液滴定生成的I2,耗用Na2S2O3溶液体积为b2 L。请根据上述实验数据计算过氧乙酸的浓度(用含a1、a2、b0、b1、b2的代数式表示)。c0= _______________ mol·
的Na2S2O3标准溶液滴定生成的I2,耗用Na2S2O3溶液体积为b2 L。请根据上述实验数据计算过氧乙酸的浓度(用含a1、a2、b0、b1、b2的代数式表示)。c0= _______________ mol· 。
。
(5)为计算待测液中过氧乙酸的浓度c0,加入的KI的质量已过量但没有准确称量,是否影响测定结果 ________(填是或否)
-
抗击“非典”期间,过氧乙酸(CH3COOOH)是广为使用的消毒剂。它可由H2O2和冰醋酸反应制取,所以在过氧乙酸中常含有残留的H2O2。测定产品中过氧乙酸浓度c0。涉及下列反应:
①□MnO4-+□H2O2+□H+ =□Mn2++□O2↑十□H2O
②H2O2+2 +2H+ = I2+2H2O
+2H+ = I2+2H2O
③CH3COOOH+2 +2H+ = CH3COOH+I2+H2O
+2H+ = CH3COOH+I2+H2O
④I2 + 2S2O32- =2I- + S4O62-
请回答以下问题:
(l)配平反应①的离子方程式(配平系数填入以下方框内):
□MnO4-+□H2O2+□H+ = □Mn2++□O2↑十□H2O
(2)用单线桥法在下面已配平的化学方程式上标出电子转移的方向和数目:
□MnO4-+□H2O2+□H+ = □Mn2++□O2↑十□H2O
(3)用Na2S2O3标准溶液滴定I2时(反应④)选用的指示剂是____________________。
(4)取b0 L待测液,用硫酸使溶液酸化,再用浓度为a1 mol· 的KMnO4标准溶液滴定其中的H2O2,耗用的KMnO4体积为b1 L(反应①,滴定过程中KMnO4不与过氧乙酸反应)。另取b0 L待测液,加入过量的KI,并用硫酸使溶液酸化,此时过氧乙酸和残留的H2O2都能跟 KI反应生成 I2(反应②和③)。再用浓度为a2 mol·
的KMnO4标准溶液滴定其中的H2O2,耗用的KMnO4体积为b1 L(反应①,滴定过程中KMnO4不与过氧乙酸反应)。另取b0 L待测液,加入过量的KI,并用硫酸使溶液酸化,此时过氧乙酸和残留的H2O2都能跟 KI反应生成 I2(反应②和③)。再用浓度为a2 mol· 的Na2S2O3标准溶液滴定生成的I2,耗用Na2S2O3溶液体积为b2 L。请根据上述实验数据计算过氧乙酸的浓度(用含a1、a2、b0、b1、b2的代数式表示)。c0= _______________ mol·
的Na2S2O3标准溶液滴定生成的I2,耗用Na2S2O3溶液体积为b2 L。请根据上述实验数据计算过氧乙酸的浓度(用含a1、a2、b0、b1、b2的代数式表示)。c0= _______________ mol· 。
。
(5)为计算待测液中过氧乙酸的浓度c0,加入的KI的质量已过量但没有准确称量,是否影响测定结果 ________(填是或否)






