-
二甲醚是一种清洁能源,用水煤气制取甲醚的原理如下:
I.CO(g)+2H2(g) CH3OH(g)
CH3OH(g)
II.2CH3OH(g)===CH3OCH3(g)+H2O(g)
(1)300℃和500℃时,反应I的平衡常数分别为K1、K2,且K1>K2,则其正反应为_______反应(填“吸热”或“放热”)。
(2)在恒容密闭容器中发生反应I:
①下图能正确反映体系中甲醇体积分数随温度变化情况的曲线是______________(填“a”或“b”)。
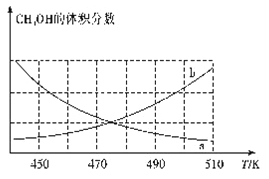
②下列说法能表明反应已达平衡状态的是____(填标号)。
A.容器中气体的压强不再变化 B.混合气体的密度不再变化
C.混合气体的平均相对分子质量不再变化 D.v正(H2)=2v正(CH3OH)
(3)500K时,在2L密闭容器中充入4 mol CO和8 mol H2,4 min达到平衡,平衡时CO的转化率为80%,且2c(CH3OH)=c(CH3OCH3) ,则:
① 0~4 min,反应I的v(H2)=______,反应I的平衡常数K=______。
② 反应II中CH3OH的转化率α=_______。
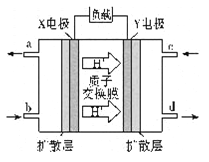
(4)二甲醚燃料电池的工作原理如图听示,则X电极的电极反应式为_______。用该电池对铁制品镀铜,当铁制品质量增加64 g时,理论上消耗二甲醚的质量为_______g(精确到0.01)。
-
二甲醚是一种清洁能源,用水煤气制取甲醚的原理如下:
I.CO(g)+2H2(g) CH3OH(g)
CH3OH(g)
II.2CH3OH(g)===CH3OCH3(g)+H2O(g)
(1)300℃和500℃时,反应I的平衡常数分别为K1、K2,且K1>K2,则其正反应为_______反应(填“吸热”或“放热”)。
(2)在恒容密闭容器中发生反应I:
①下图能正确反映体系中甲醇体积分数随温度变化情况的曲线是______________(填“a”或“b”)。
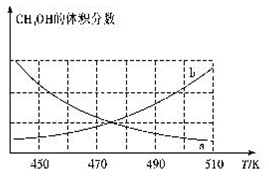
②下列说法能表明反应已达平衡状态的是____(填标号)。
A.容器中气体的压强不再变化 B.混合气体的密度不再变化
C.混合气体的平均相对分子质量不再变化 D.v正(H2)=2v正(CH3OH)
(3)500K时,在2L密闭容器中充入4 mol CO和8 mol H2,4 min达到平衡,平衡时CO的转化率为80%,且2c(CH3OH)=c(CH3OCH3) ,则:
① 0~4 min,反应I的v(H2)=______,反应I的平衡常数K=______。
② 反应II中CH3OH的转化率α=_______。
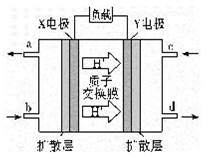
(4)二甲醚燃料电池的工作原理如图听示,则X电极的电极反应式为_______。用该电池对铁制品镀铜,当铁制品质量增加64 g时,理论上消耗二甲醚的质量为_______g(精确到0.01)。
-
二甲醚(DME)被誉为“21世纪的清洁燃料”。由合成气制备二甲醚的主要原理如下:
① CO(g)+2H2(g) CH3OH(g) △H 1=-90.7 kJ·mol-1
CH3OH(g) △H 1=-90.7 kJ·mol-1
② 2CH3OH(g) CH3OCH3(g)+H2O(g) △H 2=-23.5 kJ·mol-1
CH3OCH3(g)+H2O(g) △H 2=-23.5 kJ·mol-1
③ CO(g)+H2O(g) CO2(g)+H2(g) △H 3=-41.2kJ·mol-1
CO2(g)+H2(g) △H 3=-41.2kJ·mol-1
回答下列问题:
(1)则反应3H2(g)+3CO(g) CH3OCH3(g)+CO2(g)的△H=______kJ·mol-1。
CH3OCH3(g)+CO2(g)的△H=______kJ·mol-1。
(2)反应①达平衡后采取下列措施,能提高CH3OH产率的有__________。
A.加入H2 B.升高温度 C.增大压强 D.使用催化剂
(3)在一定温度下,将4mol CO和4mol H2混合置于2L的密闭容器中发生反应3H2(g)+3CO(g) CH3OCH3(g)+CO2(g),60s时达到平衡状态时,测得气体的总物质的量为4mol。达平衡时,氢气的转化率为__________,用CO表示的反应速率为__________,该反应的平衡常数为__________。
CH3OCH3(g)+CO2(g),60s时达到平衡状态时,测得气体的总物质的量为4mol。达平衡时,氢气的转化率为__________,用CO表示的反应速率为__________,该反应的平衡常数为__________。
(4)以下说法能说明反应3H2(g)+3CO(g) CH3OCH3(g)+CO2(g)达到平衡状态的有__________。
CH3OCH3(g)+CO2(g)达到平衡状态的有__________。
A. 氢气和二氧化碳的浓度之比为3∶1
B.单位时间内断裂3个H-H同时断裂1个C=O
C.恒温恒容条件下,气体的密度保持不变
D.恒温恒压条件下,气体的平均摩尔质量保持不变
E.绝热体系中,体系的温度保持不变
(5)二甲醚燃料电池的工作原理如图所示:
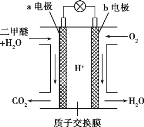
该电池负极的电极反应式为__________。
-
二甲醚(DME)被誉为“21世纪的清洁燃料”。由合成气制备二甲醚的主要原理如下:
① CO(g)+2H2(g) CH3OH(g) △H 1=-90.7 kJ·mol-1
CH3OH(g) △H 1=-90.7 kJ·mol-1
② 2CH3OH(g) CH3OCH3(g)+H2O(g) △H 2=-23.5 kJ·mol-1
CH3OCH3(g)+H2O(g) △H 2=-23.5 kJ·mol-1
③ CO(g)+H2O(g) CO2(g)+H2(g) △H 3=-41.2kJ·mol-1
CO2(g)+H2(g) △H 3=-41.2kJ·mol-1
回答下列问题:
(1)则反应3H2(g)+3CO(g) CH3OCH3(g)+CO2(g)的△H= kJ·mol-1。
CH3OCH3(g)+CO2(g)的△H= kJ·mol-1。
(2)下列措施中,能提高CH3OCH3产率的有 。
A.使用过量的CO B.升高温度 C.增大压强
(3)反应③能提高CH3OCH3的产率,原因是 。
(4)将合成气以n(H2)/n(CO)=2通入1 L的反应器中,一定条件下发生反应:
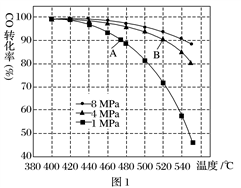
4H2(g)+2CO(g)  CH3OCH3(g)+H2O(g) △H,其CO的平衡转化率随温度、压强变化关系如图1所示,下列说法正确的是 。
CH3OCH3(g)+H2O(g) △H,其CO的平衡转化率随温度、压强变化关系如图1所示,下列说法正确的是 。
A.△H <0
B.P1<P2<P3
C.若在P3和316℃时,起始时n(H2)/n(CO)=3,则达到平衡时,CO转化率小于50%[
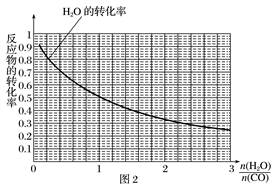
(5)采用一种新型的催化剂(主要成分是Cu-Mn的合金),利用CO和H2制备二甲醚。观察图2回答问题。催化剂中n(Mn)/n(Cu)约为 时最有利于二甲醚的合成。
(6)图3为绿色电源“二甲醚燃料电池”的工作原理示意图,a电极的电极反应式为 。
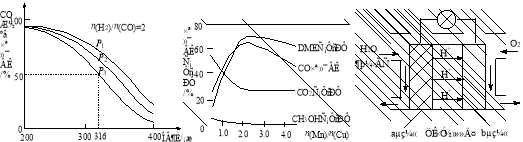
图1 图2 图3
(7)甲醇液相脱水法制二甲醚的原理是:CH3OH +H2SO4→CH3HSO4+H2O,
CH3 HSO4+CH3OH→CH3OCH3+H2SO4。与合成气制备二甲醚比较,该工艺的优点是反应温度低,转化率高,其缺点是 。
-
二甲醚(DME)被誉为“21世纪的清洁燃料”。由合成气制备二甲醚的主要原理如下:
①CO(g)+2H2(g) CH3OH(g) △H1=- 90.7 kJ·mol-1
CH3OH(g) △H1=- 90.7 kJ·mol-1
②2CH3OH(g) CH3OCH3(g)+H2O(g) △H2=-23.5 kJ·mol-1
CH3OCH3(g)+H2O(g) △H2=-23.5 kJ·mol-1
③CO(g)+H2O(g) CO2(g)+H2(g) △H3=-41.2 kJ·mol-1
CO2(g)+H2(g) △H3=-41.2 kJ·mol-1
回答下列问题:
(1)则反应3H2(g)+3CO(g) CH3OCH3(g)+CO2(g)的△H=_____________ kJ·mol-1。
CH3OCH3(g)+CO2(g)的△H=_____________ kJ·mol-1。
(2)在不同温度下按照相同物质的量投料发生反应①,测得CO的平衡转化率与压强的关系如图所示,下列说法正确的是_____________。
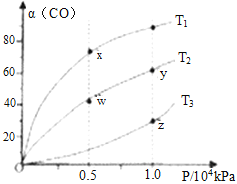
A.反应温度: T1>T2 B.正反应速率:υ正(y)=υ正(w)
C.混合气体密度: ρ(x)>ρ(w) D.混合气体平均摩尔质量:M(y)<M(z)
E.该反应的△S<0、△H<0,所以能在较低温度下自发进行
(3)采用一种新型的催化剂(主要成分是Cu-Mn 的合金),利用CO和H2制备二甲醚(DME)。如图回答问题; 催化剂中 约为_____________时最有利于二甲醚的合成。
约为_____________时最有利于二甲醚的合成。

(4)高温时二甲醚发生分解反应: CH3OCH3 CH4+CO+H2。迅速将二甲醚引入一个504℃的抽成真空的瓶中,在不同时刻t测定瓶内压强P总如下表。
CH4+CO+H2。迅速将二甲醚引入一个504℃的抽成真空的瓶中,在不同时刻t测定瓶内压强P总如下表。
| t/min | 0 | 10 | 20 | 30 | 40 | 50 |
| P总/kPa | 50.0 | 78.0 | 92.0 | 99.0 | 100 | 100 |
①该反应的平衡常数表达式为Kp=_____________。
②该反应的平衡常数Kp=_____________。(带单位。某一物质的平衡分压=总压×物质的量分数)
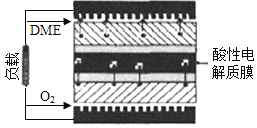
(5)一种以二甲醚作为燃料的燃料电池的工作原理如图所示。则其负极的电极反应式为_______________。该电池的理论输出电压为1.20V,则其能量密度E=_____________(列式计算。能量密度=电池输出电能/燃料质量,1kW·h=3.6×106J,法拉第常数F=96500C·mol-1)。
-
工业上用DME法以H2和CO为原料生产甲醚(CH3 OCH3)。其原理是在同一容器中发生如下两个连续反应:
①2H2(g) +CO(g) CH3OH(g)
CH3OH(g)
②2CH3OH(g) CH3OCH3(g)+H2O(g)
CH3OCH3(g)+H2O(g)
当达到平衡时实验数据如表,下列分析正确的是
| 温度(℃) 平衡态 | 260 | 270 | 280 | 290 | 300 | 310 | 320 |
| CO转化率(%) | 92 | 87 | 82 | 80 | 72 | 65 | 62 |
| CH3OCH3产率(%) | 33 | 45 | 77 | 79 | 62 | 58 | 52 |
A.反应①、②均为吸热反应
B.290℃时反应②平衡常数值达到最大
C.平衡时,反应①与②中CH3OH的消耗速率一定相等
D.增大压强能增大CH3OCH3产率
-
二甲醚是一种重要的化工原料,利用水煤气(CO、H2)合成二甲醚是工业上的常用方法,该方法由以下几步组成:
2H2(g)+CO(g)  CH3OH(g) ΔH=-90.0 kJ·mol-1①
CH3OH(g) ΔH=-90.0 kJ·mol-1①
2CH3OH(g)  CH3OCH3(g)+H2O(g) ΔH=-24.5 kJ·mol-1②
CH3OCH3(g)+H2O(g) ΔH=-24.5 kJ·mol-1②
CO(g)+H2O(g)  CO2(g)+H2(g) ΔH= -41.1 kJ·mol-1③
CO2(g)+H2(g) ΔH= -41.1 kJ·mol-1③
(1)下列说法正确的是________(填字母)。
A.反应①的ΔS<0、ΔH<0,所以能在较低温度下自发进行
B.反应③的H2O与CO的生成速率之比为1∶1时,表示该反应已经达到平衡状态
C.反应②属于加成反应
(2)反应①合成的甲醇在工业上可以用作燃料电池,请写出甲醇燃料电池(KOH溶液)负极电极反应式 :_______________,电池总反应离子方程式:___________________。
:_______________,电池总反应离子方程式:___________________。
(3)当合成气中CO与H2的物质的量之比恒定时,温度、压强对CO转化率影响如图1所示,图1中A点的v(逆)________(填“>”“<”或“=”)B点的v(正),说明理由_____________________________________。
(4)一定温度下,密闭容器中发生反应③,该反应的平衡常数表达式K=________________________;水蒸气的转化率与 的关系如图2,计算该温度下反应③的平衡常数K=______。在图2中作出一氧化碳的转化率与
的关系如图2,计算该温度下反应③的平衡常数K=______。在图2中作出一氧化碳的转化率与 的曲线。_________________________
的曲线。_________________________
-
密闭容器中,由H2和CO直接制备二甲醚(CH3OCH3),其过程包含以下反应:
i. CO(g)+2H2(g) CH3OH(g)
CH3OH(g)  H1=-90.1 kJ·mol-1
H1=-90.1 kJ·mol-1
ii. 2CH3OH(g) CH3OCH3(g)+H2O(g)
CH3OCH3(g)+H2O(g)  H2=-24.5 kJ·mol-1
H2=-24.5 kJ·mol-1
当其他条件相同时,由H2和CO直接制备二甲醚的反应中,CO平衡转化率随条件X的变化曲线如下图所示。下列说法正确的是

A.由H2和CO直接制备二甲醚的反应为放热反应
B.条件X为压强
C.X增大,二甲醚的产率一定增大
D.X增大,该反应的平衡常数一定减小
-
甲醚(CH3OCH3)是一种新型能源。
已知①CO(g)+2H2(g)⇌CH3OH(g) ∆H1=-99kJ/mol
②2CH3OH(g)⇌CH3OCH3(g)+H2O(g) ∆H2=-24kJ/mol
③CO(g)+H2O(g)⇌CO2(g)+H2(g) ∆H3=-41kJ/mol
回答下列问题:
(1)写出CO和H2反应生成CO2和CH3OCH3(g)的热化学方程式:________________。
(2)下列措施能提高反应①中CO的平衡转化率的是________(填字母)。
A.增大压强 B.升高温度 C.增大H2浓度 D.加高效催化剂
(3)在恒温恒容条件下只发生反应③,下列情况表明该反应达到平衡的是________(填字母)。
A.气体压强保持不变 B.气体密度保持不变
C. 保持不变 D.浓度商保持不变
保持不变 D.浓度商保持不变
(4)在一定温度(T℃)下,向恒容密闭容器中投入一定量CH3OH气体,只发生反应②。气体混合物中CH3OCH3的物质的量分数[φ(CH3OCH3)]与反应时间(t)的有关数据如表所示。
| t/min | 0 | 15 | 30 | 45 | 80 | 100 |
| [φ(CH3OCH3)] | 0 | 0.05 | 0.08 | 0.09 | 0.10 | 0.10 |
①30min时,CH3OH的转化率α(CH3OH)________%;该温度下,上述反应的平衡常数K=________(用分数表示)。
②反应速率v=v正-v逆,其中v正=k正∙φ2(CH3OH)、v逆=k逆∙φ(CH3OCH3)∙φ(H2O),k正、k逆分别为正、逆反应速率常数,只与温度有关,φ为物质的量分数。15min时 ________(结果保留2位小数)
________(结果保留2位小数)
(5)在密闭容器中发生反应③,平衡常数为K,pK=-lg2K。pK温度的关系如图所示,图中曲线________(填“a”或“b”)能反映平衡常数变化趋势。

(6)在CO2处理过的饱和KHCO3溶液中,电解活化的CO2制备CH3OCH3的原理如图所示,阴极上有HCO3-生成,该电的电极反应式为________。

-
(15分)二甲醚(DME)和甲醇是21世纪应用最广泛的两种清洁燃料,目前工业上均可由合成气在特定催化剂作用下制得。
(1)由合成气制备二甲醚的主要原理如下:
已知:①CO(g)+2H2(g) CH3OH(g) △H1=-90.7 kJ·mol-1
CH3OH(g) △H1=-90.7 kJ·mol-1
②2CH3OH(g) CH3OCH3(g)+H2O(g) △H2=-23.5 kJ·mol-1
CH3OCH3(g)+H2O(g) △H2=-23.5 kJ·mol-1
③CO(g)+H2O(g) CO2(g)+H2(g) △H3=-41.2 kJ·mol-1
CO2(g)+H2(g) △H3=-41.2 kJ·mol-1
则反应3H2(g)+3CO(g) CH3OCH3(g)+CO2(g)的△H= kJ·mol-1。
CH3OCH3(g)+CO2(g)的△H= kJ·mol-1。
(2)将合成气以n(H2)/n(CO)=2通入1 L的反应器中,一定条件下发生反应:
4H2(g)+2CO(g) CH3OCH3(g)+H2O(g),其中CO的平衡转化率随温度、压强变化关系如图所示:
CH3OCH3(g)+H2O(g),其中CO的平衡转化率随温度、压强变化关系如图所示:
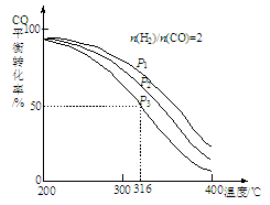
①该反应的平衡常数表达式为 ;P1、P2、P3由大到小的顺序为 。
②若反应在P3和316℃时,起始时n(H2)/n(CO)=3,则达到平衡时,CO的转化率 50%(填“大于”、“小于”或“等于”)。
(3)由合成气合成甲醇的反应的温度与平衡常数(K)的关系如表数据,


250℃时,将2 molCO和6 molH2充入2L的密闭容器中发生反应,反应时间与物质浓度的关系如图所示,则前10分钟内,氢气的平均反应速率为 ;若15分钟时,只改变温度一个条件,假设在20分钟时达到新平衡,氢气的转化率为33.3%,此时温度为 (从上表中选),请在图中画出15—25分钟c (CH3OH)的变化曲线。
(4)利用甲醇液相脱水也可制备二甲醚,原理是:CH3OH +H2SO4→CH3HSO4+H2O,CH3HSO4+CH3OH→CH3OCH3+H2SO4。与合成气制备二甲醚比较,该工艺的优点是反应温度低,转化率高,其缺点是 。
CH3OH(g)
















