-
(1)从化学键的角度分析,化学反应的过程就是反应物的化学键被破坏和生成物的化学键的形成过程。已知反应:N2(g)+3H2(g)⇌2NH3(g)△H。有关键能数据如下:
| 化学键 | H-H | N-H | N≡N |
| 键能)kJ/mol) | 436 | 391 | 945 |
根据表中所列键能数据可得△H=____________。
(2)已知:CH3OH(g)+H2O(g)=CO2(g)+3H2(g)△H= +49.0kJ/mol
CH3OH(g)+ O2(g)=CO2(g)+2H2O(g)△H= -192.9kJ/mol
O2(g)=CO2(g)+2H2O(g)△H= -192.9kJ/mol
已知水的气化热为44.0kJ/mol,表示氢气燃烧热的热化学方程式为______________。
(3)已知化学反应A(g)+B(g)⇌C(g)+D(g),900℃时向一个体积为2L的密闭容器中充入0.20mol A和0.80mol B,2s时达到平衡,A的浓度变化0.05mol/L,则A的平均反应速率v(A) =________,平衡时B的转化率为____ ,C的体积百分数为_______ 。
(4)CO、H2可用于合成甲醇和甲醚,其反应为(m、n均大于 ):
):
反应①:CO(g)+2H2(g)⇌CH3OH(g)△H=-m kJ/mol
反应②:2CO(g)+4H2(g)⇌CH3OCH3(g)+H2O(g)△H=-n kJ/mol
反应③:2CH3OH(g)⇌CH3OCH3(g)+H2O(g)△H<0
根据上述的热化学方程式可以判断则2m_____n(填“大于”、“小于”、“等于”或“无法确定”)。
-
工业上合成氨反应为:N2+3H2 2NH3,回答下列问题:
2NH3,回答下列问题:
(1)反应过程中拆开的化学键是_______;
(2)反应放热,从价键角度分析,反应放热的原因是_______,下列图像正确的是_______。

(3)在体积是2L的密闭容器中开始加入1molN2,3molH2,反应过程浓度中,物质的浓度与时间的关系如图所示。
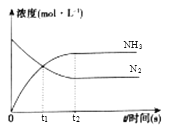
①t1时生成NH3的物质的量是_______;用H2表示的化学反应速率υ(H2)=_______。
②下列各项能表明反应达到化学平衡状态的是_______。
A.容器中气体的密度保持不变
B.容器中气体的压强不变
C.氨气的含量不变
D.拆开3molH—H键同时形成6molN—H键
(4)下列措施中能提高合成氨反应化学反应速率的是_______。
A.使用高效催化剂 B.恒温恒容再充入氢气 C.降低反应温度 D.扩大容器体积
-
从能量的变化和反应的快慢等角度研究化学反应具有重要意义。
(1)已知一定条件下,反应N2+3H2=2NH3为放热反应:
①下图能正确表示该反应中能量变化的是____;

②根据下表数据,计算生成1 molNH3时该反应放出的热量为____kJ;
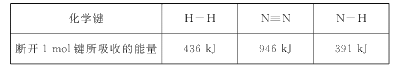
③一定温度下,将3 molH2和1 molN2通入容积为2L的密闭容器中发生反应,5 min达到平衡,测得c(NH3)=0.6 mol/L,则0至5 min时v(N2)=___,达到平衡时H2的转化率为____。
(2)某兴趣小组为研究原电池原理,设计如图装置。
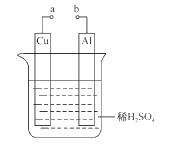
①a和b用导线连接,Cu极为原电池____极(填“正”或“负”),电极反应式是____;Al极发生____(填“氧化”或“还原”)反应,其电极反应式为____,溶液中SO42-移向____(填“Cu”或“Al”极)。溶液pH____(填增大或减小);当负极金属溶解5.4g时,____NA电子通过导线。
②不将a、b连接,请问如何加快Al与稀硫酸的反应速率?_______________
-
从能量的变化和反应的快慢等角度研究化学反应具有重要意义。
(1)已知一定条件下,反应N2+3H2 2NH3为放热反应;:
2NH3为放热反应;:
①下图能正确表示该反应中能量变化的是________;
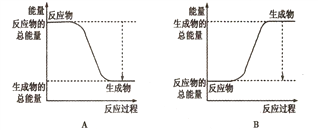
②根据下表数据,计算生成1molNH3时该反应放出的热量为______kJ;
| 化学键 | H-H | N≡N | N-H |
| 断开1mol键所吸收的能量 | 436kJ | 946kJ | 391kJ |
③一定温度下,将3molH2和1molN2通入容积为2L的密闭容器中发生反应,5min达到平衡,测得c(NH3)=0.4mol/L,则O至5min时 (N2)=______,反应开始与平衡时气体的物质的量之比为__________;
(N2)=______,反应开始与平衡时气体的物质的量之比为__________;
(2)原电池可将化学能转化为电能。由A、B、C、D四种金属按下表中装置进行实验:
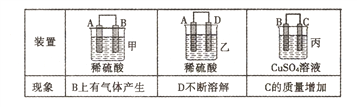
①装置甲甲SO42-向________ 极移动(填“A”或“B”);
②四种金属活动性由强到弱的顺序是____;
③若装置丙中的电极为质量相等的铁棒和铜棒,电池工作一段时间后.取出洗净、干燥、称量.两电极质量差为6g。则导线中通过电子的物质的量为______mol。
-
从能量的变化和反应的快慢等角度研究化学反应具有重要意义。
(1)已知一定条件下,反应N2+3H2 2NH3为放热反应;:
2NH3为放热反应;:
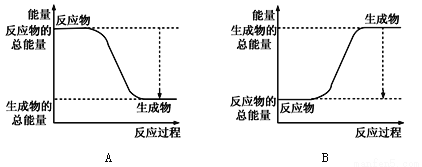
①下图能正确表示该反应中能量变化的是________;
②根据下表数据,计算生成1molNH3时该反应放出的热量为______kJ;
| 化学键 | H-H | N≡N | N-H |
| 断开1mol键所吸收的能量 | 436kJ | 946kJ | 391kJ |
③一定温度下,将3molH2和1molN2通入容积为2 L的密闭容器中发生反应。若5min达到平衡,测得c(NH3)=0.4mol/L,则0至5min内N2的平均化学反应速率v(N2)=______,反应开始与平衡时气体的物质的量之比为__________;若达到平衡时,该容器内混合气体总压强为p,混合气体起始压强为p0 ,请用p0、p来表示达到平衡时H2的转化率为__________。
④ 在③反应条件下,能够判断该反应已经达到化学平衡状态的是______________。
A.容器内混合气体密度不变
B.混合气体的压强不变
C.单位时间内生成n mol N2 的同时生成2n mol NH3
D. v (N2)=2v(NH3)
(2)原电池可将化学能转化为电能。由A、B、C、D四种金属按下表中装置进行实验:
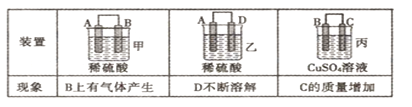
①装置甲中SO 向________ 极移动(填“A”或“B”);
向________ 极移动(填“A”或“B”);
②四种金属活动性由强到弱的顺序是_____________;
③若装置丙中的电极为质量相等的铁棒和铜棒,电池工作一段时间后,取出洗净、干燥、称量,两电极质量差为6g,则导线中通过电子的物质的量为______mol。
-
从能量的变化和反应的快慢等角度研究化学反应具有重要意义。
(1)已知一定条件下,反应N2+3H2 2NH3为放热反应;:
2NH3为放热反应;:
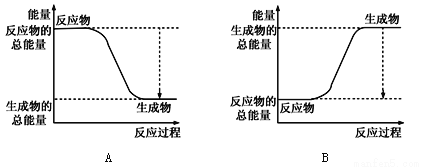
①下图能正确表示该反应中能量变化的是________;
②根据下表数据,计算生成1molNH3时该反应放出的热量为______kJ;
| 化学键 | H-H | N≡N | N-H |
| 断开1mol键所吸收的能量 | 436kJ | 946kJ | 391kJ |
③一定温度下,将3molH2和1molN2通入容积为2 L的密闭容器中发生反应。若5min达到平衡,测得c(NH3)=0.4mol/L,则0至5min内N2的平均化学反应速率v(N2)=______,反应开始与平衡时气体的物质的量之比为__________;若达到平衡时,该容器内混合气体总压强为p,混合气体起始压强为p0 ,请用p0、p来表示达到平衡时H2的转化率为__________。
④ 在③反应条件下,能够判断该反应已经达到化学平衡状态的是______________。
A.容器内混合气体密度不变
B.混合气体的压强不变
C.单位时间内生成n mol N2 的同时生成2n mol NH3
D. v (N2)=2v(NH3)
(2)原电池可将化学能转化为电能。由A、B、C、D四种金属按下表中装置进行实验:
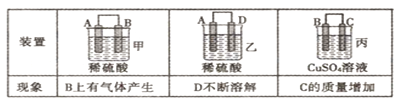
①装置甲中SO 向________ 极移动(填“A”或“B”);
向________ 极移动(填“A”或“B”);
②四种金属活动性由强到弱的顺序是_____________;
③若装置丙中的电极为质量相等的铁棒和铜棒,电池工作一段时间后,取出洗净、干燥、称量,两电极质量差为6g,则导线中通过电子的物质的量为______mol。
-
(5分)已知化学反应N2+3H2=2NH3的能量变化如图所示,
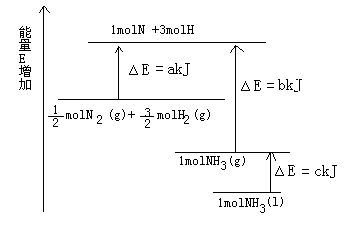
(1)1mol N 和3mol H 生成1mol NH3(g)是________能量的过程(填“吸收”或“释放”)。
(2) N2(g)+
N2(g)+ H2(g)=NH3(g);
H2(g)=NH3(g);
△H=________;
(3)N2(g)和H2生成NH3(1)的热化学方程式为________
-
已知化学反应N2+3H2 2NH3的能量变化如图所示,
2NH3的能量变化如图所示,
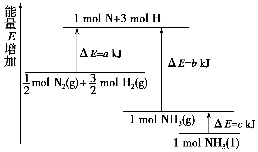
(1)1 mol N和3 mol H生成1 mol NH3(g)是________能量的过程(填“吸收”或“释放”)。
(2)由 mol N2(g)和
mol N2(g)和 mol H2(g)生成1 mol NH3(g)过程________(填“吸收”或“释放”)________kJ能量。
mol H2(g)生成1 mol NH3(g)过程________(填“吸收”或“释放”)________kJ能量。
-
下列对化学反应的理解不正确的是
A.从化学键的角度分析,化学反应中一定有旧键的断裂和新键的形成
B.从能量的角度分析,化学反应中一定有能量的变化
C.从物质的种类分析,化学反应中一定有新物质的生成
D.从微观角度分析,化学反应中一定有分子种类的变化
-
下列说法中正确的是( )
A、在化学反应过程中,发生物质变化的同时不一定发生能量变化
B、生成物全部化学键形成时所释放的能量大于破坏反应物全部化学键所吸收的能量时,
反应为吸热反应
C、生成物的总焓大于反应物的总焓时,反应吸热,ΔH>0
D、ΔH的大小与热化学方程式的计量系数无关
O2(g)=CO2(g)+2H2O(g)△H= -192.9kJ/mol
):












