-
I.已知在 1×105 Pa、298 K 时断裂 1 mol H—H 键吸收的能量为 436 kJ,断裂 1 mol N—H 键吸收的能量为391 kJ,断裂 1 mol N≡N 键吸收的能量是 945 kJ。
(1)根据以上数据判断工业合成氨的反应  是_____(填“吸热”或“放热”)反应。
是_____(填“吸热”或“放热”)反应。
(2)在 298 K 时,取 1 mol N2 和 3 mol H2 放入一密闭容器中,加入催化剂进行反应。理论上完全反应放出或吸收的热量为Q1,则 Q1 为_____kJ。
(3)实际生产中,放出或吸收的热量为 Q2,Q1 与Q2 的大小关系为_____
A.Q1<Q2 B. Q1>Q2 C.Q1=Q2
Ⅱ.微生物燃料电池是一种利用微生物将化学能直接转化成电能的装置。已知某种甲醇微生物燃料电池中,电解质溶液呈酸性,示意图如图:
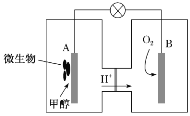
(1)该电池中外电路电子的流动方向为_____(填“从A 到B”或“从B 到A”)。
(2) B 电极附近氧气发生的电极反应为_____。
III.某可逆反应在体积为 2 L 的密闭容器中进行,0~3 分钟各物质的物质的量的变化情况如图所示(A、C 均为气体,B 为固体)
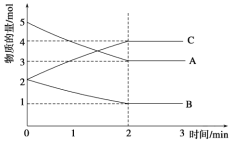
(1)该反应的化学方程式为_____。
(2)下列说法正确的是_____。
A. 2min 内 A 表示的反应速率为 0.5mol·L-1·min-1
B. 增加B 的物质的量,可使反应速率加快
C. 当容器内混合气体的密度保持不变时,该反应达到平衡状态
D. 当容器内压强保持不变时,该反应达到平衡状态
-
已知断裂 1mol 共价键所需要吸收的能量分别为H—H 键:436 kJ;I—I 键:151 kJ;H—I键:298 kJ。下列对反应H2(g)+I2(g)=2HI(g)的判断中,下列说法正确的是( )
A.该反应吸收的能量为 9 kJ
B.物质发生化学反应时都伴随着能量变化,伴随能量变化的物质变化一定是化学变化
C.需要加热的化学反应一定是吸热反应,不需要加热就能进行的反应一定是放热反应
D.反应物I2(g)与H2具有的总能量大于生成的HI 具有的总能量
-
已知一定条件下断裂或生成某些化学键的能量关系如下表:
| 断裂或生成的化学键 | 能量数据 |
| 断裂1mol H2分子中的化学键 | 吸收能量436 kJ |
| 断裂1mol I2分子中的化学键 | 吸收能量151 kJ |
| 形成1mol HI分子中的化学键 | 释放能量299 kJ |
对于反应:H2 + I2=2 HI,下列说法正确的是( )
A.该反应为放热反应
B.该反应中反应物总能量低于生成物总能量
C.HI分子中的化学键比H2分子中的化学键更牢固
D.无法判断
-
已知一定条件下断裂或生成某些化学键的能量关系如下表:
| 断裂或生成的化学键 | 能量数据 |
| 断裂1mol H2分子中的化学键 | 吸收能量436 kJ |
| 断裂1mol I2分子中的化学键 | 吸收能量151 kJ |
| 形成1mol HI分子中的化学键 | 释放能量299 kJ |
对于反应:H2 + I2=2 HI,下列说法正确的是
A.该反应为放热反应
B.该反应中反应物总能量低于生成物总能量
C.HI分子中的化学键比H2分子中的化学键更牢固
D.无法判断
-
已知一定条件下断裂或形成某些化学键的能量关系如下表:
| 断裂或形成的化学键 | 能量数据 |
| 断裂1 mol H2分子中的化学键 | 吸收能量436 kJ |
| 断裂1 mol Cl2分子中的化学键 | 吸收能量243 kJ |
| 形成1 mol HCl分子中的化学键 | 释放能量431 kJ |
对于反应:H2(g)+Cl2(g)===2HCl(g),下列说法正确的是
A. 该反应的反应热ΔH>0
B. 生成1 mol HCl时反应放热431 kJ
C. 氢气分子中的化学键比氯气分子中的化学键更牢固
D. 相同条件下,氢气分子具有的能量高于氯气分子具有的能量
-
已知:①1mol H2分子中化学键断裂时需要吸收436kJ的能量;②1mol I2蒸气中化学键断裂时需要吸收151kJ的能量;③由H原子和I原子形成1mol HI分子时释放299kJ的能量。下列判断不正确的是( )
A.I2蒸气比H2分子稳定 B.2mol HI(g)发生分解反应吸收11kJ热量
C.HI与NaOH反应属于放热反应 D.0.5mol H2(g)与0.5mol I2(g)完全反应释放出5.5kJ热量
-
已知以下信息:①1 mol N2的共价键断裂吸收946 kJ的能量;1 mol H2的共价键断裂吸收436 kJ的能量;形成1 mol NH3中的化学键释放1 173 kJ的能量。②将一定量的N2和H2投入一密闭容器中,在一定条件下进行反应,测得有关数据如下:
| N2(mol·L-1) | H2(mol·L-1) | NH3(mol·L-1) |
| 起始时 | 3 | 3 | 0 |
| 2s末 | 2.6 | 1.8 | 0.8 |
根据以上相关数据回答问题:
(1)用H2表示该反应2 s内的平均反应速率为________
(2)______(填“能”或“不能”)确认该反应2 s末已达化学平衡状态。
(3)写出该反应的化学方程式:
________________________________________________________________________。
(4)氮气和氢气生成氨气的过程______(填“释放”或“吸收”)能量。
-
已知:①1 mol H2分子中化学键断裂时需要吸收436kJ的能量
②1 mol Cl2分子中化学键断裂时需要吸收243kJ的能量
③由H原子和Cl原子形成1 mol HCl分子时释放431kJ的能量
下列叙述正确的是( )
A.氢气和氯气反应生成氯化氢气体的热化学方程式是
H2(g)+Cl2(g)=2HCl(g)
B.氢气和氯气反应生成2 mol氯化氢气体,反应的△H=183kJ/mol
C.氢气和氯气反应生成2 mol氯化氢气体,反应的△H=-183kJ/mol
D.氢气和氯气反应生成1 mol氯化氢气体,反应的△H=-183kJ/mol
-
已知:①1 mol H2 分子中化学键断裂时需要吸收 436kJ 的能量
②1 mol Cl2 分子中化学键断裂时需要吸收 243kJ 的能量
③由H原子和Cl原子形成1mol HCl分子时释放 431kJ 的能量
则下列叙述正确的是( )
A.氢气和氯气反应生成氯化氢气体的热化学方程式是 H2(g) + Cl2(g) = 2HCl(g)
B.氢气和氯气反应生成 2 mol 氯化氢气体,反应的△H = 183kJ/mol
C.氢气和氯气反应生成 2 mol 氯化氢气体,反应的△H =-183kJ/mol
D.氢气和氯气反应生成 1 mol 氯化氢气体,反应的△H =-183kJ/mol
-
已知以下信息:
①1mol N2的共价键断裂吸收946kJ的能量;1mol H2的共价键断裂吸收436kJ的能量;形成1mol NH3中的化学键释放1173kJ的能量.
②将一定量的N2和H2投入一密闭容器中,在一定条件下进行反应,测得有关数据如下:
| N2 | H2 | NH3 |
| 起始时 | 3 | 3 | |
| 2s末 | 2.6 | 1.8 | 0.8 |
根据以上相关数据回答问题:
(1)用H2表示该反应2s内的平均反应速率为________
(2)________(填“能”或“不能”)确认该反应2s末已达化学平衡状态.
(3)写出该反应的化学方程式________
(4)氮气和氢气生成氨气的过程________(填“释放”或“吸收”)能量.
是_____(填“吸热”或“放热”)反应。

