-
用0.1mol/LNaOH溶液分别滴定体积均为20.00 mL、浓度均为0.1mol/L的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH溶液体积而变化的两条滴定曲线。
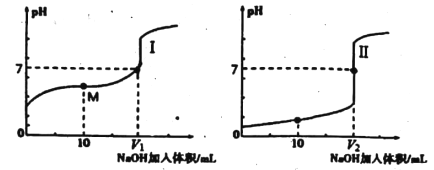
(1)用NaOH溶液滴定醋酸溶液通常所选择的指示剂为________;符合其滴定曲线的是______(填“I”或“Ⅱ”)。
(2)图中V1和V2大小的比较:V1_____V2(填“>”、“<”或“=”)。
(3)滴定前的上述三种溶液中。由水电离出的c(H+)最大的是_____溶液(填化学式)。
(4)若用0.1mol/LNaOH溶液滴定未知浓度的醋酸,滴定前仰视,滴定后平视,则所测结果____(填“偏低”,“偏高”或“不变”)。
-
Ⅰ、用0.1 mol•L-1 NaOH溶液分别滴定体积均为20.00 mL、浓度均为0.1 mol•L-1的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH溶液体积而变化的两条滴定曲线。
①滴定盐酸的曲线是______________(填“I”或“Ⅱ”);
②滴定开始前,三种溶液中由水电离出的c(H+)最大的是_____________________;
③V1和V2的关系:V1 _____ V2(填“>”、“=”或“<”)。
Ⅱ、已知25℃时,2.0×10−3 mol/L氢氟酸水溶液中,调节溶液pH(忽略体积变化),得到c(HF)、c(F−)与溶液pH的变化关系如图所示。
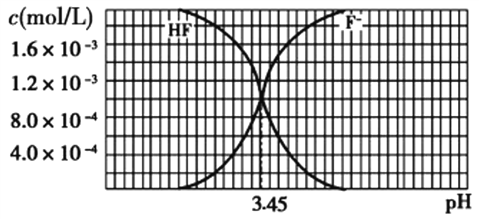
(1)25℃时,HF的电离平衡常数Ka=_____________。
(2)已知HF(aq) H+(aq)+F−(aq) ΔH=−10.4 kJ/mol,现将室温下0.1 mol/L HF溶液升温至30℃(不考虑溶质和溶剂的挥发),下列各量增大的是__________。
H+(aq)+F−(aq) ΔH=−10.4 kJ/mol,现将室温下0.1 mol/L HF溶液升温至30℃(不考虑溶质和溶剂的挥发),下列各量增大的是__________。
a.Ka b.Kw c.n(H+) d. 
(3)25℃时,在20 mL 0.1 mol/L氢氟酸中加入V mL 0.1 mol/L NaOH溶液,测得混合溶液的pH变化曲线如图所示,下列说法正确的是__________________。
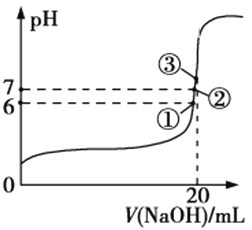
a.pH=3的HF溶液和pH=11的NaF溶液中,由水电离出的c(H+)相等
b.①点时pH=6,此时溶液中,c(F−)−c(Na+)=9.9×10−7 mol/L
c.②点时,溶液中的c(F−)=c(Na+)
d.③点时V=20 mL,此时溶液中c(F−)<c(Na+)=0.1 mol/L
-
Ⅰ、用0.1 mol•L-1 NaOH溶液分别滴定体积均为20.00 mL、浓度均为0.1 mol•L-1的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH溶液体积而变化的两条滴定曲线。
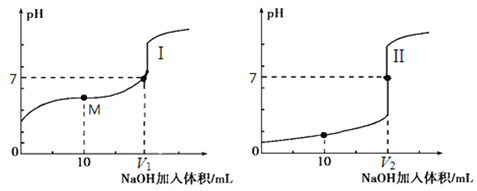
①滴定盐酸的曲线是______________(填“I”或“Ⅱ”);
②滴定开始前,三种溶液中由水电离出的c(H+)最大的是_____________________;
③V1和V2的关系:V1 _____ V2(填“>”、“=”或“<”)。
Ⅱ、已知25℃时,2.0×10−3 mol/L氢氟酸水溶液中,调节溶液pH(忽略体积变化),得到c(HF)、c(F−)与溶液pH的变化关系如图所示。
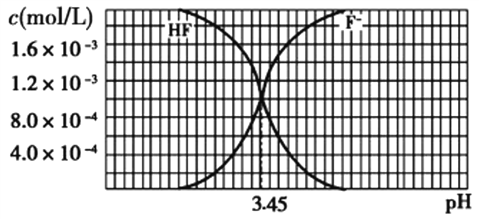
(1)25℃时,HF的电离平衡常数Ka=_____________。
(2)已知HF(aq) H+(aq)+F−(aq) ΔH=−10.4 kJ/mol,现将室温下0.1 mol/L HF溶液升温至30℃(不考虑溶质和溶剂的挥发),下列各量增大的是__________。
H+(aq)+F−(aq) ΔH=−10.4 kJ/mol,现将室温下0.1 mol/L HF溶液升温至30℃(不考虑溶质和溶剂的挥发),下列各量增大的是__________。
a.Ka b.Kw c.n(H+) d. 
(3)25℃时,在20 mL 0.1 mol/L氢氟酸中加入V mL 0.1 mol/L NaOH溶液,测得混合溶液的pH变化曲线如图所示,下列说法正确的是__________________。
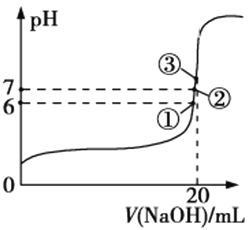
a.pH=3的HF溶液和pH=11的NaF溶液中,由水电离出的c(H+)相等
b.①点时pH=6,此时溶液中,c(F−)−c(Na+)=9.9×10−7 mol/L
c.②点时,溶液中的c(F−)=c(Na+)
d.③点时V=20 mL,此时溶液中c(F−)<c(Na+)=0.1 mol/L
-
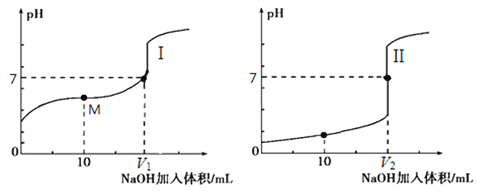
(1)用0.1mol/LNaOH溶液分别滴定体积均为20.00mL、浓度均为0.1mol/L的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH溶液体积而变化的两条滴定曲线。
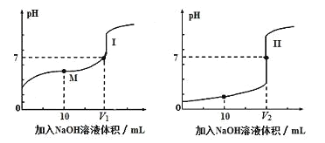
①滴定醋酸的曲线是____(填“I”或“II”)。
②V1和V2的关系:V1____V2(填“>”、“=”或“<”)。
③M点对应的溶液中,各离子的物质的量浓度由大到小的顺序是____。
(2)为了研究沉淀溶解平衡和沉淀转化,某同学查阅资料并设计如下实验。查阅资料:AgSCN是白色沉淀,相同温度下,溶解度:AgSCN>AgI。
| 操作步骤 | 现象 |
| 步骤1:向2mL0.005mol/LAgNO3溶液中加入2mL0.005mol/LKSCN溶液,静置。 | 出现白色沉淀 |
| 步骤2:取1mL上层清液于试管中,滴加1滴mol/LFe(NO3)3溶液。 | 溶液变红色 |
| 步骤3:向步骤2的溶液中,继续加入5滴3mol/LAgNO3溶液。 | 现象a,溶液红色变浅 |
| 步骤4:向步骤1中余下的浊液中加入5滴3mol/LKI溶液。 | 出现黄色沉淀 |
①写出步骤2中溶液变红色的离子方程式____。
②步骤3中现象a是____。
③用化学平衡原理解释步骤4的实验现象____。
-
(1)用0.lmol·L-1NaOH溶液分别滴定体积均为20.00mL、浓度均为0.1mol·L-1的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH溶液体积而变化的两条滴定曲线。
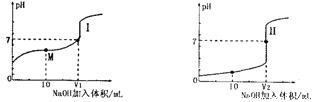
①滴定醋酸的曲线是__________(填“I”或“Ⅱ”)。
②V1和V2的关系:V1______V2(填“>”、“=”或“<”)
③M点对应的溶液中,各离子的物质的量浓度由大到小的顺序是_______________。
(2)为了研究沉淀溶解平衡和沉淀转化,某同学查阅资料并设计如下实验。资料:AgSCN 是白色沉淀
| 操作步骤 | 现象 |
| 步骤1:向2mL0.005mol·L-1AgNO3溶液中 加入2mL0 .005mol·L-1KSCN 溶液,静置 | 出现白色沉淀 |
| 步骤2:取lmL 上层清液于试管中,滴加1 滴2 mol·L-1Fe(NO3)3溶液 | 溶液变红色 |
| 步骤3:向步骤2的溶液中,继续加入5滴3mol·L-1 AgNO3溶液 | 出现白色沉淀,溶液红色变浅 |
| 步骤4:向步骤1余下的浊液中加入5滴3 mol·L-1 KI 溶液 | 出现黄色沉淀 |
①写出步骤2中溶液变红色的离子方程式______________________。
②用化学平衡原理解释步骤3的实验现象______________________。
-
室温下,用0.100mol•L﹣1的NaOH溶液分别滴定体积和浓度均为20.00mL 0.100mol•L﹣1的盐酸和醋酸滴定曲线如图所示。下列说法错误的是( )
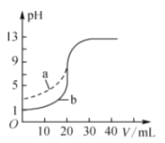
A.a表示的是醋酸的滴定曲线
B.滴定b过程中,指示剂可以是酚酞
C.pH=7时,滴定盐酸消耗的V(NaOH)=20.00mL
D.V(NaOH)=10.00mL时,醋酸中c(Na+)>c(CH3COO﹣)>c(H+)>c(OH﹣)
-
室温下,用0.100mol•L﹣1的NaOH溶液分别滴定体积和浓度均为20.00mL 0.100mol•L﹣1的盐酸和醋酸滴定曲线如图所示。下列说法错误的是( )
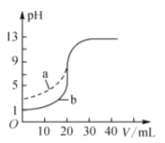
A. a表示的是醋酸的滴定曲线
B. 滴定b过程中,指示剂可以是酚酞
C. pH=7时,滴定盐酸消耗的V(NaOH)=20.00mL
D. V(NaOH)=10.00mL时,醋酸中c(Na+)>c(CH3COO﹣)>c(H+)>c(OH﹣)
-
25℃时,用0.1 mol·L-1NaOH溶液分别滴定20.00mL 0.1 mol·L-1的盐酸和醋酸,滴定曲线如图所示,下列说法正确的是
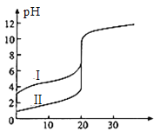
A.Ⅰ、Ⅱ分别表示盐酸和醋酸的滴定曲线
B.pH=7时,滴定盐酸和醋酸消耗NaOH溶液的体积相等
C.V(NaOH)=10.00mL时,醋酸溶液中c(CH3COO-)> c(Na+)> c(H+)> c(OH-)
D.V(NaOH)=20.00mL时,两溶液中c(CH3COO-)> c(Cl-)
-
现有HA、HB 和H2C三种酸。室温下用0.1mol·L- 1NaOH溶液分别滴定20.00 mL浓度均为0.1mol·L-1的HA、HB两种酸的溶液,滴定过程中溶液的pH随滴入的NaOH 溶液体积的变化如图所示。
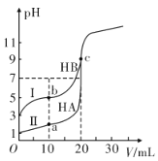
(1)原HA中水电离出的c(H+)=________mol·L-1
(2)与曲线I 上的c点对应的溶液中各离子浓度由大到小的顺序为________;b点对应的溶液中c(HB)____c(B-)(填“>”“<”或“=”)。
(3)已知常温下向0.1mol·L-1的NaHC 溶液中滴入几滴石蕊试液后溶液变成红色。
①若测得此溶液的pH=1,则NaHC的电离方程式为_______________。
②若在此溶液中能检测到H2C 分子,则此溶液中c(C2-)________c(H2C)(填“>”“<”或“=”)。
③若H2C的一级电离为H2C=H++HC-,常温下0.1mol·L-1H2C溶液中的c(H+)=0.11mol·L-1,则0.1mol·L-1NaHC溶液中的c(H+)________0.01mol·L-1(填“>”“<”或“=”)。
-
现有HA、HB 和H2C三种酸。室温下用0.1mol·L- 1NaOH溶液分别滴定20.00 mL浓度均为0.1mol·L-1的HA、HB两种酸的溶液,滴定过程中溶液的pH随滴入的NaOH 溶液体积的变化如图所示。
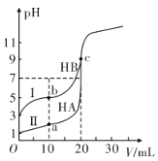
(1)原HA中水电离出的c(H+)=________mol·L-1
(2)与曲线I 上的c点对应的溶液中各离子浓度由大到小的顺序为________;b点对应的溶液中c(HB)____c(B-)(填“>”“<”或“=”)。
(3)已知常温下向0.1mol·L-1的NaHC 溶液中滴入几滴石蕊试液后溶液变成红色。
①若测得此溶液的pH=1,则NaHC的电离方程式为_______________。
②若在此溶液中能检测到H2C 分子,则此溶液中c(C2-)________c(H2C)(填“>”“<”或“=”)。
③若H2C的一级电离为H2C=H++HC-,常温下0.1mol·L-1H2C溶液中的c(H+)=0.11mol·L-1,则0.1mol·L-1NaHC溶液中的c(H+)________0.01mol·L-1(填“>”“<”或“=”)。


H+(aq)+F−(aq) ΔH=−10.4 kJ/mol,现将室温下0.1 mol/L HF溶液升温至30℃(不考虑溶质和溶剂的挥发),下列各量增大的是__________。











