-
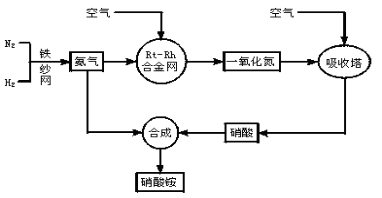
制取硝酸铵的流程图如下:
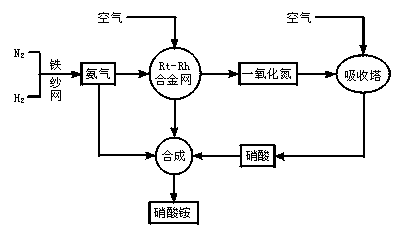
请回答下列问题:
(1)合成氨的原料通常各来自何处?
(2)已知N2(g)+3H2(g) 2NH3(g),Q>0。请解释:
2NH3(g),Q>0。请解释:
①什么是可逆反应?
②为有效提高氨的产率,实际生产中宜采取哪些措施?
(3)写出氨催化氧化的化学方程式。铂—铑合金网有何作用?为什么铂铑合金网未预热也会发热?
(4)举出硝酸铵的两种主要用途。解释为什么该用途对现代社会非常重要?
(5)在一定温度和压强的密闭容器中,将平均式量为8.5的H2和N2混合,当该反应达到平衡时,测出平衡混合气的平均式量为10,此时N2的转化率为______________,平衡混合气体中NH3的体积分数为____________________________________。
(6)请你为硝酸厂的选址提出合理化建议。
-
工业合成氨与制备硝酸一般可连续生产,流程如下:

请回答下列问题:
(1)某科研小组研究:在其他条件不变的情况下,改变起始物氢气的物质的量,对反应N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1的影响。实验结果如图所示:(图中T表示温度,n表示物质的量)
2NH3(g) ΔH=-92.4 kJ·mol-1的影响。实验结果如图所示:(图中T表示温度,n表示物质的量)
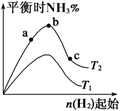
①图像中T2和T1的关系是:T2________T1(填“>”、“<”、“=”或“无法确定”)。
②比较在a、b、c三点所处的平衡状态中,N2的转化率最高的是________(填字母)。
③要使反应后氨的百分含量最大,则在起始体系中原料投料比n(H2)/n(N2)________3(填 “>”、“<”、“=”或“无法确定”)。若容器容积恒为1 L,起始状态n(H2)=3 mol,反应达到平衡时H2的转化率为60%,则此条件下(T2),反应的平衡常数K=________。(结果保留小数点后两位)
(2)已知:N2(g)+O2(g) 2NO(g) ΔH=+180.5 kJ·mol-1
2NO(g) ΔH=+180.5 kJ·mol-1
2H2(g)+O2(g) 2H2O(g) ΔH=-483.6 kJ·mol-1
2H2O(g) ΔH=-483.6 kJ·mol-1
今有17 g氨气,假设其经催化氧化完全反应,生成一氧化氮气体和水蒸气,则该过程中所放出的热量为________kJ。
(3)在装置②中,NH3和O2从145℃就开始下列反应,在不同温度和催化剂条件下生成不同产物(如下图所示):
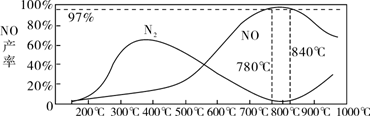
温度较低时生成________为主,温度高于900℃时,NO产率下降的可能原因是________。
-
合成氨的流程示意图如下:
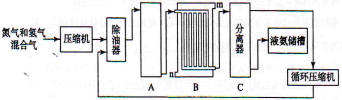
回答下列问题:
(1)工业合成氨的原料是氮气和氢气。氮气是从空气中分离出来的,通常使用的两种分离方法是 , ;氢气的来源是水和碳氢化合物,写出分别采用煤和天然气为原料制取氢气的化学反应方程式 , ;
(2)设备A中含有电加热器,触媒和热交换器,设备A的名称是 ,其中发生的化学反应方程式为 ;
(3)设备B的名称是 ,其中m和n是两个通水口,入水口是 (填“m”或“n”)。不宜从相反方向通水的原因是 ;
(4)设备C的作用是 ;
(5)在原料气制备过程中混有的CO对催化剂有毒害作用,欲除去原料气中的CO,可通过以下反应来实现:
CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)
已知1000K时该反应的平衡常数K=0.627,若要使CO的转化率超过90%,则起始物中的c(H2O):c(CO)不低于 。
-
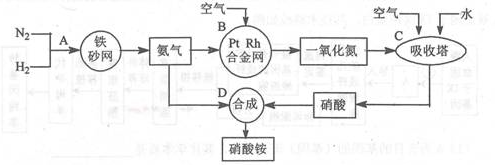
工业生产硝酸铵的流程图如下:请回答下列问题:
(1)写出硝酸铵在工农业生产中的重要作用_______________(任写一条)。
(2)已知N2(g)+3H2(g) 2NH3(g),ΔH=-92.4 kJ·mol-1。
2NH3(g),ΔH=-92.4 kJ·mol-1。
在一定温度压强和铁催化条件下向一密闭容器中充入1molN2和3molH2,充分反应后,放出的热量___________(填“<” “>” “=”)92.4kJ,理由是 。
(3)写出氨催化氧化的化学方程式:__________________________。
-
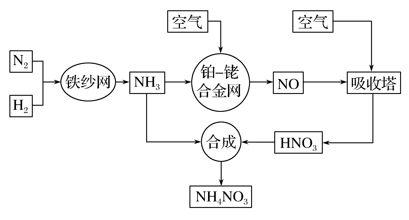
工业上制取硝酸铵的流程图如下,请回答下列问题:
(1)合成氨的工业设备名称是 ,设备中设置热交换器的目的的是________;此生产过程中,N2与H2合成NH3所用的催化剂是____ ;生产中原料气必须进行脱硫,目的是____ 。
(2)吸收塔中反应为 ,从生产流程看,吸收塔中需要补充空气,其原因是 。
(3)生产硝酸的过程中常会发生一些氮的氧化物,可用如下三种方法处理:
方法一:碱吸收法:
NO+NO2+2NaOH=2NaNO2+H2O,2NO2+Na2CO3=NaNO2+NaNO3+CO2
方法二:氨还原法:
8NH3+6NO2=7N2+12H2O(该反应放热,NO也有类似的反应)
方法三:甲烷吸收法:
CH4(g)+2NO2(g)=CO2(g)+N2(g)+2H2O(g) △H=+867kJ·mol-1(NO也有类似的反应)
上述三种方法中方法一最大的缺点是____;方法三和方法二相比,优点是________,缺点是_____________。
(4)某化肥厂用NH3制备NH4NO3。已知:由NH3制NO的产率是94%,NO制HNO3的产率是89%,则制HNO3所用的NH3的质量占总耗NH3质量(不考虑其他损耗)的 %(保留三位有效数值)。
-
[化学——选修化学与技术](15分)
工业上合成氨是在一定条件下进行如下反应:N2(g)+3H2(g) 2NH3(g),其
2NH3(g),其
部分工业流程如下:
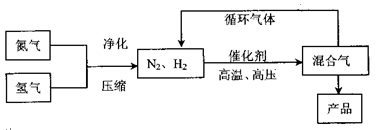
回答下列问题:
(1)已知:N2(g)+O2(g)=2NO(g) △H=180.5kJ/mol
4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H=-905kJ/mol
2H2(g)+O2(g)=2H2(g) △H=-483.6kJ/mol
则N2(g)+2H2 2NH3(g)的△H=________;
2NH3(g)的△H=________;
(2)如果工业上,在一定温度下,将1.5molN2气体和6molH2气体通入到体积为1升的密闭容器中。当反应达到平衡时,容器内气体的压强为起始时的80%,则其平衡常数为________。改变下列条件,能使平衡向正反应方向进行且平衡常数不变的是________;
①增大压强 ②增大反应物质的浓度
③使用催化剂 ④降低温度
(3)合成氨反应的平衡常数很小,所以在工业采取气体循环的流程。即反应后通过降低混合气体的温度而使氢气分离出来。这种分离物质的方法其原理类似于下列哪种方
法?________(填编号)
①过滤 ②蒸馏 ③渗析 ④萃取
理由是________;
(4)可以用氯气来检验输送氨气的管道是否漏气,如果漏气则会有白烟(成份为氯化铵)生成。该反应的化学方程式为________;
(5)假如该厂生产氨水的物质的量浓度为20mol/L,实验室若需用80mL浓度为5mol/L的氨水时,需取20mol/L的氨水________mL(用100mL的容量瓶)。假如该氨水的pH=a,加入相同体积的盐酸时,溶液呈中性,则此盐酸的pH________14-a(填“大于”“小于”或“等于”)。
-
工业生产硝酸铵的流程如下图所示:
请回答下列问题:
(1)已知:N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ· mol-1。
2NH3(g) ΔH=-92.4 kJ· mol-1。
①在500 ℃、2.02×107 Pa和铁催化条件下向一密闭容器中充入1 mol N2和3 mol H2,充分反应后,放出的热量________(填“大于”、“小于”或“等于”)92.4 kJ。
②为提高H2的转化率,实际生产中宜采取的措施有________(填字母)。
A.降低温度
B.最适合催化剂活性的适当高温
C.适当增大压强
D.减小压强
E.循环利用和不断补充氮气
F.及时移出氨
(2)该流程中铂—铑合金网上的氧化还原反应为4NH3(g)+5O2(g) 4NO(g)+6H2O(g)。
4NO(g)+6H2O(g)。
①已知铂—铑合金网未预热也会发热,则随着温度升高,该反应的化学平衡常数K________(填“增大”、“减小”或“不变”),理由是__________________________________________________________________。
②若其他条件不变,则下列图像正确的是________(填字母)。
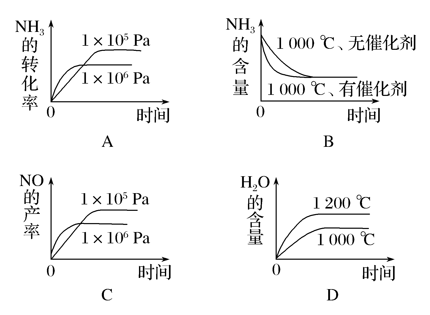
-
(14分)工业上合成氨是在一定条件下进行如下反应:N2(g) + 3H2(g) ≒ 2NH3(g),其部分工艺流程如下:

回答下列问题:
(1) 已知: N2(g) + O2(g)  2NO(g) ΔH
2NO(g) ΔH +180.5kJ/mol
+180.5kJ/mol
4NH3(g) + 5O2(g)  4NO(g) + 6H2O(g) ΔH
4NO(g) + 6H2O(g) ΔH −905kJ/mol
−905kJ/mol
2H2(g) + O2(g)  2H2O(g) ΔH
2H2O(g) ΔH −483.6kJ/mol
−483.6kJ/mol
则N2(g) + 3H2(g) ≒ 2NH3(g) ΔH  ________________。
________________。
(2) 如果工业上,在一定温度下,将1.5 mol N2气体和6 mol H2气体通入到体积为1升的密闭容器中。当反应达到平衡时,容器内气体的压强为起始时的80%,则其平衡常数为_______。改变下列条件,能使平衡向正反应方向进行且平衡常数不变的是__________。
①增大压强 ②增大反应物的浓度 ③使用催化剂 ④降低温度
(3) 合成氨反应的平衡常数很小,所以在工业上采取气体循环的流程。即反应后通过降低混合气体的温度而使氨气分离出来。这种分离物质的方法其原理类似于下列方法中的________(填编号),其理由是__________。
①过滤 ②蒸馏 ③渗析 ④萃取
(4) 可以用氯气来检验输送氨气的管道是否漏气,如果漏气则会有白烟(成分为氯化铵)生成,该反应的化学方程式为__________。
(5) 假如该厂生产氨水的物质的量浓度为20 mol/L,实验室若需用80 mL浓度为5 mol/L的氨水时,需取20 mol/L的氨水__________mL(用100 mL的容量瓶)。假如该氨水的 ,加入相同体积的盐酸时,溶液呈中性,则此盐酸的pH__________
,加入相同体积的盐酸时,溶液呈中性,则此盐酸的pH__________ (填“大于”、“小于”或“等于”)。
(填“大于”、“小于”或“等于”)。
-
工业上合成氨是在一定条件下进行如下反应:N2(g)+3H2(g)⇌2NH3(g),其部分工艺流程如下:
回答下列问题:
(1)已知:N2(g)+O2(g)=2NO(g);△H=180.5kJ/mol
4NH3(g)+5O2(g)=4NO(g)+6H2O(g);△H=-905kJ/mol
2H2(g)+O2(g)=2H2O(g);△H=-483.6kJ/mol
则N2(g)+3H2(g)⇌2NH3(g)的△H=______.
(2)如果工业上,在一定温度下,将1.5molN2 气体和6molH2 气体通入到体积为1升的密闭容器中.当反应达到平衡时,容器内气体的压强为起始时的80%,则氮气的转化率为______.该反应的平衡常数表达式为______,改变下列条件,能使平衡向正反应方向进行且平衡常数不变的是______
①增大压强 ②增大反应物的浓度 ③使用催化剂 ④降低温度
(3)可以用氯气来检验输送氨气的管道是否漏气,如果漏气则会有白烟(成份为氯化铵)生成.该反应的化学方程式为:______.
(4)假如该厂生产的氨水的pH=a,加入相同体积的盐酸时,溶液呈中性,则此盐酸的pH______14-a(填“大于”“小于”或“等于”)
-
氨是合成硝酸、铵盐和氮肥的基本原料,在科学技术和生产中有重要的应用。请回答下列问题:
(1)以N2和H2为原料,合成氨气的反应为N2(g)+3H2(g)  2NH3(g) ΔH<0,下列措施可以提高ʋ(正)的是_____________ (填序号)。
2NH3(g) ΔH<0,下列措施可以提高ʋ(正)的是_____________ (填序号)。
a.选择适当的催化剂 b.增大压强
c.及时分离生成的NH3 d.降低温度
(2)在恒温条件下,将N2与H2按一定比例混合的气体充人一个体积可变的恒压密闭容器中,p = 5MPa,原气体体积为2L。5分钟后反应达到平衡时,n(N2)=1.0mol,n(H2)=3.0mol,n(NH3)=1.0mol,则反应速率v (N2)=_______mol/min (用单位时间物质的量变量表示化学反应速率),平衡常数Kp =________。(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
(3)在容积恒定的密闭容器中进行反应2NO(g)+O2(g)  2NO2(g) ΔH>0,该反应的反应速率(v)随时间(t)变化的关系如图所示。若t2、t4时刻只改变一个条件,下列说法正确的是_____ (填序号)。
2NO2(g) ΔH>0,该反应的反应速率(v)随时间(t)变化的关系如图所示。若t2、t4时刻只改变一个条件,下列说法正确的是_____ (填序号)。
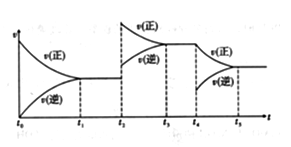
a.在t1~t2时,可依据容器内气体的压强保持不变判断反应已达到平衡状态
b.在t2时,采取的措施一定是升高温度
c.在t3~t4时,可依据容器内气体的密度保持不变判断反应已达到平衡状态
d.在t0~t5时,容器内NO2的体积分数在t3时的值最大
(4)氨和联氨(N2H4)是氨的两种常见化合物,最常见的制备联氨的方法是以丙酮为催化剂,用次氯酸钠与氨气反应,该反应中还原剂与氧化剂的物质的量之比为2 :1,写出该反应的化学方程式:_________。标况下,每消耗1.12L氨气,转移_________mol电子。
(5)已知:N2(g)+O2(g)═2NO(g) ΔH=+180.5Kj/mol; N2(g)+3H2(g)  2NH3(g)
2NH3(g)
ΔH=-92.4kJ/mol; 2H2(g) +O2 (g) ═2H2O(g) ΔH=-483.6kJ/mol。
若有34g氨气经催化氧化完全生成一氧化氮气体和水蒸气所放出的热量为_________。

2NH3(g),Q>0。请解释:










