-
研究氮的循环和转化对生产、生活有重要的价值。
I.(1)写出实验室制备氨气的化学方程式________ 。
II.氨是重要的化工原料。某工厂用氨制硝酸和铵盐的流程如下图所示。
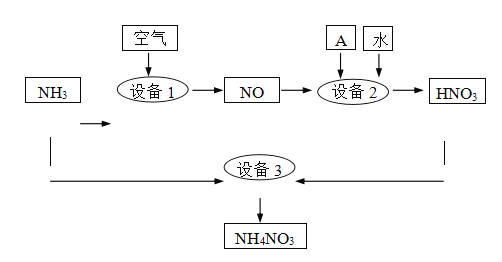
(2)设备1、3中发生反应的化学方程式分别是______、 ________ 。设备2中通入的物质A是________。
III.氨氮废水的去除是当前科学研究的热点问题。氨氮废水中的氮元素多以NH4+和NH3•H2O的形式存在。某工厂处理氨氮废水的流程如下:
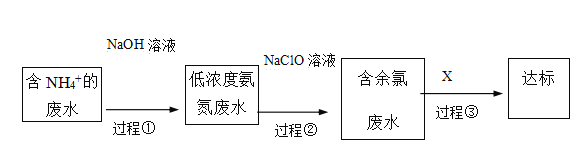
(3)过程①的目的是将NH4+转化为NH3,并通过鼓入大量空气将氨气吹出,写出NH4+转化为NH3的离子方程式________ 。
(4)过程②加入NaClO溶液可将氨氮转化为无毒物质,反应后含氮元素、氯元素的物质化学式分别为___、_______。
(5)含余氯废水的主要成分是NaClO以及HClO,X可选用以下哪种溶液以达到去除余氯的目的(填序号)_________。
a.KOH b.Na2SO3 c.KMnO4 D.NaCl
写出其中一个反应的离子方程式__________ 。
-
研究氮的循环和转化对生产、生活有重要的价值。
I.(1)写出实验室制备氨气的化学方程式________ 。
II.氨是重要的化工原料。某工厂用氨制硝酸和铵盐的流程如下图所示。
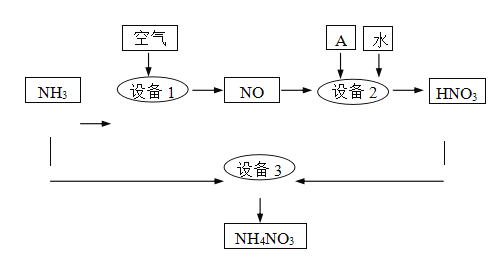
(2)设备1、3中发生反应的化学方程式分别是______、 ________ 。设备2中通入的物质A是________。
III.氨氮废水的去除是当前科学研究的热点问题。氨氮废水中的氮元素多以NH4+和NH3•H2O的形式存在。某工厂处理氨氮废水的流程如下:
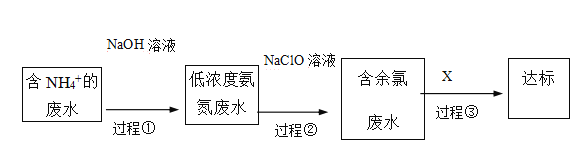
(3)过程①的目的是将NH4+转化为NH3,并通过鼓入大量空气将氨气吹出,写出NH4+转化为NH3的离子方程式________ 。
(4)过程②加入NaClO溶液可将氨氮转化为无毒物质,反应后含氮元素、氯元素的物质化学式分别为___、_______。
(5)含余氯废水的主要成分是NaClO以及HClO,X可选用以下哪种溶液以达到去除余氯的目的(填序号)_________。
a.KOH b.Na2SO3 c.KMnO4 D.NaCl
写出其中一个反应的离子方程式__________ 。
-
研究氮的循环和转化对生产、生活有重要的价值。
I.(1)写出实验室制备氨气的化学方程式________ 。
II.氨是重要的化工原料。某工厂用氨制硝酸和铵盐的流程如下图所示。
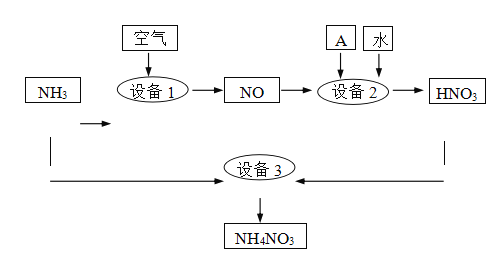
(2)设备1、3中发生反应的化学方程式分别是______、 ________ 。设备2中通入的物质A是________。
III.氨氮废水的去除是当前科学研究的热点问题。氨氮废水中的氮元素多以NH4+和NH3•H2O的形式存在。某工厂处理氨氮废水的流程如下:
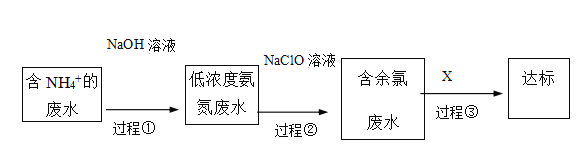
(3)过程①的目的是将NH4+转化为NH3,并通过鼓入大量空气将氨气吹出,写出NH4+转化为NH3的离子方程式________ 。
(4)过程②加入NaClO溶液可将氨氮转化为无毒物质,反应后含氮元素、氯元素的物质化学式分别为___、_______。
(5)含余氯废水的主要成分是NaClO以及HClO,X可选用以下哪种溶液以达到去除余氯的目的(填序号)_________。
a.KOH b.Na2SO3 c.KMnO4 D.NaCl
写出其中一个反应的离子方程式__________ 。
-
研究氮的循环和转化对生产、生活有重要价值。
I.氮是重要的化工原料。某工厂用氨制硝酸和铵盐的流程如图所示:
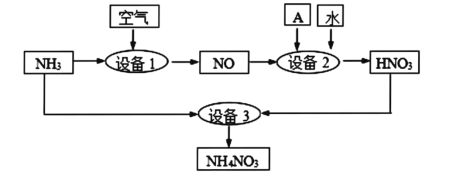
设备1、3中发生反应的化学方程式分别是_________________、_________________;设备2中通入的物质A是__________。
II.氨氮废水的处理是当前科学研究的热点问题之一。氨氮废水中氮元素多以NH4+和NH3·H2O的形式存在。某工厂处理氨氮废水的流程如下:
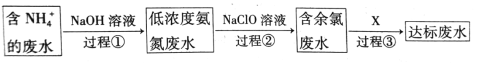
(1)过程①的目的是将NH4+转化成NH3,并通过鼓入大量热空气将氨气吹出,写出NH4+转化成NH3的离子方程式:______________________________
(2)过程②中加入NaClO溶液可将氨氮化合物转化为无毒物质,反应后含氮元素、氯元素的物质的化学式分别为__________、__________。
(3)图中含余氯废水中含有NaClO,则X可选用__________(填序号)的溶液达到去除余氯的目的。
a.KOH b.Na2SO3 c.KMnO4 d.NaCl
写出该反应的离子方程式:___________________________。
-
氨在人类的生产和生活中有着广泛的应用。利用下图装置某化学兴趣小组在实验室制备氨气并进行氨的催化氧化实验。
I制备并收集干燥的氨气
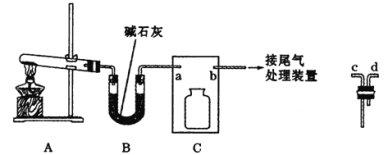
(1)A中反应的化学方程式为________。
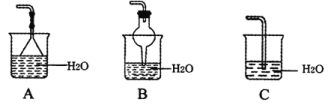
(2)B装置的作用为_____,C装置用于收集氨气,则装置中导管的连接顺序为a→__→__→b。
(3)氨气的尾气处理装置不能选用___(填写代号)。
II氨的催化氧化实验
将铂丝烧至红热,放入盛有氨气和空气的锥形瓶中,请回答:
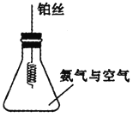
(4)氨的催化氧化反应的化学方程式为_______。
(5)锥形瓶内铂丝始终保持红热状态,说明该反应是___反应(填“吸热”或“放热”)。
(6)锥形瓶内的实验现象为_____。
-
化学来源于生活又服务于生活,化工生产是指对原料进行化学加工,最终获得有价值的产品的生产过程。某研究小组利用含硫酸亚铁和硫酸铜的工业废料制备铁红(氧化铁)和硫酸铵晶体。流程如下:
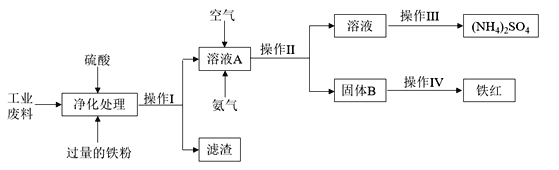
请回答下列问题:
(1)操作I的名称________________,滤渣的成分为__________________。
(2)简述下列实验操作:
①检验溶液A中金属阳离子的方法为____________________________________________________;
②检验固体B是否洗涤干净的方法是____________________________________________________。
(3)请写出溶液A中反应的离子方程式_______________________________________________________
(4) 测定废料中硫酸铜的质量分数:称取a g废料样品,将操作I得到的滤渣用足量的稀硫酸溶解、过滤、洗涤、干燥,称得固体的质量为b g,则废料中硫酸铜的质量分数为_______________(写出表达式。)
(5) 某同学提出另一种制备铁红的方法:往工业废水中加入足量的硫酸和双氧水,通过下列操作也可以得到铁红,请配平下列离子方程式_____ Fe2++ _____ H2O2 + _____ H+= _____ Fe3+ + ____ H2O
-
氨气是一种重要化合物,在工农业生产、生活中有着重要应用。
(1) 实验室制备NH3,下列方法中可以选用的是_______________。
A.固态氯化铵与熟石灰混合加热 B.固态氯化铵加热分解
C.碱石灰中滴加浓氨水 D.氯化铵溶液与氢氧化钠溶液共热
(2) “氨的催化氧化”是工业生产硝酸的重要步骤。某化学课外活动小组设计了如下装置模拟该实验过程,并用水吸收所得气体制取硝酸(固定装置略去):
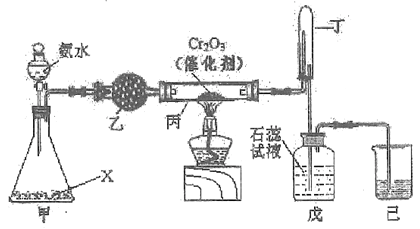
①盛装氨水仪器的名称是________。甲装置不需要加热即能同时产生氨气和氧气,则锥形瓶内固体X的化学式为____________。
②乙装置中药品的名称是_________。写出受热时丙装置发生反应的化学方程式________。
③当戊中观察到______现象,则说明戊中制得硝酸。某同学按上图组装仪器并检验气密性后进行实验,并没有观察到此现象,请分析实验失败的可能原因________,如何改进装置_________。
(3) 若将氨气和氯气在集气瓶中混合,会出现浓厚的白烟并在容器内壁凝结,另一生成物是空气的主要成分之一,请写出该反应的化学方程式_____________。
-
铁的化合物在生产、生活中有广泛的用途,试回答下列问题:
(1)制造电路板的工艺中,FeCl3溶液可以蚀刻铜箔,请写出该反应的离子方程式: 。
(2)纳米级Fe3O4是磁流体中的重要粒子,其实验室制备原理可简单表示如下:
①将化合物NH3通入等物质的量的FeSO4、Fe2(SO4)3的混合溶液中生成两种碱,写出该反应的总离子方程式 。
②上述反应生成的两种碱继续作用,得到Fe3O4,该反应的化学方程式为 。
(3)向FeCl2和FeCl3混合溶液中加入适量KOH,高速搅拌下加入油脂,过滤后干燥得到一类特殊的磁流体材料,其化学式通式为KxFeO2(其组成可理解为aK2O·bFeO·cFe2O3)。请回答下列问题:若x平均值为1.3,则磁流体中Fe2+和Fe3+的质量之比为 。
-
氨气是一种重要化合物,在工农业生产、生活中有重要作用。利用下图探究氨气的性质。
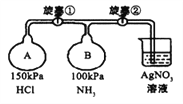
(1)收集气体,按下图玻璃装置进行实验。先打开旋塞①,B瓶中产生白色的烟,原因是______(用化学方程式表示);稳定后,关闭旋塞①,再打开旋塞②,B瓶中的现象是________。
(2)若将氯气和氨气在集气瓶中混合,会出现浓厚的白烟并在容器内壁凝结,另一生成物是空气的主要成分之一,请写出反应的化学方程式:________,该反应生成的还原产物的化学键类型是________。
(3)“氨的催化氧化”是工业生产硝酸的重要步骤。某化学课外活动小组设计了如下装置模拟该实验过程,并用水吸收制取硝酸(固定装置略去):
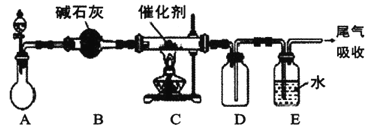
①A装置的分液漏斗中盛放浓氨水,则烧瓶中盛放的药品应该是_______。
②C装置中发生反应的化学方程式为________。
③反应后,装置E中除存在较多的H+外,还可能存在的一种离子是______,试设计实验证明这种离子的存在________。
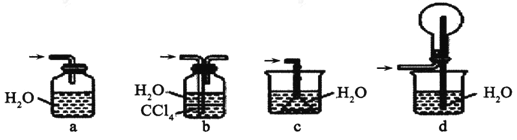
④下列哪些装置可以同时起到装置D和E的作用_______ (填代号)。
-
氨气和氨水在工农业生产中均有重要应用。
(1)工业合成氨反应的化学方程式是_________。
(2)实验室常加热熟石灰[主要成分是Ca(OH)2]和氯化铵混合固体制取氨气,写出反应的化学方程式___________。
(3)如图所示,向表面皿中的NaOH固体滴几滴浓氨水,迅速盖上盖,观察现象。
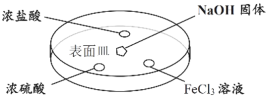
①___________液滴上方会出现白烟(填序号)
A.浓盐酸 B.浓硫酸 C.FeCl3溶液
②一段时间后浓硫酸的液滴中有白色固体,生成该白色固体的化学方程式是_______。
③FeCl3液滴中出现的现象是___________,发生反应的离子方程式是_________。
(4)利用氨水可以将大气污染物SO2吸收并生产氮肥,原理如图所示:
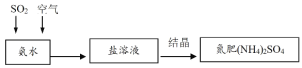
分析上述生产原理,在下列表格中填写该生产过程中利用的SO2的化学性质并进行理论论证
| SO2的化学性质 | 理论论证 |
| ______ | ______ |
| ______ | ______ |

















