-
实验室以工业钴渣为原料制取CoSO4溶液和ZnSO4·7H2O晶体,其实验流程如下:
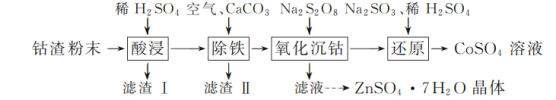
已知:①“酸浸”所得溶液中主要含CoSO4、ZnSO4,另含少量FeSO4、NiSO4。②金属活动性:Ni介于Fe、Cu之间。③下表是相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度1 mol·L-1计算,pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2-):
| 金属离子 | 开始沉淀的pH | 完全沉淀的pH |
| Co2+ | 7.6 | 9.4 |
| Zn2+ | 5.9 | 8.9 |
(1)“酸浸”时所加稀硫酸不宜过量太多的原因是________。
(2)“除铁”时,向溶液中持续鼓入空气的作用是________。
(3)流程中需将滤渣Ⅰ、滤渣Ⅱ的洗涤液与“除铁”后所得滤液合并,目的是________。
(4)写出“还原”过程中Na2SO3、稀H2SO4与Co(OH)3反应的离子方程式:________。
(5)实验所得CoSO4溶液可用于制备CoCO3,制备时CoSO4饱和溶液与Na2CO3饱和溶液的混合方式为________。
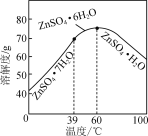
(6)请结合如图硫酸锌晶体的溶解度曲线,设计从“氧化沉钴”后的滤液(含ZnSO4、Na2SO4、NiSO4等)中获取ZnSO4·7H2O的实验方案:取适量滤液,____________________________,过滤,用少量冰水洗涤,低温干燥得ZnSO4·7H2O晶体。(实验中须使用的试剂有:Zn粉、1.0 mol·L-1 NaOH、1.0 mol·L-1 H2SO4)
-
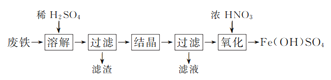
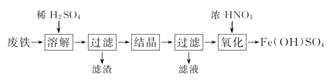
实验室以工业废铁为原料制取绿矾(FeSO4·7H2O),并用绿矾为原料制备Fe(OH)SO4溶液和NH4Fe(SO4)2·12H2O晶体,其实验流程如下:
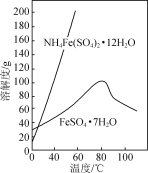
已知:FeSO4·7H2O和NH4Fe(SO4)2·12H2O随温度变化的溶解度曲线如下图。
(1)废铁溶解前需要用热的饱和Na2CO3溶液浸泡,目的是________。
(2)溶解时控制溶液温度为70~80 ℃,目的是__________________,溶解时铁需过量的原因是________________。
(3)氧化时将绿矾分批次加入到浓硝酸中,搅拌,反应1 h,有红棕色气体生成,同时得到Fe(OH)SO4,发生的化学方程式为________________。氧化结束后不能采用加热煮沸的方法除去溶液中剩余的硝酸,理由是________________(任写一条)。
(4)设计以绿矾和硫酸铵为原料,制取纯净NH4Fe(SO4)2·12H2O的实验方案:________________(已知pH=1时出现Fe(OH)3沉淀。实验中可以选用的试剂:1.0 mol·L-1稀硫酸、2.0 mol·L-1稀盐酸、5%H2O2溶液)。
-
实验室以工业废铁为原料制取绿矾(FeSO4·7H2O),并用绿矾为原料制备Fe(OH)SO4溶液和NH4Fe(SO4)2·12H2O晶体,其实验流程如下:
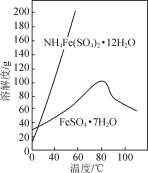
已知:FeSO4·7H2O和NH4Fe(SO4)2·12H2O随温度变化的溶解度曲线如下图。
(1)废铁溶解前需要用热的饱和Na2CO3溶液浸泡,目的是________。
(2)溶解时控制溶液温度为70~80 ℃,目的是__________________,溶解时铁需过量的原因是________________。
(3)氧化时将绿矾分批次加入到浓硝酸中,搅拌,反应1 h,有红棕色气体生成,同时得到Fe(OH)SO4,发生的化学方程式为________________。氧化结束后不能采用加热煮沸的方法除去溶液中剩余的硝酸,理由是________________(任写一条)。
(4)设计以绿矾和硫酸铵为原料,制取纯净NH4Fe(SO4)2·12H2O的实验方案:________________(已知pH=1时出现Fe(OH)3沉淀。实验中可以选用的试剂:1.0 mol·L-1稀硫酸、2.0 mol·L-1稀盐酸、5%H2O2溶液)。
-
硫酸锌是制备荧光粉的原料之一。工业上由锌白矿(主要成分是ZnO,还含有Fe2O3、CuO、SiO2等杂质)制备ZnSO4•7H2O的流程如下。
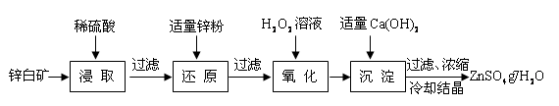
已知:常温下,溶液中的Fe3+、Zn2+、Fe2+以氢氧化物形式完全沉淀的pH分别为:3.7,6.5,9.7。
(1)浸取过程中提高浸出效率可采用的措施有 (任答一条),ZnO和硫酸反应的化学方程式为 。
(2)加入适量锌粉的作用为:①使溶液中的Fe3+转化为Fe2+;② 。
(3)氧化过程中H2O2发生反应的离子方程式为 。
(4)加入适量Ca(OH)2调节溶液pH,促进Fe3+水解,Fe3+水解反应的平衡常数表达式K= ,Ca(OH)2不能过量的原因是 。
-
硫酸锌是制备荧光粉的原料之一。工业上由锌白矿(主要成分是ZnO,还含有Fe2O3、CuO、SiO2等杂质)制备ZnSO4•7H2O的流程如下。
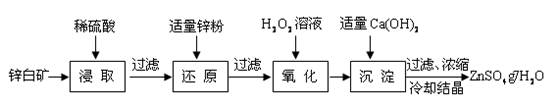
已知:常温下,溶液中的Fe3+、Zn2+、Fe2+以氢氧化物形式完全沉淀的pH分别为:3.7,6.5,9.7。
(1)浸取过程中提高浸出效率可采用的措施有 (任答一条),
ZnO和硫酸反应的化学方程式为 。
(2)加入适量锌粉的作用为:①使溶液中的Fe3+转化为Fe2+;② 。
(3)氧化过程中H2O2发生反应的离子方程式为 。
(4)加入适量Ca(OH)2调节溶液pH,促进Fe3+水解,Fe3+水解反应的平衡常数表达式
K= ,Ca(OH)2不能过量的原因是 。
-
硫酸锌是制备荧光粉的原料之一。某实验室用炼锌厂的烟道灰(主要成分为:炭粉、ZnO、PbO、FeO、SiO2)制备皓矾(ZnSO4· 7H2O)的流程如下:
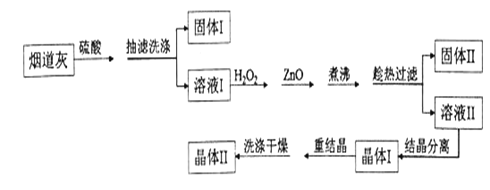
已知:ZnSO4易溶于水,难溶于乙醇。请回答下列问題:
(1)下列操作或描述正确的是 _________
A.“抽滤洗涤”时,将洗液与溶液I合并,有利于提高皓矾的产率
B.溶液I中含量较高的溶质有ZnSO4、PbSO4、FeSO4、H2SO4
C.重结晶时,需加少量稀盐酸抑制Zn2+水解
D. “洗涤干燥”时,可用95%的酒精作为洗涤剂
(2)如图安装抽滤装置,经过一系列操作完成抽滤。请选择合适的编号,按正确的搡作顺序补充完整:
在布氏漏斗中加入滤纸→_____ →_____→_______→________→确认抽干。__________
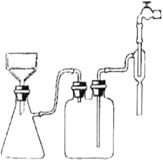
①转移固液混合物;②开大水龙头;③关闭水龙头;④微开水龙头;⑤加入少量蒸馏水润湿滤纸
(3)某同学设计了一个实验方案,证明晶体II中的杂质Fe3+含量低于晶体Ⅰ,请把该方案补充完整。_____ (填操作),分别加入2滴稀硝酸和6滴15%KSCN,________(填现象),证明晶体II中的杂质含量低于晶体I
(4)某同学称取28.700g研细的皓矾晶体(0.100mol), 置于坩埚中充分加热、冷却、称量,发现晶体失重13.100g。该同学分析认为,在加热失水过程中还发生副反应,该副反应可能的化学方程式为_____________
(5)将烟道灰在氧气中髙温灼烧后,再按上述流程操作,皓矾产率有明显提高,其原因是________
-
硫酸锌是制备荧光粉的原料之一。某实验室用炼锌厂的烟道灰(主要成分为:炭粉、ZnO、PbO、FeO、SiO2)制备皓矾(ZnSO4· 7H2O)的流程如下:
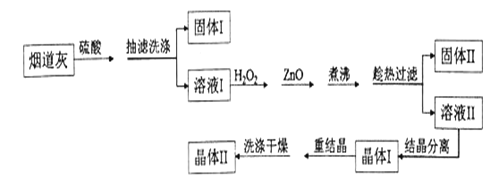
已知:ZnSO4易溶于水,难溶于乙醇。请回答下列问題:
(1)下列操作或描述正确的是 _________
A.“抽滤洗涤”时,将洗液与溶液I合并,有利于提高皓矾的产率
B.溶液I中含量较高的溶质有ZnSO4、PbSO4、FeSO4、H2SO4
C.重结晶时,需加少量稀盐酸抑制Zn2+水解
D. “洗涤干燥”时,可用95%的酒精作为洗涤剂
(2)如图安装抽滤装置,经过一系列操作完成抽滤。请选择合适的编号,按正确的搡作顺序补充完整:
在布氏漏斗中加入滤纸→_____ →_____→_______→________→确认抽干。__________
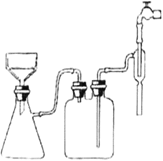
①转移固液混合物;②开大水龙头;③关闭水龙头;④微开水龙头;⑤加入少量蒸馏水润湿滤纸
(3)某同学设计了一个实验方案,证明晶体II中的杂质Fe3+含量低于晶体Ⅰ,请把该方案补充完整。_____ (填操作),分别加入2滴稀硝酸和6滴15%KSCN,________(填现象),证明晶体II中的杂质含量低于晶体I
(4)某同学称取28.700g研细的皓矾晶体(0.100mol), 置于坩埚中充分加热、冷却、称量,发现晶体失重13.100g。该同学分析认为,在加热失水过程中还发生副反应,该副反应可能的化学方程式为_____________
(5)将烟道灰在氧气中髙温灼烧后,再按上述流程操作,皓矾产率有明显提高,其原因是________
-
盐泥是氯碱工业中的废渣,主要含有镁、铁、铝、钙等的硅酸盐和碳酸盐。实验室以盐泥为原料制取MgSO4·7H2O的流程如下:

已知:(Ⅰ) Ksp[Mg(OH)2]=6.0×
(Ⅱ) Fe2+、Fe3+、Al3+开始沉淀到完全沉淀的pH范围依次为:7.1~9.6、2.0~3.7、3.1~4.7
(Ⅲ) 三种化合物的溶解度(S)随温度变化曲线如图。
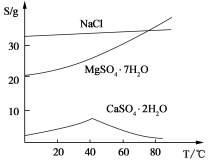
回答下列问题:
(1)在盐泥中加H2SO4溶液控制pH为1~2以及第一次煮沸的目的是: 。
(2)若溶液中Mg2+的浓度为6 mol/L,溶液pH≥ 才可能产生Mg(OH)2沉淀。
(3)第二次过滤需要趁热进行,主要原因是 。所得滤渣的主要成分是 。
(4)从滤液Ⅱ中获得MgSO4·7H2O晶体的实验操作步骤为:①向滤液Ⅱ中加入 ,②过滤,得沉淀,③ ,④蒸发浓缩,降温结晶,⑤过滤、洗涤得产品。
(5)若获得的MgSO4·7H2O质量为24.6 g,则该盐泥中含镁[以Mg(OH)2计]的百分含量约 (MgSO4·7H2O式量为246)
-
盐泥是氯碱工业中的废渣,主要含有镁、铁、铝、钙等的硅酸盐和碳酸盐。实验室以盐泥为原料制取MgSO4·7H2O的流程如下:

已知:(Ⅰ) Ksp[Mg(OH)2]=6.0×
(Ⅱ) Fe2+、Fe3+、Al3+开始沉淀到完全沉淀的pH范围依次为:7.1~9.6、2.0~3.7、3.1~4.7
(Ⅲ) 三种化合物的溶解度(S)随温度变化曲线如图。
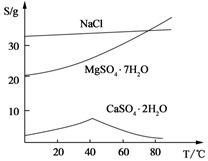
回答下列问题:
(1)在盐泥中加H2SO4溶液控制pH为1~2以及第一次煮沸的目的是: 。
(2)若溶液中Mg2+的浓度为6 mol/L,溶液pH≥ 才可能产生Mg(OH)2沉淀。
(3)第二次过滤需要趁热进行,主要原因是 。所得滤渣的主要成分是 ________。
(4)从滤液Ⅱ中获得MgSO4·7H2O晶体的实验操作步骤为:①向滤液Ⅱ中加入 ,②过滤,得沉淀,③ ,④蒸发浓缩,降温结晶,⑤过滤、洗涤得产品。
(5)若获得的MgSO4·7H2O质量为24.6 g,则该盐泥中含镁[以Mg(OH)2计]的百分含量约________(MgSO4·7H2O式量为246)
-
用Zn(主要含有Fe、Al、Pb杂质)和硫酸来制取H2,利用制氢废液制备硫酸锌晶体(ZnSO4·7H2O)、Al2O3和Fe2O3,流程如下:
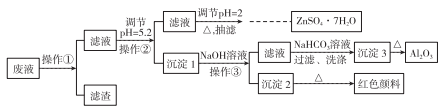
已知Al3+、Fe3+、Zn2+的氢氧化物完全沉淀的pH分别为5.2、4.1和8.5,ZnSO4·7H2O晶体易溶于水,易风化。回答下列问题:
(1)调节pH=2的目的是______________,调节pH=2,可加入_________(填化学式)。
(2)写出生成沉淀3的化学方程式:______________________。
(3)加热浓缩ZnSO4溶液出现极薄品膜时,要停止加热的主要原因是_____________。
(4)某同学用如图所示的装置抽滤。

①有关抽滤的说法正确的是__________。
A.抽滤的目的主要是得到较干燥的沉淀
B.滤纸的直径应略小于漏斗内径,又能盖住全部小孔
C.图中有一处出错
D.抽滤结束,从吸滤瓶的支管口倒出滤液
②抽滤,洗涤沉淀的具体操作是___________________________。
(5)为得到干燥的ZnSO4·7H2O产品,选择干燥方法是________。
A.加热烘干 B.用浓H2SO4干燥
C.用酒精洗干 D.在空气中白然干燥

















