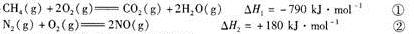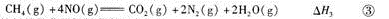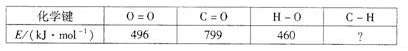-
H2S是一种大气污染物。工业尾气中含有H2S,会造成严重的环境污染;未脱除H2S的煤气,运输过程中还会腐蚀管道。
(1)干法氧化铁脱硫是目前除去煤气中H2S的常用方法,其原理如图所示。
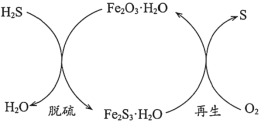
①下列说法正确的是____________(填序号)。
a.单质硫为淡黄色固体
b.脱硫反应为3H2S+Fe2O3·H2O=3H2O+Fe2S3·H2O
c.再生过程中,硫元素被还原
d.脱硫过程中,增大反应物的接触面积可提高脱硫效率
②从安全环保的角度考虑,再生过程需控制反应温度不能过高的原因是_______。
(2)电化学溶解一沉淀法是一种回收利用H2S的新方法,其工艺原理如下图所示。
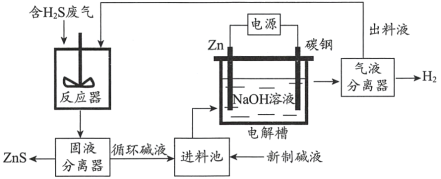
已知: Zn与强酸、强碱都能反应生成H2;Zn(II)在过量的强碱溶液中以[Zn(OH)4]2-形式存在。
①锌棒连接直流电源的____________(填“正极”或“负极”)。
②反应器中反应的离子方程式为____________。
③电解槽中,没接通电源时已经有H2产生,用化学用语解释原因:___________。
(3)常用碘量法测定煤气中H2S的含量,其实验过程如下:
i.将10L煤气通入盛有100mL锌氨络合液的洗气瓶中,将其中的H2S全部转化为ZnS沉淀,过滤;
ii.将带有沉淀的滤纸加入盛有15mL 0.1mol/L碘标准液、200mL水和10mL盐酸的碘量瓶中,盖上瓶塞,摇动碘量瓶至瓶内滤纸摇碎,置于暗处反应10 min后,用少量水冲洗瓶壁和瓶塞。(已知:ZnS+I2=ZnI2+S)
iii.用0.1mol/L Na2S2O3标准液滴定,待溶液呈淡黄色时,加入1mL淀粉指示剂,继续滴定至终点。(已知:2Na2S2O3+I2=Na2S4O6+2NaI)
①i中,将煤气中的H2S转化为ZnS的目的是____________。
②滴定终点的现象是__________________。
③若消耗Na2S2O3标准液的体积为20mL,则煤气中 的含量为_______________mg/m3。
的含量为_______________mg/m3。
-
煤气中主要的含硫杂质有H2S以及COS(有机硫),煤气燃烧后含硫杂质会转化成SO2从而引起大气污染,因此煤气中H2S的脱出程度已成为煤气洁净度的一个重要指标。请回答下列问题:
(1)脱除煤气中COS的方法有Br2的KOH溶液氧化法、H2还原法、水解法等。
①COS的分子结构与CO2相似,COS的结构式为___________。
②Br 2的KOH溶液将COS氧化为硫酸盐的离子方程式为______________。
③已知:H2、COS、H2S、CO的燃烧热依次为285kJ/mol、299kJ/mol、586kJ/mol、283kJ/mol;H2还原COS发生的反应为H2(g)+COS(g)=H2S(g)+CO(g),该反应的ΔH=_________kJ/mol。
恒温恒容条件下,密闭容器中将气体按n(H2):n(COS)=2:1混合发生下列反应,下列事实能说明反应达到平衡状态的是_______(填字母)
a.混合气体的平均相对分子质量不再改变 b. n(H2)与n(COS)的比值不变
c.CO的体积分数不变 d.形成2 mol H-S键的同时形成1 mol H-H键
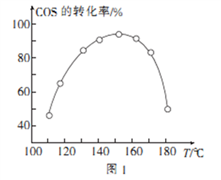
④用活性α-Al2O3催化COS水解反应为COS(g)+H2O(g) CO 2(g)+H2S(g) ΔH<0,相同流量且在催化剂表面停留相同时间时,不同温度下H2S的转化率(未达到平衡)如图所示
CO 2(g)+H2S(g) ΔH<0,相同流量且在催化剂表面停留相同时间时,不同温度下H2S的转化率(未达到平衡)如图所示
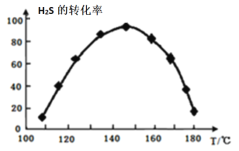
由图可知,催化剂活性最大时对应的温度约为______,H2S的转化率在后期下降的原因是_______________________________________。
(2)煤气燃烧后含硫杂质转化成的SO2,可以被氨水吸收,已知25℃时,NH3·H2O的Kb=1.8×10-5,H2SO3的Ka1=1.3×10-2, Ka2=6.2×10-8.将SO2通入氨水中,当溶液呈中性时,溶液中的c(NH4+)/c(HSO3-)=_____________________.此时溶液中各离子浓度大小关系为:_____________________
-
煤气中主要的含硫杂质有H2S以及COS(有机硫),煤气燃烧后含硫杂质会转化成SO2从而引起大气污染。煤气中H2S的脱除程度已成为其洁净度的一个重要指标。回答下列问题:
(1)将H2S通入FeCl3溶液中,该反应的还原产物为___________。
(2)脱除煤气中COS的方法有Br2的KOH溶液氧化法、H2还原法以及水解法等。
①COS的分子结构与CO2相似,COS的电子式为_____________。
②Br2的KOH溶液将COS氧化为硫酸盐和碳酸盐的离子方程式为_____________。
③已知断裂1mol化学键所需的能量如下:
| 化学键 | H—H | C═O | C═S | H—S | C≡O |
| E/kJ•mol-1 | 436 | 745 | 577 | 339 | 1072 |
H2还原COS发生的反应为H2(g)+COS(g) ═H2S(g)+CO(g),该反应的ΔH=________kJ·mol-1。
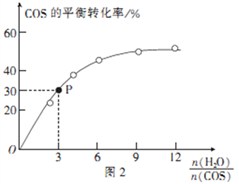
④用活性α—Al2O3催化COS水解的反应为COS(g)+ H2 O(g)  CO2(g)+ H2S (g) ΔH<0,相同投料比、相同流量且在催化剂表面停留相同时间时,不同温度下COS的转化率(未达到平衡)如图1所示;某温度下,COS的平衡转化率与
CO2(g)+ H2S (g) ΔH<0,相同投料比、相同流量且在催化剂表面停留相同时间时,不同温度下COS的转化率(未达到平衡)如图1所示;某温度下,COS的平衡转化率与 的关系如图2所示。
的关系如图2所示。
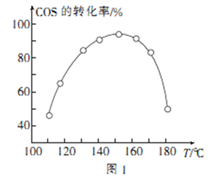
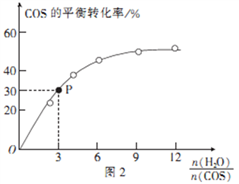
由图1可知,催化剂活性最大时对应的温度约为____________;由图2可知,P点时平衡常数K=_____
(保留2位有效数字)。
(3)常温下可发生反应:ZnS(s)+2H+(aq)  Zn2+(aq)+H2S(aq),达到平衡时,该反应的平衡常数K=_______[已知:Ksp(ZnS)=2.93×10-25;H2S电离常数;Ka1=9.5×10-8,Ka2=1.3×10-14]。
Zn2+(aq)+H2S(aq),达到平衡时,该反应的平衡常数K=_______[已知:Ksp(ZnS)=2.93×10-25;H2S电离常数;Ka1=9.5×10-8,Ka2=1.3×10-14]。
-
煤气中主要的含硫杂质有H2S以及COS(有机硫),煤气燃烧后含硫杂质会转化成SO2从而引起大气污染。煤气中H2S的脱除程度已成为其洁净度的一个重要指标。回答下列问题:
(1)将H2S通入FeCl3溶液中,该反应的还原产物为___________。
(2)脱除煤气中COS的方法有Br2的KOH溶液氧化法、H2还原法以及水解法等。
①COS的分子结构与CO2相似,COS的电子式为_____________。
②Br2的KOH溶液将COS氧化为硫酸盐和碳酸盐的离子方程式为_____________。
③已知断裂1mol化学键所需的能量如下:
| 化学键 | H—H | C═O | C═S | H—S | C≡O |
| E/kJ•mol-1 | 436 | 745 | 577 | 339 | 1072 |
H2还原COS发生的反应为H2(g)+COS(g) ═H2S(g)+CO(g),该反应的ΔH=________kJ·mol-1。
④用活性α—Al2O3催化COS水解的反应为COS(g)+ H2 O(g)  CO2(g)+ H2S (g) ΔH<0,相同投料比、相同流量且在催化剂表面停留相同时间时,不同温度下COS的转化率(未达到平衡)如图1所示;某温度下,COS的平衡转化率与
CO2(g)+ H2S (g) ΔH<0,相同投料比、相同流量且在催化剂表面停留相同时间时,不同温度下COS的转化率(未达到平衡)如图1所示;某温度下,COS的平衡转化率与 的关系如图2所示。
的关系如图2所示。
由图1可知,催化剂活性最大时对应的温度约为____________;由图2可知,P点时平衡常数K=_____
(保留2位有效数字)。
(3)常温下可发生反应:ZnS(s)+2H+(aq)  Zn2+(aq)+H2S(aq),达到平衡时,该反应的平衡常数K=_______[已知:Ksp(ZnS)=2.93×10-25;H2S电离常数;Ka1=9.5×10-8,Ka2=1.3×10-14]。
Zn2+(aq)+H2S(aq),达到平衡时,该反应的平衡常数K=_______[已知:Ksp(ZnS)=2.93×10-25;H2S电离常数;Ka1=9.5×10-8,Ka2=1.3×10-14]。
-
近年来环境问题突出,大气污染更为严重。回答下面问题
(1)下列选项中属于重点城市空气质量日报首要污染物的是_____
A.CO2 B.SO2 C.可吸入颗粒物 D.H2S
(2)汽车尾气常含有CO、NO等有毒气体,汽车气缸中生成NO的化学方程式是___________
(3)汽车排气管装有的三元催化装置,可以消除CO、NO等的污染,反应机理如下(以Pt催化剂为例)
I:NO+Pt(S)=NO(S)(Pt(S)表示催化剂,NO(S)表示吸附态NO,下同)
II:CO+Pt(S)=CO(S)
III:NO(S)=N(S)+O(S)
IV:CO(S)+O(S)=CO2+2Pt(S)
V:N(S)+N(S)=N2+2Pt(S)
VI:NO(S)+N(S)=N2O+2Pt(S)
尾气中反应物及生成物浓度随温度的变化关系如下图。
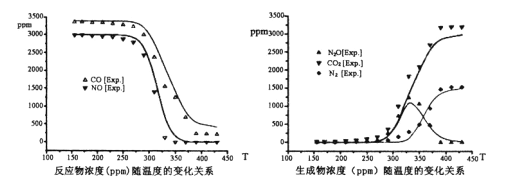
回答下面问题
①汽车尾气消污反应最适宜的反应温度是____
A. 250℃ B.300℃ C.330℃ D.400℃
②330℃以下的低温区发生的主要反应的化学方程式是___________
③低温区N2O选择性高于N2,由此可推断出:V反应的活化能____Ⅵ反应的活化能(填
“<”、“>”或“=”),理由是_______________
④结合反应机理和图像温度位于330℃—400℃时,升高温度,V反应的反应速率_____,(填“增大”、“减小”或“不变”,下同),Ⅳ反应的反应速率__________。
-
近年来环境问题突出,大气污染更为严重。回答下面问题
(1)下列选项中属于重点城市空气质量日报首要污染物的是_____
A.CO2 B.SO2 C.可吸入颗粒物 D.H2S
(2)汽车尾气常含有CO、NO等有毒气体,汽车气缸中生成NO的化学方程式是___________
(3)汽车排气管装有的三元催化装置,可以消除CO、NO等的污染,反应机理如下(以Pt催化剂为例)
I:NO+Pt(S)=NO(S)(Pt(S)表示催化剂,NO(S)表示吸附态NO,下同)
II:CO+Pt(S)=CO(S)
III:NO(S)=N(S)+O(S)
IV:CO(S)+O(S)=CO2+2Pt(S)
V:N(S)+N(S)=N2+2Pt(S)
VI:NO(S)+N(S)=N2O+2Pt(S)
尾气中反应物及生成物浓度随温度的变化关系如下图。
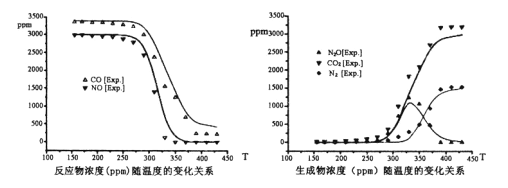
回答下面问题
①汽车尾气消污反应最适宜的反应温度是____
A. 250℃ B.300℃ C.330℃ D.400℃
②330℃以下的低温区发生的主要反应的化学方程式是___________
③低温区N2O选择性高于N2,由此可推断出:V反应的活化能____Ⅵ反应的活化能(填
“<”、“>”或“=”),理由是_______________
④结合反应机理和图像温度位于330℃—400℃时,升高温度,V反应的反应速率_____,(填“增大”、“减小”或“不变”,下同),Ⅳ反应的反应速率__________。
-
近年来环境问题突出,大气污染更为严重。回答下面问题
(1)下列选项中属于重点城市空气质量日报首要污染物的是_____
A.CO2 B.SO2 C.可吸入颗粒物 D.H2S
(2)汽车尾气常含有CO、NO等有毒气体,汽车气缸中生成NO的化学方程式是___________
(3)汽车排气管装有的三元催化装置,可以消除CO、NO等的污染,反应机理如下(以Pt催化剂为例)
I:NO+Pt(S)=NO(S)(Pt(S)表示催化剂,NO(S)表示吸附态NO,下同)
II:CO+Pt(S)=CO(S)
III:NO(S)=N(S)+O(S)
IV:CO(S)+O(S)=CO2+2Pt(S)
V:N(S)+N(S)=N2+2Pt(S)
VI:NO(S)+N(S)=N2O+2Pt(S)
尾气中反应物及生成物浓度随温度的变化关系如下图。
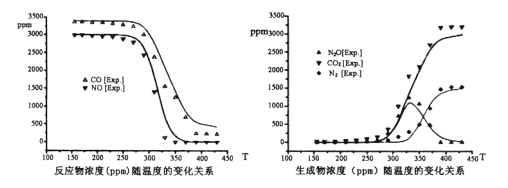
回答下面问题
①汽车尾气消污反应最适宜的反应温度是____
A. 250℃ B.300℃ C.330℃ D.400℃
②330℃以下的低温区发生的主要反应的化学方程式是___________
③低温区N2O选择性高于N2,由此可推断出:V反应的活化能____Ⅵ反应的活化能(填
“<”、“>”或“=”),理由是_______________
④结合反应机理和图像温度位于330℃—400℃时,升高温度,V反应的反应速率_____,(填“增大”、“减小”或“不变”,下同),Ⅳ反应的反应速率__________。
-
大气污染越来越成为人们关注的问题,工业生产尾气中的氮氧化物必须脱除(即脱硝)后才能排放。
(1)已知:
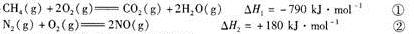
CH4可用于脱硝,其热化学方程式为:
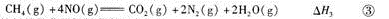
已知反应①中的相关的化学键键能数据如下:
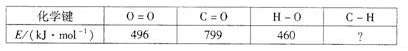
由此计算△H3= kJ·mol-1,C-H化学键键能E= kJ·mol-1。
(2)反应2CO(g) +2NO(g)=N2(g)+2CO2(g)也可用于脱硝,图1为该反应过程中NO的平衡转化率a(NO)与温度、压强的关系[其中初始c(CO)和c(NO)均为1mol.L-1],计算该反应在200cC时的平衡常数K=__ ,图中压强(P1、P2、P3)的大小顺序为_____________。
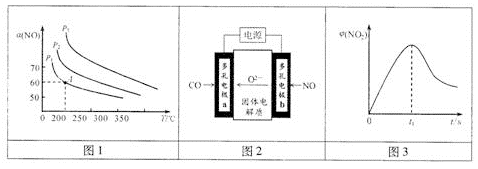
(3)有人利用电化学方法将CO和NO转化为无毒物质。装置如图2所示
①电极a是 极;②电极b的电极反应式是 。
(4)新型臭氧氧化技术利用具有极强氧化性的0,对尾气中的NO脱除,反应为NO(g)+O3(g)=NO2(g)+O2(g),在一定条件下,将NO和0,通人密闭容器中并不断加热发生反应(温度不超过各物质的分解温度),NO2的体积分数妒(NO2)随时间变化如图3所示,可以发现t1s后NO。的体积分数下降,其可能的原因是__________。研究小组通过增大 比值提高NO的平衡转化率,却发现当
比值提高NO的平衡转化率,却发现当 >1时,NO2的物质的量减小,可能原因是________________。
>1时,NO2的物质的量减小,可能原因是________________。
-
在工业废气和汽车尾气中含有多种氮氧化物,氮氧化物能破坏臭氧层,产生光化学烟雾,是造成大气污染的来源之一。
(1)处理 NO 尾气通常是将 NO 与 O2 混合通入碱液中吸收。已知一定条件下有下列反应:
Ⅰ:2N2O5(g)  4NO2(g)+O2(g) △H1
4NO2(g)+O2(g) △H1
Ⅱ:2NO2(g) 2NO(g)+O2(g) △H2
2NO(g)+O2(g) △H2
Ⅲ:2NaOH(aq)+N2O5(g)=2NaNO3(aq)+H2O(1) △H3
写出 NO 和O2 的混合物溶于NaOH 溶液生成硝酸盐的热化学方程式______。
(2)常温下,NO 极易被 O2 氧化为 NO2,温度高于 423K 时,NO2 发生分解:2NO2(g)  2NO(g)+O2(g)△H=114kJ·mol -1,实验测得:
2NO(g)+O2(g)△H=114kJ·mol -1,实验测得:
υ正=υ(NO2)消耗=k 正C2(NO2), υ逆=υ(NO)消耗=2υ(O2) 消耗=k 逆c2(NO)·c( O2),k 正、k 逆 为速率常数,受温度影响。不同温度下,将 NO2 置于体积为 VL 的密闭容器中,NO2 的物质的量的浓度与反应时间的关系如图所示:
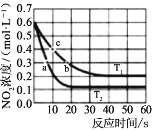
①T1 温度下 0-10s 内,O2 的反应速率υ(O2)=______、平衡常数 KT1=___________。
②T1 温度下,要减少 NO2 的分解率,并缩短达到平衡的时间,可采取的单一措施有______
③平衡常数KT1 ______ KT2 填“大于”“小于”或“等于”,下同);反应速率υa_______υb。
④计算 c 处υ正/υ逆=______。
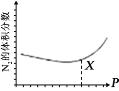
(3)NO 也 可 通 过 如 下 反 应 处 理 :6NO(g)+4NH3(g) =5N2(g) +6H2O(g);一定条件下,平衡时 N2 的体积分数与压强的关系如图所示。N2 的体积分数先减小后增大的原因是______。
-
随着我国工业化水平的不断发展,解决水、空气污染问题成为重要课题。
(1)工业尾气中含有大量的氮氧化物,NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。反应原理如图所示:
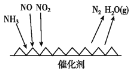
①由图可知SCR技术中的氧化剂为____。
②用Fe作催化剂加热时,在氨气足量的情况下,当NO2与NO的物质的量之比为1:1时,写出该反应的化学方程式:_______。
(2)ClO2气体是一种常用的消毒剂,现在被广泛用于饮用水消毒。自来水厂用ClO2处理后的水中,要求ClO2的浓度在0.1~0.8 mg/L。碘量法可以检测水中ClO2的浓度,步骤如下:
Ⅰ.取一定体积的水样用微量的氢氧化钠溶液调至中性,然后加入一定量的碘化钾,并加入淀粉溶液,溶液变蓝
Ⅱ.加入一定量的Na2S2O3溶液(已知:2S2O32-+I2=S4O62-+2I-)
Ⅲ.加硫酸调节水样pH至1.3。
已知:ClO2在中性条件下还原产物为ClO2-,在酸性条件下还原产物为Cl-。请回答下列问题:
①确定操作Ⅱ完全反应的现象为________。
②在操作Ⅲ过程中,溶液又呈蓝色,反应的离子方程式为______。
③若水样的体积为1.0 L,在操作Ⅱ时消耗了1.0×10-3 mol/L的Na2S2O3溶液10 mL,则水样中ClO2的浓度是____mg/L。


的含量为_______________mg/m3。