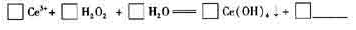-
工业上利用如下反应制取P4:2Ca(PO4)2 +6SiO2+10C 6CaSiO3+P4+10CO
6CaSiO3+P4+10CO
回答下列问题:
(1)基态硅原子的核外电子排布式为___。
(2)Si、P、S元素第一电离能大小关系为___。
(3)P4中P原子的杂化方式是___ ,P4的空间结构为___ ,键角∠PPP=___。
(4)与CO互为等电子的阴离子是___ (填化学式)。
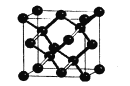
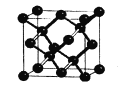
(5)晶体硅与金刚石结构相似,下图为晶体硅的晶胞结构。已知硅原子的半径为r nm,晶体硅的密度是___g/cm3。
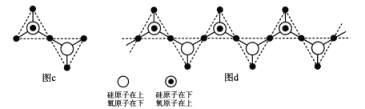
(6)硅的含氧化合物都以硅氧四面体(SiO4)作为基本结构单元,如图a所示,可简化为图b。
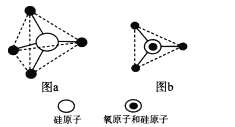
硅、氧原子通过共用氧原子形成各种不同的硅酸根负离子,如图c和图d,图c的化学式____________。在无限长链的硅酸根中硅氧原子之比为____。

硅、氧原子除可形成长链外,也可形成层状和立体网状结构。在立体网状结构中,硅、氧原子数之比为____。
-
工业上利用如下反应制取P4:2Ca(PO4)2 +6SiO2+10C 6CaSiO3+P4+10CO
6CaSiO3+P4+10CO
回答下列问题:
(1)基态硅原子的核外电子排布式为___。
(2)Si、P、S元素第一电离能大小关系为___。
(3)P4中P原子的杂化方式是___ ,P4的空间结构为___ ,键角∠PPP=___。
(4)与CO互为等电子的阴离子是___ (填化学式)。
(5)晶体硅与金刚石结构相似,下图为晶体硅的晶胞结构。已知硅原子的半径为r nm,晶体硅的密度是___g/cm3。
(6)硅的含氧化合物都以硅氧四面体(SiO4)作为基本结构单元,如图a所示,可简化为图b。

硅、氧原子通过共用氧原子形成各种不同的硅酸根负离子,如图c和图d,图c的化学式____________。在无限长链的硅酸根中硅氧原子之比为____。
硅、氧原子除可形成长链外,也可形成层状和立体网状结构。在立体网状结构中,硅、氧原子数之比为____。
-
磷是地壳中含量较为丰富的非金属元素,它的单质和化合物在工农业生产中应用广泛。白磷可通过反应 2Ca3(PO4)2+10C→6CaO+P4+10CO 获得。完成下列填空:
(1)磷原子的最外层电子排布式是__________,氧原子核外有______种不同运动状态的电子。C、O两种元素非金属性较强的是_______________。
(2)白磷在空气中露置时间长了会因温度达到____而自燃,使白磷升温的热量主要来自_________。某温度时,在2.0L恒容密闭容器中充入0.5mol PCl5,发生反应PCl5(g) PCl3(g)+Cl2(g)-Q,经过一段时间后达到平衡。
PCl3(g)+Cl2(g)-Q,经过一段时间后达到平衡。
(3)该反应的平衡常数表达式 K=_____________;
(4)其他条件不变,起始时向上述容器中充入1.0 mol PCl5,达到平衡时,PCl5的转化率____(选填“增大”、 “减小”“不变”),平衡常数 K____(选填“增大”、 “减小”“不变”)。
(5)在不同时间(t)测得反应过程中 PCl5 的部分数据如下:
| t(s) | 0 | 50 | 100 | 250 | 350 |
| n(mol) | 0.5 | 0.42 | 0.41 | 0.40 | 0.40 |
则 100s 时, PCl3的物质的量浓度是__________________。
-
Ⅰ.磷、硫元素的单质和化合物应用广泛。
(1)磷元素的原子结构示意图是 。
(2)磷酸钙与焦炭、石英砂混合,在电炉中加热到1 500 ℃生成白磷,反应为:
2Ca3(PO4)2+6SiO2 6CaSiO3+P4O10
6CaSiO3+P4O10
10C+P4O10 P4+10CO
P4+10CO
每生成1 mol P4时,就有 mol电子发生转移。
(3)硫代硫酸钠(Na2S2O3)是常用的还原剂。在维生素C(化学式C6H8O6)的水溶液中加入过量I2溶液,使维生素C完全氧化,剩余的I2用Na2S2O3溶液滴定,可测定溶液中维生素C的含量。发生的反应为:
C6H8O6+I2 C6H6O6+2H++2I-
C6H6O6+2H++2I-
2S2 +I2
+I2 S4
S4 +2I-
+2I-
在一定体积的某维生素C溶液中加入a mol/L I2溶液V1 mL,充分反应后,用Na2S2O3溶液滴定剩余的I2,消耗b mol/L Na2S2O3溶液V2 mL。该溶液中维生素C的物质的量是 mol。
(4)在酸性溶液中,碘酸钾(KIO3)和亚硫酸钠可发生如下反应:
2I +5S
+5S +2H+
+2H+ I2+5S
I2+5S +H2O
+H2O
生成的碘可以用淀粉溶液检验,根据反应溶液出现蓝色所需的时间来衡量该反应的速率。
某同学设计实验如下表所示:
| 0.01 mol/LKIO3酸性溶液(含淀粉)的体积/mL | 0.01 mol/LNa2SO3溶液的体积/mL | H2O的体积/mL | 实验温度/℃ | 溶液出现蓝色时所需时间/s |
| 实验1 | 5 | V1 | 35 | 25 | |
| 实验2 | 5 | 5 | 40 | 25 | |
| 实验3 | 5 | 5 | V2 | 0 | |
该实验的目的是 ;表中V2= mL。
Ⅱ.稀土元素是宝贵的战略资源,我国的蕴藏量居世界首位。
(5)铈(Ce)是地壳中含量最高的稀土元素。在加热条件下CeCl3易发生水解,无水CeCl3可用加热CeCl3·6H2O和NH4Cl固体混合物的方法来制备。其中,NH4Cl的作用是 。
(6)在某强酸性混合稀土溶液中加入H2O2,调节pH≈3,Ce3+通过下列反应形成Ce(OH)4沉淀得以分离。完成反应的离子方程式:
Ce3++ H2O2+ H2O Ce(OH)4↓+ 。
Ce(OH)4↓+ 。
-
Ⅰ、磷、硫元素的单质和化合物应用广泛.
(1)磷元素的原子结构示意图是________.
(2)磷酸钙与焦炭、石英砂混合,在电炉中加热到1500℃生成白磷,反应为:
2Ca3(PO4)2+6SiO2═6CaSiO3+P4O10 10C+P4O10═P4+10CO
每生成1molP4时,就有________mol电子发生转移.
(3)硫代硫酸钠(Na2S2O3)是常用的还原剂.在维生素C(化学式C6H8O6)的水溶液中加入过量I2溶液,使维生素C完全氧化,剩余的I2用Na2S2O3溶液滴定,可测定溶液中维生素C的含量.发生的反应为:C6H8O6+I2═C6H6O6+2H++2I- 2S2O32-+I2═S4O62-+2I-
在一定体积的某维生素C溶液中加入a mol•L-1I2溶液V1mL,充分反应后,用Na2S2O3溶液滴定剩余的I2,消耗b mol•L-1Na2S2O3溶液V2mL.该溶液中维生素C的物质的量是________mol.
II、稀土元素是宝贵的战略资源,我国的蕴藏量居世界首位.
(4)铈(Ce)是地壳中含量最高的稀土元素.在加热条件下CeCl3易发生水解,无水CeCl3可用加热CeCl3•6H2O和NH4Cl固体混合物的方法来制备.其中NH4Cl的作用是________.
(5)在某强酸性混合稀土溶液中加入H2O2,调节pH≈3,Ce3+通过下列反应形成Ce(OH)4沉淀得以分离.完成反应的离子方程式:
□Ce3++□H2O2+□H2O═□Ce(OH)4↓+□________.
-
利用氟磷灰石[主要成分Ca5(PO4)3F生产磷酸主要有热法和湿法两种方法。其流程如下:
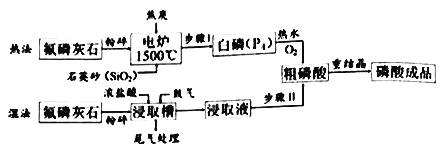
热法:工业上将氟磷灰石、焦炭和石英砂(SiO2)混合后,在电炉中加热到1500℃生成白磷(P4)、SiF4、CO,白磷在空气中燃烧生成五氧化二磷,再经水化制成粗磷酸。
湿法:武汉化工研究院为技术攻关,实验室模拟生产磷酸的流程。
(1)配平步骤I反应的化学方程式:
____Ca5(PO4)3F+ ____C+ ____SiO2=____SiF4↑+ ___P4+____CO↑+____CaSiO3。其中氧化剂是______。
(2)湿法中粉碎氟磷灰石的目的是___________。
(3)浸取槽中发生反应的化学方程式________;浸取槽不能使用玻璃器皿的原因___________。
(4)探究中发现,65℃、一定流速下鼓气(鼓气可减少盐酸与氟磷灰石矿反应过程中液面的泡沫,利于HF逸出),并通过控制盐酸的用量减少后续除氟工艺。其他条件不变,盐酸实际用量/理论用量与所得的磷酸中氟含量及磷酸的浸取率如图所示。
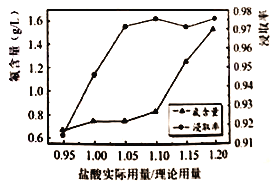
①选择盐酸用量:盐酸实际用量/理论用量的范围为________(填字母代号)时磷酸浸取率较高且氟含量较低。
A.0.95~1.00 B.1.00~1.05
C. 1.05~1.10 D.1.15~1.20
②盐酸稍过量,氟含量降低的原因是___________。
③盐酸过量较多,氟含量快速增加的可能原因是___________。
(5)通过双指示剂方法测定浸取液中盐酸和磷酸的浓度。实验如下:每次取10.0mL浸取液,用1.0 mol·L-1NaOH溶液滴定,分别用不同的指示剂,滴定结果见表。含磷微粒在不同pH下物质的量分数如图所示。(甲基橙的变色范围为3.1~4.4,百里酚酞的变色范围为9.4~10.6)
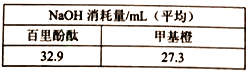
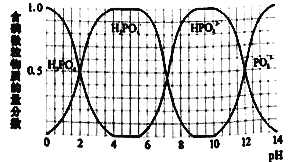
则浸取液中c(HCl)=___________mol·L-1。
-
I.磷、硫元素的单质和化合物应用广泛。
(1)磷元素的原子结构示意图是________。
(2)磷酸钙与焦炭、石英砂混合,在电炉中加热到1500°C生成白磷,反应为:
2Ca3(PO4)2+6SiO2==6CaSiO3+P4O10 10C+P4O10==P4+10CO
每生成 1molP4 时,就有________mol电子发生转移。
(3)硫代硫酸钠(Na2S2O2)是常用的还原剂。在维生素C(化学式C6H8O6)的水溶液中加入过量I2溶液,使维生素 完全氧化,剩余的I2 用Na2S2O2溶液滴定,可测定溶液中维生素C的含量。发生的反应为:
C6H8O6+I2===C6H6O6+2H++2I- 2S2O32-+I2===S4O62-+2I-
在一定体积的某维生素C溶液中加入amolL-1I2溶液V1ml,充分反应后,用Na2S2O2溶液滴定剩余的I2,消耗bmolL-1 Na2S2O2溶液V2ml.该溶液中维生素C的物质量是________mol。
(4)在酸性溶液中,碘酸钠(KIO3)和亚硫酸钠可发生如下反映:
2IO3-+5SO32-+2H+==I2+5SO42++H2O
生成的碘可以用淀粉液检验,根据反应溶液出现蓝色所需的时间来衡量该反应的速率。某同学设计实验如下表所示:
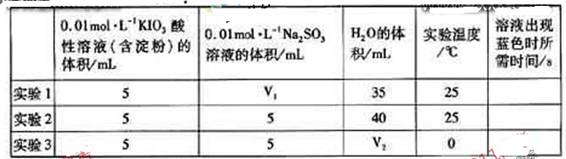
该实验的目的是______;表中 ______ML。
______ML。
II 稀土元素是宝贵的战略资源,我国的蕴藏量居世界首位。
(5)钵(Ce)是地壳中含量最高的稀土元素,在加热条件下CeCl3易发生水解,无水CeCl3,可用加热CeCl3• 6H2O和NH4Cl固体混合物的方法来制备。其中,NH4Cl的作用是___________。
(6)在某强酸性混合稀土溶液中加入H2O2,调节pH ≈3. Ce5+通过下列反应形成Ce
(OH)4沉淀得以分离。完成反应的离子方程式:
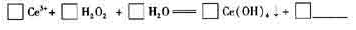
-
I、磷、硫元素的单质和化合物应用广泛.
(1)磷元素的原子结构示意图是________.
(2)磷酸钙与焦炭、石英砂混合,在电炉中加热到1500℃生成白磷,反应为:
2Ca3(PO4)2+6SiO2═6CaSiO3+P4O10 10C+P4O10═P4+10CO
每生成1mol P4时,就有________mol电子发生转移.
(3)硫代硫酸钠(Na2S2O3)是常用的还原剂.在维生素C(化学式C6H8O6)的水溶液中加入过量I2溶液,使维生素C完全氧化,剩余的I2用Na2S2O3溶液滴定,可测定溶液中维生素C的含量.发生的反应为:
C6H8O6+I2═C6H6O6+2H++2I- 2S2O32-+I2═S4O62-+2I-
在一定体积的某维生素C溶液中加入a mol•L-1I2溶液V1mL,充分反应后,用Na2S2O3溶液滴定剩余的I2,消耗b mol•L-1Na2S2O3溶液V2mL.该溶液中维生素C的物质的量是________mol.
(4)在酸性溶液中,碘酸钾(KIO3)和亚硫酸钠可发生如下反应:2IO3-+5SO32-+2H+═I2+5SO42-+H2O
生成的碘可以用淀粉溶液检验,根据反应溶液出现蓝色所需的时间来衡量该反应的速率.某同学设计实验如表所示:
| 0.01mol•L-1
KIO3酸性溶液(含淀粉)的体积/mL | 0.01mol•L-1
Na2SO3溶液的体积/mL | H2O的体积
/mL | 实验
温度
/℃ | 溶液出现蓝色时所需时间/s |
| 实验1 | 5 | V1 | 35 | 25 | |
| 实验2 | 5 | 5 | 40 | 25 | |
| 实验3 | 5 | 5 | V2 | | |
该实验的目的是________;表中V2=________mL
II、稀土元素是宝贵的战略资源,我国的蕴藏量居世界首位.
(5)铈(Ce)是地壳中含量最高的稀土元素.在加热条件下CeCl3易发生水解,无水CeCl3可用加热CeCl3•6H2O和NH4Cl固体混合物的方法来制备.其中NH4Cl的作用是________.
(6)在某强酸性混合稀土溶液中加入H2O2,调节pH≈3,Ce3+通过下列反应形成Ce(OH)4沉淀得以分离.完成反应的离子方程式:________Ce3++________H2O2+________H2O═________Ce(OH)4↓+________.
-
(16分)目前工业上可利用CO或CO2来生产燃料甲醇,某研究小组对下列有关甲醇制取的三条化学反应原理进行探究。已知在不同温度下的化学反应。平衡常数(K1、K2、K3)如下所示:
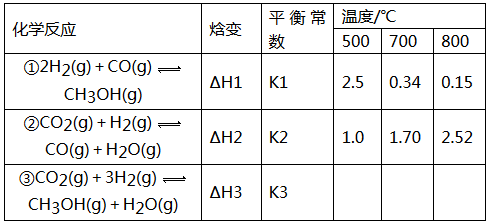
请回答下列问题:
(1)反应②是______________(填“吸热”或“放热”)反应。
(2)据反应①与②可推导出K1、K2与K3之间的关系,则K3=_____________(用K1、K2表示)。
(3)要使反应③在一定条件下建立的平衡逆向移动,可采取的措施有_______________(填字母序号)
A.缩小反应容器的容积 B.扩大反应容器的容积
C.升高温度 D.使用合适的催化剂
E.从平衡体系中及时分离出CH3OH
(4)500℃时,测得反应③在某时刻,H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度(mol·L-1)分别为0.8、0.1、0.3、0.15,则此时v正____________v逆(填“>”、“=”或“<”).
(5)甲醇是重要的基础化工原料,又是一种新型的燃料,最近有人制造了一种燃料电池,一个电极通入空气,另一个电极加入甲醇,电池的电解质是掺杂了Y2O3的ZrO2晶体,它们在高温下能传导O2-离子,该电池的正极反应式为_________________。电池工作时,固体电解质里的O2-向_____________极移动。
(6)300℃时,在一定的压强下,5molCO与足量的H2在催化剂的作用下恰好完全反应变化的热量为454kJ。在该温度时,在容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
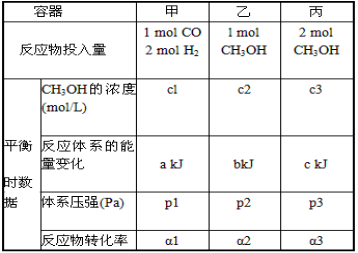
下列说法正确的是______________________。
A.2c1>c3 B.a+b<90.8 C.2p 2<p3 D.α1+α3<1
-
(14分)工业上可以利用废气中的CO2为原料制取甲醇,反应方程式为:CO2+3H2 CH3OH+H2O。请回答下列问题:
CH3OH+H2O。请回答下列问题:
(1)已知常温常压下下列反应的能量变化如下图所示:
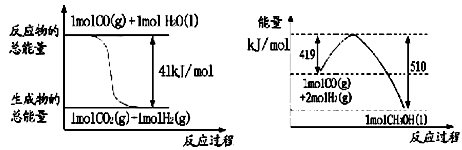
写出由二氧化碳和氢气制备甲醇的热化学方程式__ _。
(2)如果只改变一个条件使上述反应方程式的平衡常数K值变大,则该反应__ (选填编号)。
A.一定向正反应方向移动
B.在平衡移动时正反应速率先增大后减小
C.一定向逆反应方向移动
D.在平衡移动时逆反应速率先减小后增大
(3)其他条件相同,该甲醇合成反应在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下反应相同时间后,CO2的转化率随反应温度的变化如图所示。
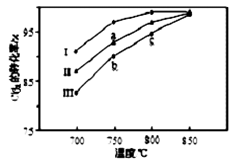
①在相同条件下,三种催化剂Ⅰ、Ⅱ、Ⅲ的催化效率由高到低的顺序是________。
②a点所代表的状态________(填“是”或“不是”)平衡状态。
③c点CO2的转化率高于b点,原因是________。
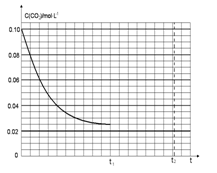
(4)若反应的容器容积为2.0L,反应时间4.0 min,容器内气体的密度减少了2.0g/L,在这段时间内CO2的平均反应速率为 。反应在t1时达到平衡,过程中c(CO2)随时间t变化趋势曲线下图所示。保持其他条件不变,t1时将容器体积压缩到1L,请在图中画出t1后c(CO2)随时间t变化趋势曲线(假定t2时刻达到新的平衡)。
6CaSiO3+P4+10CO