-
(16分)目前工业上可利用CO或CO2来生产燃料甲醇,某研究小组对下列有关甲醇制取的三条化学反应原理进行探究。已知在不同温度下的化学反应。平衡常数(K1、K2、K3)如下所示:
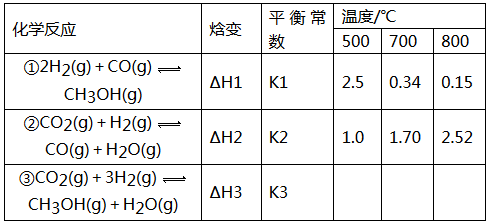
请回答下列问题:
(1)反应②是______________(填“吸热”或“放热”)反应。
(2)据反应①与②可推导出K1、K2与K3之间的关系,则K3=_____________(用K1、K2表示)。
(3)要使反应③在一定条件下建立的平衡逆向移动,可采取的措施有_______________(填字母序号)
A.缩小反应容器的容积 B.扩大反应容器的容积
C.升高温度 D.使用合适的催化剂
E.从平衡体系中及时分离出CH3OH
(4)500℃时,测得反应③在某时刻,H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度(mol·L-1)分别为0.8、0.1、0.3、0.15,则此时v正____________v逆(填“>”、“=”或“<”).
(5)甲醇是重要的基础化工原料,又是一种新型的燃料,最近有人制造了一种燃料电池,一个电极通入空气,另一个电极加入甲醇,电池的电解质是掺杂了Y2O3的ZrO2晶体,它们在高温下能传导O2-离子,该电池的正极反应式为_________________。电池工作时,固体电解质里的O2-向_____________极移动。
(6)300℃时,在一定的压强下,5molCO与足量的H2在催化剂的作用下恰好完全反应变化的热量为454kJ。在该温度时,在容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
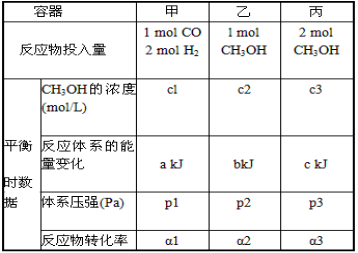
下列说法正确的是______________________。
A.2c1>c3 B.a+b<90.8 C.2p 2<p3 D.α1+α3<1
-
(12分)随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视。目前工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验,在体积为1 L的密闭容器中,充入lmol CO2和3mol H2,一定条件下发生反应:
CO2(g)+3H2(g)  CH3OH(g)+H2O(g) △H = —49.0kJ/mo1.
CH3OH(g)+H2O(g) △H = —49.0kJ/mo1.
测得CO2和CH3OH(g)的浓度随时间变化如图所示。
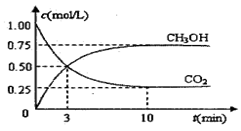
(1)从反应开始到平衡,氢气的平均反应速率v(H2)=mol/(L·min)
(2)该反应的平衡常数为。
(3)下列措施中能使n(CH3OH)/n(CO2)增大的是________。
A.升高温度 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离 D.再充入lmol CO2和3mol H2
(4)已知在常温常压下:
①2CH3OH(1)+3O2(g)=2CO2(g)+4H2O(g) △H= —1275.6kJ/mol
②H2O(g)=H2O(1) △H= —44.0kJ/mol
则甲醇的燃烧热化学方程式为:;
(5)如果燃烧甲醇会造成大量化学能损失,如果以甲醇和空气为原料,以氢氧化钠为电解质溶液设计成原电池将有很多优点,请书写出该电池的负极反应:___________________
(6)常温下,某水溶液M中存在的离子有:Na+、A—、H+、OH—。若该溶液M由 pH=3的HA溶液 mL与pH=11的NaOH溶液
mL与pH=11的NaOH溶液 mL混合反应而得,则下列说法中正确的是__。
mL混合反应而得,则下列说法中正确的是__。
A.若溶液M呈中性,则溶液M中c(H+)+c(OH—)=2×10—7mol·L-1
B.若V1=V2,则溶液M的pH一定等于7
C.若溶液M呈酸性,则V1一定大于V2
D.若溶液M呈碱性,则V1一定小于V2
-
随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视.
(1)目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验:在体积为1L的密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)△H=-49.0kJ/mol,测得CO2和CH3OH(g)的浓度随时间变化如图所示.
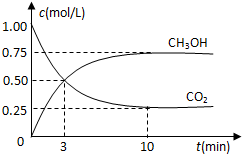
①从反应开始到平衡,氢气的平均反应速率v(H2)=________mol/.
②该反应的平衡常数表达式为________.
③下列措施中能使n(CH3OH)/n(CO2)增大的是________.
A.升高温度 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离 D.再充入1mol CO2和3mol H2
(2)在载人航天器的生态系统中,不仅要求分离去除CO2,还要求提供充足的O2.某种电化学装置可实现如下转化:2CO2=2CO+O2,CO可用作燃料.已知该反应的阳极反应为:4OH--4e-=O2↑+2H2O,则阴极反应式为:________.
有人提出,可以设计反应2CO=2C+O2(△H>0、△S<0)来消除CO的污染.请你判断是否可行并说出理由:________.
-
(14分)随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视。
(1)目前工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验,在体积为1 L的密闭容器中,充入1mol CO2和3mol H2,在500oC下发生反应:
CO2(g)+3H2(g) CH3OH(g)+H2O(g);△H=-49.0kJ/mol
CH3OH(g)+H2O(g);△H=-49.0kJ/mol
测得CO2和CH3OH(g)的浓度随时间变化如图所示。
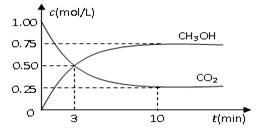
①从反应开始到平衡,氢气的平均反应速率
v(H2)=______________________________;
②该反应的平衡常数K为__________(精确到小数点后两位)。若提高温度到800oC进行达平衡时;K值__________,n(CH3OH)/n(CO2)比值__________(以上两空填“增大”、“减小”或“不变”);
③平衡时CH3OH的体积分数 为__________;
为__________;
④若在相同条件下,起始时加入物质的量为:a mol CO2、b mol H2和c mol CH3OH、c mol H2O,达平衡后,CH3OH的体积分数仍为 。则a、b、c的关系为__________。
。则a、b、c的关系为__________。
(2)在载人航天器的生态系统中,不仅要求分离去除CO2,还要求提供充足的O2。某种电化学装置可实现如下转化:2CO2=2CO+O2,CO可用作燃料。已知该反应的阳极反应为:4OH―-4e―=O2↑+2H2O,则阴极反应式为______________________________。
-
随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视.
(1)目前工业上有一种方法是用CO2来生产燃料甲醇.为探究该反应原理,现进行如下实验,在体积为l L的密闭容器中,充入1molCO2和3.25molH2,一定条件下发生反应,测得CO2、CH3OH(g)和H2O(g)的浓度随时问变化如图所示.
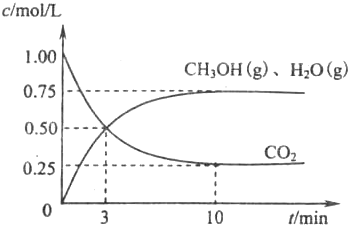
①写出该工业方法制取甲醇的化学方程式:________.
②从反应开始到平衡,氢气的平均反应速率v(H2)=________mol/.平衡时CO2的转化事为________.
③该条件下反应的平衡常数K的值为________.当温度降低时K值变大,剐该反应的△H________0(填“<”、“>”或“=”)
④下列措施中能使n(CH3OH)/n(CO2)增大的是________.
A.升高温度 B.充入He(g)
C.将H2O(g)从体系中分离 D.用更有效的催化剂
(2)在载人航天器的生态系统中.不仅要求分离除去CO2还要求提供充足的O2•某种电化学装置可实现如下转化:2CO2=2CO+O2,CO可用作燃料.已知该反应的阳极反应为4OH--4e-=O2↑+2H2O.划阴极反应式为:________.
-
(17分)随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视。
(1)目前工业上有一种方法是用CO2来生产燃料甲醇。为探究该反应原理,进行如下实验,在体积为2L的密闭容器中,充入1molCO2和3.25molH2,在一定条件下发生反应,测定CO2、CH3OH和H2O(g)的浓度随时间变化如图所示:

①写出该工业方法制取甲醇的化学方程式:________。
②从反应开始到平衡,氢气的平均反应速率v(H2)=________。
③反应到达平衡后,再向该容器中通入1 mol CO2和3.25 mol H2,重新到达平衡后,H2的转化率将________(填增大、减小或不变)
④下列措施中一定能使n(CH3OH)/ n(CO2)增大的是:________。
A.向容器中充入一定量的氦气 B.充入CO2
C.将水蒸气从体系中分离 D.用更有效的催化剂
(2)可燃性的有机物和氧气在理论上都可以作为燃料电池中的反应物,请写出CH3OH —O2—KOH燃料电池的负极的电极反应式:________
(3)若将一定数量的C3H8—O2—KOH燃料电池按一定方式组成电池组以满足电解需要的电压。现用该电池组电解500mL某CuSO4的稀溶液(用铂为电极),电解后的溶液需要加入98克Cu(OH)2才能使溶液恢复到原硫酸铜溶液的浓度和质量。若忽略电池组在电解过程中的能量损失,其能量全部用来电解CuSO4溶液,则:
①原CuSO4溶液物质的量浓度________
②该电池组消耗的丙烷在标准状况时的体积________
-
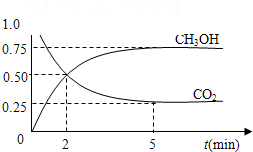
如何降低大气中CO2的含量及有效地开发利用CO2,已受到各国的普遍重视.
(1)目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在体积为1L的密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g),△H=-49.0kJ/mol测得CO2和CH3OH(g)的浓度随时间变化如图所示.
①从反应开始到平衡,氢气的平均反应速率v(H2)=________mol/.
②该反应的平衡常数表达式为________.
③其它条件不变,下列措施中能使
n(CH3OH)/n(CO2)增大的是________.
A.升高温度 B.再充入1mol CO2和3mol H2
C.将H2O(g)从体系中分离 D.充入He(g),使体系压强增大
(2)CO2是典型的酸性氧化物,能转化为其它物质.
①利用CO2可制得纯碱,纯碱溶液PH________7(填大于、等于、小于);原因是(用离子反应方程式表示)________.
②一定温度下,在碳酸钙饱和溶液中滴加饱和碳酸钠溶液,观察到的现象是________;产生此现象的原因是________.
(3)在载人航天器的生态系统中,不仅要求分离除去CO2,还要求提供充足的O2.某种电化学装置可实现如下转化:2CO2=2CO+O2 ,CO可用作燃料.已知该反应的阳极反应为:4OH--4e-=O2↑+2H2O则阴极反应式为:________.
-
随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视。
⑴目前工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验,在体积为1 L的密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:
CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-49.0kJ/mol
CH3OH(g)+H2O(g) △H=-49.0kJ/mol
测得CO2和CH3OH(g)的浓度随时间变化如图所示。
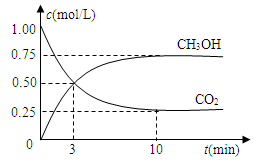
①从反应开始到平衡,氢气的平均反应速率v(H2)=___________mol/(L·min)。
②该反应的平衡常数表达式为__________________。
③下列措施中能使n(CH3OH)/n(CO2)增大的是___________。
A.升高温度 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离 D.再充入1mol CO2和3mol H2
⑵在载人航天器的生态系统中,不仅要求分离去除CO2,还要求提供充足的O2。某种电化学装置可实现如下转化:2 CO2=2 CO+O2,CO可用作燃料。
已知该反应的阳极反应为:4OH――4e―=O2↑+2H2O
则阴极反应式为:________________________________。
有人提出,可以设计反应2CO=2C+O2(△H>0、△S<0)来消除CO的污染。请你判断是否可行并说出理由:__________________________________________。
-
降低大气中CO2的含量及有效地开发利用 CO2,目前工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验,在体积为1L的恒容密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)  CH3OH(g)+H2O(g) ΔH=-49.0kJ/mol。测得CO2和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g) ΔH=-49.0kJ/mol。测得CO2和CH3OH(g)的浓度随时间变化如图所示。
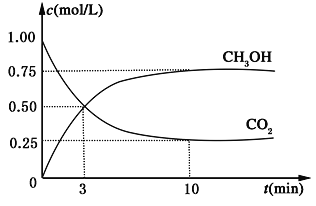
(1)从反应开始到平衡,氢气的平均反应速率v(H2)=___________________mol/(L·min);
(2)氢气的转化率=________________________;
(3)反应过程中,下列能说明该反应达到平衡状态的是______________________。
a.体系压强保持不变
b.混合气体密度保持不变
c.混合气体的平均相对分子质量保持不变
d.CO2的消耗速率等于CH3OH的生成速率
e.CO2与CH3OH的物质的量浓度相等
(4)该反应的平衡常数为__________________________ (保留小数点后2位);
(5)下列措施中能使平衡体系中n(CH3OH)/n(CO2)增大的是_____________________。
A.升高温度
B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离出去
D.再充入1mol H2
(6)当反应达到平衡时,H2的物质的量浓度为c1,然后向容器中再加入一定量H2,待反应再一次达到平衡后,H2的物质的量浓度为c2,则c1________c2的关系(填“>”、“<”或“=”)。
-
降低大气中CO2的含量及有效地开发利用 CO2,目前工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验,在体积为1L的恒容密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)  CH3OH(g)+H2O(g) ΔH=-49.0kJ/mol。测得CO2和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g) ΔH=-49.0kJ/mol。测得CO2和CH3OH(g)的浓度随时间变化如图所示。

(1)从反应开始到平衡,氢气的平均反应速率v(H2)=___________________mol/(L·min);
(2)氢气的转化率=________________________;
(3)反应过程中,下列能说明该反应达到平衡状态的是______________________。
a.体系压强保持不变
b.混合气体密度保持不变
c.混合气体的平均相对分子质量保持不变
d.CO2的消耗速率等于CH3OH的生成速率
e.CO2与CH3OH的物质的量浓度相等
(4)该反应的平衡常数为__________________________ (保留小数点后2位);
(5)下列措施中能使平衡体系中n(CH3OH)/n(CO2)增大的是_____________________。
A.升高温度
B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离出去
D.再充入1mol H2
(6)当反应达到平衡时,H2的物质的量浓度为c1,然后向容器中再加入一定量H2,待反应再一次达到平衡后,H2的物质的量浓度为c2,则c1________c2的关系(填“>”、“<”或“=”)。










