-
研究碳、氮、硫及其化合物的转化对环境的改善有重大意义。
(1)在一定条件下,CH4可与NO2反应除去NO,已知:
①CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-890.2kJ•mol-1
②2NO2(g)⇌N2(g)+2O2(g) ΔH=-67.0kJ•rnol-1
③H2O(g)=H2O(l) ΔH=-44.0kJ•mol-1
则CH4(g)+2NO2(g)⇌CO2(g)+2H2O(g)+N2(g) ΔH=_________kJ·mol-1。
(2)SO2经过净化后与空气混合进行催化氧化可制取硫酸,其中SO2发生催化氧化的反应为:2SO2(g)+O2(g)⇌2SO3(g) ΔH<0,下列说法正确的是________。
A.升高温度,正反应速率增大,逆反应速率减小
B.使用催化剂,能提高SO2的转化率
C在一定温度下的恒容容器中,混合气体的密度不再发生变化能说明上述反应达到平衡状态
D.温度不变,增大压强,该反应的化学平衡常数不变
E.350K和500K时,反应的平衡常数分别为Kl、K2,且K1>K2
(3)若在T1℃下,往一恒容密闭容器中通入SO2和O2[其中n(SO2):n(O2)=2:l]发生反应2SO2(g)+O2(g)⇌2SO3(g),容器中总压强为0.1MPa,反应8min时达到平衡,测得容器内总压强为0.09MPa,反应8min时,SO2的转化率为________。
(4)将NO2、O2和熔融KNO3制成燃料电池,电解处理含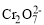 的废水,工作原理如图所示。
的废水,工作原理如图所示。
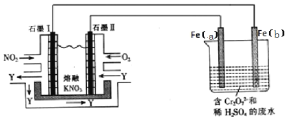
①Fe(a)电极为________(填“阳极”或“阴极”),a极的电极反应为_________。
②请完成电解池中Cr2O72-转化为Cr3+的离子反应方程式:___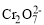 +___Fe2++___=____Cr3++___Fe3++____。
+___Fe2++___=____Cr3++___Fe3++____。
③若在标准状况下有224mL氧气参加反应,则电解装置中铁棒的质量减少_________。在相同条件下,消耗的NO2和O2的体积比为_________。
④称取含Na2Cr2O7的废水样品6.55g配成250mL溶液,量取25.00mL于碘量瓶中,加入2moll•L-1H2SO4和足量碘化钾溶液(铬的还原产物为Cr3+),放于暗处5min,加入淀粉溶液作指示剂,用0.3000mol•L-1Na2S2O3]标准溶液滴定(I2+2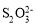 =2I-+
=2I-+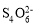 ),判断达到滴定终点的现象是_________。若实验中平均消耗Na2S2O3标准溶液25.00mL,则重铬酸钠的纯度为________(设整个过程中其他杂质不参与反应)
),判断达到滴定终点的现象是_________。若实验中平均消耗Na2S2O3标准溶液25.00mL,则重铬酸钠的纯度为________(设整个过程中其他杂质不参与反应)
(5)为了清除NO、NO2、N2O4对大气的污染,常采用氢氧化钠溶液进行吸收处理。现有由amolNO2、bmolN2O4,cmolNO组成的混合气体,恰好被VL氢氧化钠溶液吸收(无气体剩余)转化为NaNO3和NaNO2,则此氢氧化钠溶液的物质的量浓度最小为________。
-
运用化学反应原理研究碳、氮、硫的单质及其化合物的反应对缓解环境污染、能源危机具有重要意义。
I.氨为重要的化工原料,有广泛用途。
(1)合成氨中的氢气可由下列反应制取:
a. CH4(g)+H2O(g)⇌CO(g)+3H2(g) ∆H1=+216.4kJ/mol
b. CO(g)+H2O(g)⇌CO2(g)+H2(g) ∆H2=–41.2kJ/mol
则反应CH4(g)+2H2O(g)⇌CO2(g)+4H2(g) ∆H= _____________。
(2)起始时投入氮气和氢气的物质的量分别为1mol、3mol,在不同温度和压强下合成氨。平衡时混合物中氨的体积分数与温度的关系如图。

①恒压时,反应一定达到平衡状态的标志是_____________(填序号)
A. 和
和 的转化率相等 B.反应体系密度保持不变
的转化率相等 B.反应体系密度保持不变
C.相同时间内,断开H-H键的数目和生成N-H键的数目相同
D.容器内气体浓度c(N2):c(H2):c (NH3)=1:3:2
②P1_____P2 (填“>” “<”“=”或“不确定”,下同);反应的平衡常数:C点______B点_______D点。
③C点 的转化率为________;在A、B两点条件下,该反应从开始到平衡时生成氮气的平均速率:υ(A)__________υ(B)。
的转化率为________;在A、B两点条件下,该反应从开始到平衡时生成氮气的平均速率:υ(A)__________υ(B)。
Ⅱ.用间接电化学法去除烟气中NO的原理如下图所示。
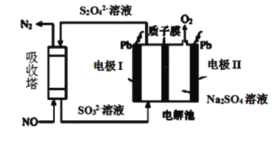
(3)已知阴极室溶液呈酸性,则阴极的电极反应式为_____________。反应过程中通过质子交换膜(ab)的 为2mol时,吸收柱中生成的气体在标准状况下的体积为_____________L。
为2mol时,吸收柱中生成的气体在标准状况下的体积为_____________L。
-
研究CO2与CH4的反应使之转化为H2和CO对减缓燃料危机,减少温室效应具有重大意义。已知CH4(g)+CO2(g)→2H2(g)+2CO(g)。
(1)该反应的平衡常数K=__。在2L密闭容器中,通入CO2和CH4的混合气体,30min后CH4的质量减少了4.8g,则v(CH4)__。
(2)根据如图可得出n(CO2)消耗__n(CH4)消耗(填“>”、“<”和“=”,原因是___。

-
研究氮及其化合物的性质,可以有效改善人类的生存环境。氮元素化合价——物质类别关系图如下。
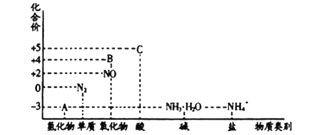
回答下列问题:
(1)在催化剂和加热的条件下,物质A生成NO是工业制硝酸的重要反应,化学方程式是:__________
(2)在加热条件下,物质C的浓溶液与碳单质反应,写出反应的化学方程式: _______________;
(3)实验室中,检验溶液中含有NH4+的操作方法是: __________________________;
(4)物质B为红棕色气体,写出该物质与水反应的离子方程式_____________,当反应消耗3.36L (标准状况) 物质B时,转移电子的物质的量为__________________________。
(5)将32g铜与140 mL一定浓度的C溶液反应,铜完全溶解产生的气体在标准状况下的体积为11.2L。
①参加反应的C的物质的量为__________________________;
②待产生的气体全部释放后,向溶液中加入VmLamol·L-1 的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原C溶液的浓度为________ mol·L-1
③欲使铜与C反应生成的气体在NaOH溶液中全部转化为NaNO3,至少需要通入O2_____mol。
-
研究氮及其化合物的性质,可以有效改善人类的生存环境。氮元素化合价—物质类别关系图如下。
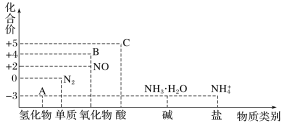
回答下列问题:
(1)在催化剂和加热的条件下,物质A生成NO是工业制硝酸的重要反应,化学方程式是_______。
(2)在加热条件下,物质C的浓溶液与碳单质反应,写出反应的化学方程式:_______。
(3)实验室中,检验溶液中含有NH4+的操作方法是_________。
(4)物质B为红棕色气体,写出该物质与水反应的离子方程式:__________,当反应消耗3.36L(标准状况)物质B时,转移电子的物质的量为________mol。
(5)写出一种人工固氮的化学反应原理_______。
(6)Cu与一定浓度的硝酸溶液反应生成NO时的离子反应方程式为_________。
-
研究氮及其化合物的性质具有极为重要的意义。
(1) NOx能形成酸雨,写出NO2转化为HNO3的化学方程式:_____________________________
(2)在含Cu+离子的酶的活化中,亚硝酸根 (NO2-)离子可转化为NO,写出Cu+和亚硝酸根离子在酸性水溶液中反应的离子方程式 。
(3)将38.4 g铜与150mL一定浓度的硝酸反应,铜完全溶解,产生的NO和NO2混合气体在标准状况下的体积为11.2L,请回答:
① NO2的体积为____________L。
②若铜与硝酸刚好反应完全,则原硝酸溶液的浓度为____________mol•L-1。
-
研究氮及其化合物的性质具有极为重要的意义。
(1) NOx能形成酸雨,写出NO2转化为HNO3的化学方程式:_____________________________
(2)在含Cu+离子的酶的活化中,亚硝酸根 (NO2-)离子可转化为NO,写出Cu+和亚硝酸根离子在酸性水溶液中反应的离子方程式 。
(3)将38.4 g铜与150mL一定浓度的硝酸反应,铜完全溶解,产生的NO和NO2混合气体在标准状况下的体积为11.2L,请回答:
① NO2的体积为____________L。
②若铜与硝酸刚好反应完全,则原硝酸溶液的浓度为____________mol•L-1。
-
CH4(其中C为-4价)既是一种重要的能源,也是一种重要的化工原料。
(1)已知8.0gCH4完全燃烧生成二氧化碳和液态水时放出444.8kJ热量。若一定量的甲烷完全燃烧生成二氧化碳和液态水时放出1334.4kJ的热量,则需要标准状况下的氧气约___L。
(2)以CH4为燃料可设计成结构简单、能量转化率高、对环境无污染的燃料电池,其工作原理如图甲所示,通入2.24L(已换算为标准状况)a气体时,通过质子交换膜转移的H+数目为___(设NA为阿伏加德罗常数的值)。
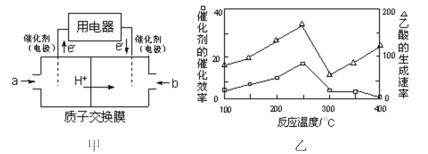
(3)在一定温度和催化剂作用下,CH4与CO2可直接转化成乙酸,这是实现“减排”的一种研究方向。
①在不同温度下,催化剂的催化效率与乙酸的生成速率如图乙所示,则该反应的最佳温度应控制在___℃左右。
②该反应催化剂的有效成分为偏铝酸亚铜(CuAlO2,难溶物)。将CuAlO2溶解在稀硝酸中生成两种盐并放出NO气体,其反应的离子方程式为___。
③CH4还原法是处理NOx气体的一种方法。已知一定条件下CH4与NOx反应转化为N2、CO2和H2O,若标准状况下8.96LCH4可处理22.4LNOx,则x值为___。
-
(13分)研究工业废弃物的处理和防治具有重要的意义。
(1)利用反应CH4+2NO2  N2+CO2+2H2O可消除NO2的污染,该反应中氧化剂是____,当消耗CH4的体积是11.2 L(标准状况下)时,理论上可处理____molNO2 。
N2+CO2+2H2O可消除NO2的污染,该反应中氧化剂是____,当消耗CH4的体积是11.2 L(标准状况下)时,理论上可处理____molNO2 。
(2)治理汽车尾气中CO和NO的一种方法是:在汽车排气管中安装一个催化转化装置,该装置能将CO和NO转化为参与大气循环的无毒气体。该反应的化学方程式为________________.
(3)某无色废水中可能含有Fe3+、Al3+、Na+、Cl-、OH-、SO42-、中的几种离子。分别取三份废水进行如下实验:
I.进行焰色反应实验,火焰为无色。
Ⅱ.取100 mL废水,加入足量的BaCl2溶液,生成2.33g白色沉淀。
Ⅲ.取100 mL废水,逐滴加入1.0 mol 的NaOH溶液,消耗NaOH溶液的体积与生成沉淀的质量如下图所示。
的NaOH溶液,消耗NaOH溶液的体积与生成沉淀的质量如下图所示。
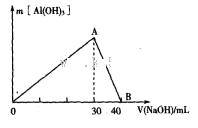
请根据上述信息回答下列问题:、
①该废水中一定不含有的离子是__________.
②实验中需配制1.0 mol 的NaOH溶液100 mL,所需仪器除了玻璃棒、托盘天平、量筒、药匙、烧杯、胶头滴管,还缺少的仪器有_______。
的NaOH溶液100 mL,所需仪器除了玻璃棒、托盘天平、量筒、药匙、烧杯、胶头滴管,还缺少的仪器有_______。
③写出图中A→B反应的离子方程式:_______________________。
④通过计算,该废水中______Cl-(填“含有”或“不含有”);若含有,则c(Cl-)=________(若不含有,此问不必作答)。
-
研究工业废弃物的处理和防治具有重要的意义。
(1)利用反应CH4+2NO2 N2+CO2+2H2O可消除NO2的污染,该反应中氧化剂是________,当消耗CH4的体积是11.2 L(标准状况下)时,理论上可处理________g NO2。
N2+CO2+2H2O可消除NO2的污染,该反应中氧化剂是________,当消耗CH4的体积是11.2 L(标准状况下)时,理论上可处理________g NO2。
(2)治理汽车尾气中CO和NO的一种方法是:在汽车排气管中安装一个催化转化装置,该装置能将CO和NO转化为参与大气循环的无毒气体。该反应的化学方程式为___________。
(3)有一瓶溶液,其中可能含有H+、NH 、K+、Na+、Mg2+、Ba2+、Fe3+、SO
、K+、Na+、Mg2+、Ba2+、Fe3+、SO 、CO
、CO 、Cl―和I―。取该溶液进行以下实验:
、Cl―和I―。取该溶液进行以下实验:
① 用pH试纸检验,表明溶液呈强酸性;
② 取部分溶液,加入数滴氯水及2 mL CCl4,经振荡后CCl4层呈紫红色;
③ 另取部分溶液,加入NaOH溶液使其变为碱性,无沉淀生成;
④ 取部分上述碱性溶液,加Na2CO3溶液,有白色沉淀生成;
⑤ 将③得到的碱性溶液加热,有气体放出,该气体能使湿润的红色石蕊试纸变蓝。
根据上述实验事实,可知该溶液中肯定含有的离子是______________;肯定没有的离子是________________;还不能确定是否含有的离子是________________。
 的废水,工作原理如图所示。
的废水,工作原理如图所示。
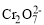 +___Fe2++___=____Cr3++___Fe3++____。
+___Fe2++___=____Cr3++___Fe3++____。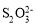 =2I-+
=2I-+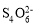 ),判断达到滴定终点的现象是_________。若实验中平均消耗Na2S2O3标准溶液25.00mL,则重铬酸钠的纯度为________(设整个过程中其他杂质不参与反应)
),判断达到滴定终点的现象是_________。若实验中平均消耗Na2S2O3标准溶液25.00mL,则重铬酸钠的纯度为________(设整个过程中其他杂质不参与反应)





