-
将浓度均为0.01 mol/L 的H2O2、H2SO4、KI、Na2S2O3溶液及淀粉混合,一定时间后溶液变为蓝色。该实验是一种“碘钟实验”。某小组同学在室温下对该“碘钟实验”的原理进行探究。
(资料)
该“碘钟实验”的总反应:H2O2 +2S2O32-+2H+=S4O62-+2H2O
反应分两步进行:
反应A:H2O2+2I-+2H+=I2+2H2O
反应B:……
(1)反应B的离子方程式是______。对于总反应,I-的作用相当于______。
(2)为证明反应A、B的存在,进行实验Ⅰ。
a.向酸化的H2O2溶液中加入试剂X的水溶液,溶液变为蓝色。
b.再向得到的蓝色溶液中加入Na2S2O3溶液,溶液的蓝色褪去。
试剂X是______。
(3)为探究溶液变蓝快慢的影响因素,进行实验Ⅱ、实验Ⅲ。(溶液浓度均为0.01 mol/L)
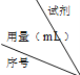
| 试剂 序号 用量(mL) | H2O2 溶液 | H2SO4 溶液 | Na2S2O3 溶液 | KI溶液 (含淀粉) | H2O |
| 实验Ⅱ | 5 | 4 | 8 | 3 | 0 |
| 实验Ⅲ | 5 | 2 | x | y | z |
溶液从混合时的无色变为蓝色的时间:实验Ⅱ是30 min、实验Ⅲ是40 min。
①实验Ⅲ中,x、y、z所对应的数值分别是______。
②对比实验Ⅱ、实验Ⅲ,可得出的实验结论是______。
(4)为探究其他因素对该“碘钟实验”的影响,进行实验Ⅳ。
(溶液浓度均为0.01 mol/L)
| 试剂 序号 用量(mL) | H2O2 溶液 | H2SO4 溶液 | Na2S2O3 溶液 | KI溶液(含淀粉) | H2O |
| 实验Ⅳ | 4 | 4 | 9 | 3 | 0 |
实验过程中,溶液始终无明显颜色变化。
试结合该“碘钟实验”总反应方程式及反应A与反应B速率的相对快慢关系,解释实验Ⅳ未产生颜色变化的原因:_____________________。
-
将浓度均为0.01 mol/L 的H2O2、H2SO4、KI、Na2S2O3溶液及淀粉混合,一定时间后溶液变为蓝色。该实验是一种“碘钟实验”。某小组同学在室温下对该“碘钟实验”的原理进行探究。
(资料)
该“碘钟实验”的总反应:H2O2 +2S2O32-+2H+=S4O62-+2H2O
反应分两步进行:
反应A:H2O2+2I-+2H+=I2+2H2O
反应B:……
(1)反应B的离子方程式是______。对于总反应,I-的作用相当于______。
(2)为证明反应A、B的存在,进行实验Ⅰ。
a.向酸化的H2O2溶液中加入试剂X的水溶液,溶液变为蓝色。
b.再向得到的蓝色溶液中加入Na2S2O3溶液,溶液的蓝色褪去。
试剂X是______。
(3)为探究溶液变蓝快慢的影响因素,进行实验Ⅱ、实验Ⅲ。(溶液浓度均为0.01 mol/L)
| 试剂 序号 用量(mL) | H2O2 溶液 | H2SO4 溶液 | Na2S2O3 溶液 | KI溶液 (含淀粉) | H2O |
| 实验Ⅱ | 5 | 4 | 8 | 3 | 0 |
| 实验Ⅲ | 5 | 2 | x | y | z |
溶液从混合时的无色变为蓝色的时间:实验Ⅱ是30 min、实验Ⅲ是40 min。
①实验Ⅲ中,x、y、z所对应的数值分别是______。
②对比实验Ⅱ、实验Ⅲ,可得出的实验结论是______。
(4)为探究其他因素对该“碘钟实验”的影响,进行实验Ⅳ。
(溶液浓度均为0.01 mol/L)
| 试剂 序号 用量(mL) | H2O2 溶液 | H2SO4 溶液 | Na2S2O3 溶液 | KI溶液(含淀粉) | H2O |
| 实验Ⅳ | 4 | 4 | 9 | 3 | 0 |
实验过程中,溶液始终无明显颜色变化。
试结合该“碘钟实验”总反应方程式及反应A与反应B速率的相对快慢关系,解释实验Ⅳ未产生颜色变化的原因:_____________________。
-
将浓度均为0.01 mol/L的H2O2、H2SO4、KI、Na2S2O3溶液及淀粉混合,一定时间后溶液变为蓝色。该实验是一种“碘钟实验”。某小组同学在室温下对该“碘钟实验”的原理进行探究。
(资料)该“碘钟实验”的总反应:H2O2+2S2O32-+2H+=S4O62-+2H2O
反应分两步进行:
反应A:H2O2+2I-+2H+=I2+2H2O
反应B:……
(1)反应B的离子方程式是______。对于总反应,I-的作用相当于_____。
(2)为证明反应A、B的存在,进行实验Ⅰ。
A.向酸化的H2O2溶液中加入试剂X的水溶液,溶液变为蓝色
B.再向得到的蓝色溶液中加入Na2S2O3溶液,溶液的蓝色褪去。
试剂X是_____。
(3)为探究溶液变蓝快慢的影响因素,进行实验Ⅱ、实验Ⅲ。(溶液浓度均为0.01 mol/L)
| 用量(mL) 试剂序号 | H2O2溶液 | H2SO4溶液 | Na2S2O3溶液 | KI溶液(含淀粉) | H2O |
| 实验Ⅱ | 5 | 4 | 8 | 3 | 0 |
| 实验Ⅲ | 5 | 2 | x | y | z |
溶液从混合时的无色变为蓝色的时间:实验Ⅱ是30 min、实验Ⅲ是40 min。
①实验Ⅲ中,x、y、z所对应的数值分别是_____、_____、_____。
②对比实验Ⅱ、实验Ⅲ,可得出的实验结论是_____。
(4)为探究其他因素对该“碘钟实验”的影响,进行实验Ⅳ。(溶液浓度均为0.01 mol/L)
| 用量(mL) 试剂序号 | H2O2溶液 | H2SO4溶液 | Na2S2O3溶液 | KI溶液(含淀粉) | H2O |
| 实验Ⅳ | 4 | 4 | 9 | 3 | 0 |
实验过程中,溶液始终无明显颜色变化。
试结合该“碘钟实验”总反应方程式及反应A与反应B速率的相对快慢关系,解释实验Ⅳ未产生颜色变化的原因:______。
-
相同条件下,0.1mol/L Na2S2O3溶液和0.1mol/L H2SO4溶液各5mL,与10mL水混合,反应时间为t1 s;0.2mol/L Na2S2O3溶液和0.2mol/L H2SO4溶液各5mL,与30mL水混合,反应时间为t2 s,则t1和t2的关系是(忽略体积变化)
A. t1>t2 B. t1<t2 C. t1=t2 D.不能肯定
-
相同条件下,0.1mol/L Na2S2O3溶液和0.1mol/L H2SO4溶液各5mL,与10mL水混合,反应时间为t1 s;0.2mol/L Na2S2O3溶液和0.2mol/L H2SO4溶液各5mL,与30mL水混合,反应时间为t2 s,则t1和t2的关系是(忽略体积变化)
A.t1>t2 B.t1<t2 C.t1=t2 D.不能肯定
-
某小组同学进行如下实验:
①向10mL 1mol/LKBr溶液中通入一定量氯气,溶液变为黄色,将溶液分为两等份;
②往第一分溶液中加入淀粉碘化钾溶液,溶液变为蓝色;
③向第二份溶液中继续通入氯气,溶液由黄色变为橙色。下列分析不正确的是
A. 实验①溶液中发生反应的离子方程式是: Cl2+2Br-=Br2+2Cl-
B. 仅根据实验②能说明氧化性: Br2>I2
C. 向实验③所得溶液中加苯,充分振荡,上层为橙红色
D. 上述实验验证了Cl2、Br2、I2的氧化性相对强弱
-
取浓度相等的NaOH和H2SO4溶液,以4∶1体积比相混合,所得溶液中的c(OH-)为0.01 mol/L,则原溶液的浓度为
A. 0.01 mol/L B. 0.017 mol/L C. 0.025 mol/L D. 0.50 mol/L
-
取物质的量浓度相等的NaOH和H2SO4溶液,以4:1体积比相混合,所得溶液中的c(OH-)为0.01mol/L,则原溶液的浓度为( )
A.0.01 mol/L
B.0.017 mol/L
C.0.025 mol/L
D.0.250 mol/L
-
取物质的量浓度相等的NaOH和H2SO4溶液,以体积比4∶1相混合,所得溶液中的c(OH-)为0.01 mol/L,则原溶液的浓度为
A.0.01 mol/L B.0.017 mol/L C.0.025 mol/L D.0.250 mol/L
-
现有H2SO4和Na2SO4的混合溶液200mL,其中H2SO4的浓度为1 mol•L-1,Na2SO4的浓度为0.5 mol•L-1。若使该混合溶液中H2SO4和Na2SO4的浓度分别变为2 mol•L-1和0.2 mol·L-1,应加入55.8%的H2SO4溶液(密度为1.35 g/cm3)多少毫升?加水至多少毫升?