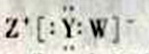-
X、Y、Z、W是原子序数依次增大的短周期主族元素,其原子半径依X、Z、Y、W的顺序增大。已知Y的气态氢化物水溶液显碱性、Z是地壳中含量最高的元素,W的原子半径在同周期中最小(稀有气体除外)。下列说法正确的是( )
A. 的酸性强于
的酸性强于 ,所以W的非金属性比Y强
,所以W的非金属性比Y强
B.X、Y分别与Z按原子个数比2∶1形成的化合物都是弱电解质
C.由Y和Z元素形成的氧化物最多可有5种
D.由X、Y、Z元素组成的化合物均为共价化合物
-
W、X、Y、Z均为短周期主族元素,且原子序数依次增大。已知W元素的原子形成的离子是一个质子;X、Y在元素周期表中处于相邻的位置,它们的单质在常温下均为无色气体;Z为同周期中原子半径最大的元素。下列有关说法正确的是
A. 四种元素均为非金属元素
B. W与X、Y形成的最简单分子的沸点:X>Y
C. Y、Z形成的化合物中只含离子键
D. W、Y、Z形成的化合物的电子式为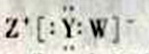
-
已知G、W、D、E、X、Y、Z是七种短周期主族元素.G是所有元素中原子半径最小的元素,元素W与元素Y位于同一主族.X、W、E三元素位于同一周期,且原子序数依次增大.D、W在周期表中的位置如表格所示.请回答下列问题.
(1)①化合物DY2 和 DW2 的分子空间构型相似,DW2的结构式为______.
②已知元素W和E的最外层电子数之和与Y和X的最外层电子数之和相差6,都由G、W、X、Y四种元素形成的两种化合物能发生反应的离子方程式为______.
③已知aX、bY、cZ三种元素,a+b+c=26,Z的最高价氧化物的水化物与其氢化物反应生成的化合物水溶液的PH______7(填“大于”、“等于”、或“小于”);如果给溶液加热,溶液的PH______(填“增大”、“等于”、或“减小”);其变化的原因是______.
(2)化合物XZ3是合成抗禽流感药物“达菲”的中间活性物质,XZ3 受撞击会生成一种非金属单质和一种离子化合物X3Z,请写出该反应的化学方程式______.若反应生成标准状况下3.36L气体单质,则电子转移的物质的量为______.
(3)化合物A、B均由上述G、W、E、X、Y五种元素中的任意三种元素组成的强电解质,且两种物质水溶液的酸碱性相同,组成元素的原子数目之比均为1:1:1,若A能抑制水的电离,B能促进水的电离,则化合物A的化学式为______,B的化学式为______.
-
已知A、B、C、D、E、F为周期表前四周期原子序数依次增大的六种元素。其中A是元素周期表中原子半径最小的元素,B原子最外层电子数是内层电子数的2倍。D、E为同主族元素,且E的原子序数为D的2倍。F元素在地壳中含量位于金属元素的第二位。试回答下列问题:
(1)F元素价层电子排布式为___________________。
(2)关于B2A2的下列说法中正确的是 ________________。
A.B2A2中的所有原子都满足8电子结构
B.每个B2A2分子中σ键和π键数目比为1∶1
C.B2A2是由极性键和非极性键形成的非极性分子
D.B2A2分子中的B-A键属于s—spσ键
(3) B和D形成的一种三原子分子与C和D形成的一种化合物互为等电子体,则满足上述条件的B和D形成的化合物的空间构型是________________。
(4) C元素原子的第一电离能比B、D两元素原子的第一电离能高的主要原因__________。
(5) A与D可以形成原子个数比分别为2∶1,1∶1的两种化合物X和Y,其中 Y含有____________键(填“极性键”“非极性键”),A与C组成的两种化合物M和N所含的电子数分别与X、Y相 等,N的 结构式为________。
(6) E的氢化物的价层电子对互斥理论模型为________,E 原子的杂化方式为________杂化。
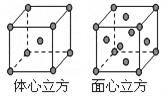
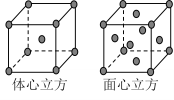
(7) F单质的晶体在不同温度下有两种堆积方式,晶胞分别如右图所示。面心立方晶胞和体心立方晶胞的棱边长分别为acm、bcm,则F单质的面心立方晶胞和体心立方晶胞的密度之比为_________,F原子配位数之比为__________________。
-
已知A、B、C、D、E、F为周期表前四周期原子序数依次增大的六种元素。其中A是元素周期表中原子半径最小的元素,B原子最外层电子数是内层电子数的2倍。D、E为同主族元素,且E的原子序数是D的2倍。F元素在地壳中含量位于金属元素的第二位。回答下列问题:
(1)F元素价层电子排布式为 。
(2)关于B2A2的下列说法中正确的是
A.B2A2 中的所有原子都满足8电子结构
B.每个B2A2分子中  键和
键和 键数目比为1:1
键数目比为1:1
C.B2A2 是由极性键和非极性键形成的非极性分子
D.B2A2分子中的A—B键属于 —
— 键
键
(3)B和D形成的一种三原子分子与C和D形成的一种化合物互为等电子体,则满足上述条件的B和D形成的化合物的结构式为
(4)C元素原子的第一电离能比B、D两元素原子的第一电离能都高的主要原因是
(5)D的氢化物比E的氢化物沸点高,其主要原因是 ;E的氢化物的价层电子对互斥模型为 ,E原子的杂化方式为 。
(6)F单质的晶体在不同温度下有两种堆积方式,即面心立方堆积和体心立方堆积,其晶胞的棱边长分别为a cm、b cm,则F单质的这两种晶体密度之比为 ,F原子的配位数之比为 。
-
已知A、B、C、D、E、F为周期表前四周期原子序数依次增大的六种元素。其中A是元素周期表中原子半径最小的元素,B原子最外层电子数是内层电子数的2倍。D、E为同主族元素,且E的原子序数为D的2倍。F元素在地壳中含量位于金属元素的第二位。试回答下列问题:
(1)F元素价层电子排布式为 _______________。
(2)关于B2A2的下列说法中正确的是 _________________。
A. B2A2中的所有原子都满足8电子结构
B. 每个B2A2分子中σ键和π键数目比为1:1
C. B2A2是由极性键和非极性键形成的非极性分子
D. B2A2分子中的B-A键属于s —spσ键
(3)B和D形成的一种三原子分子与C和D形成的一种化合物互为等电子体,则满足上述条件的B和D形成的化合物的空间构型是 ___________________。
(4)C元素原子的第一电离能比B、D两元素原子的第一电离能高的主要原因 _____________________________。
(5)A与D可以形成原子个数比分别为2:1,1:1的两种化合物X和Y,其中 Y含有__________键(填“极性键”“非极性键”),A与C组成的两种化合物M和N所含的电子数分别与X、Y相等, N的结构式为__________。
(6)E的氢化物的价层电子对互斥理论模型为 _______,E 原子的杂化方式为 ________杂化。
(7)F单质的晶体在不同温度下有两种堆积方式,晶胞分别如右图所示。面心立方晶胞和体心立方晶胞的棱边长分别为acm、bcm,则F单质的面心立方晶胞和体心立方晶胞的密度之比为____________,F原子配位数之比为__________________。
-
已知X、Y、Z、W、K五种元素均位于周期表的前四周期,且原子序数依次增大。元素X是周期表中原子半径最小的元素;Y的基态原子中电子占据了三种能量不同的原子轨道,且这三种轨道中的电子数相同;W位于第2周期,其原子的核外成对电子数是未成对电子数的3倍;K位于ds区且原子的最外层电子数与X的相同。
请回答下列问题:(答题时,X、Y、Z、W、K用所对应的元素符号表示)
(1)Y、Z、W元素的第一电离能由大到小的顺序是 。
(2)K的电子排布式是 。
(3)Y、Z元素的某些氢化物的分子中均含有18个电子,则Y的这种氢化物的化学式是 ;Y、Z的这些氢化物的沸点相差较大的主要原因是
(4)若X、Y、W形成的某化合物(相对分子质量为46)呈酸性,则该化合物分子中Y原子轨道的杂化类型是 ;1 mol该分子中含有 σ键的数目是 。
(5)Z、K两元素形成的某化合物的晶胞结构如图所示,则该化合物的化学式是 ,Z原子的配位数是 。
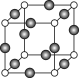
-
已知X、Y、Z、W、K五种元素均位于周期表的前四周期,且原子序数依次增大。元素X是周期表中原子半径最小的元素;Y的基态原子中电子占据了三种能量不同的原子轨道,且这三种轨道中的电子数相同;W位于第2周期,其原子的核外成对电子数是未成对电子数的3倍;K位于ds区且原子的最外层电子数与X的相同。
请回答下列问题:(答题时,X、Y、Z、W、K用所对应的元素符号表示)
⑴Y、Z、W元素的第一电离能由大到小的顺序是 。
⑵K的二价离子电子排布式是 。
⑶Y、Z元素的某些氢化物的分子中均含有18个电子,则Y的这种氢化物的化学式是 ;Y、Z的这些氢化物的沸点相差较大的主要原因是 。
⑷若X、Y、W形成的某化合物(相对分子质量为46)呈酸性,则该化合物分子中Y原子轨道的杂化类型是 ;1 mol该分子中含有 σ键的数目是 。
⑸Z、K两元素形成的某化合物的晶胞结构如图所示,则该化合物的化学式是 ,Z原子的配位数是 。
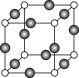
-
(16分)已知A、B、C、D、E、F、G和H都是元素周期表中前36号的元素,它们的原子序数依次增大。A是周期表中原子半径最小的元素,B原子最外层电子数是内层电子数的两倍,C的基态原子核外有7种不同运动状态的电子,E是电负性最大的元素,F的氢化物和最高价氧化物对应的水化物均为强酸,G、H分别是周期表中1—18纵列中的第10、12纵列元素。请回答下列问题:
(1)D元素在周期表位置是 ,G的核外价层电子排布式为 。
(2)E与A形成的化合物比F与A形成的化合物的沸点 (填“高”或“低”),其原因是 。
(3)B、C原子的第一电离能较大的是 (填元素符号),其原因是 。
(4)BD32-离子中B原子采取 杂化,任写一种与BD互为等电子体的分子的电子式 。
(5)元素H的一种硫化物晶体的晶胞结构如图所示,该硫化物的化学式是 。元素H的氢氧化物可溶于氨水中,生成和铜氨配离子相同配位数的离子,写出该反应的离子方程式为 。
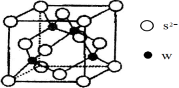
-
已知A、B、C、D、E是短周期中原子序数依次增大的五种元素,A原子在元素周期表中原子半径最小;B与E同主族,且E的原子序数是B的两倍;C、D是金属元素,它们的氢氧化物相互之间可以发生反应。下列说法不正确的是( )
A.单质D可用于冶炼某些难熔金属
B.工业上常用电解法制得C和D的单质
C.稳定性:A2B>A2E
D.简单离子的半径:C>D>E>B