-
工业合成氨的反应如下:3H2+N2 2NH3。某温度下,在容积恒定为2.0 L的密闭容器中充入2.0 mol N2和2.0 mol H2,一段时间后反应达平衡状态,实验数据如下表所示:
2NH3。某温度下,在容积恒定为2.0 L的密闭容器中充入2.0 mol N2和2.0 mol H2,一段时间后反应达平衡状态,实验数据如下表所示:
| t/s | 0 | 50 | 150 | 250 | 350 |
| n(NH3)/mol | 0 | 0.24 | 0.36 | 0.40 | 0.40 |
(1)0~50 s内的平均反应速率 v(N2)=_______________。
(2)250 s时,H2的转化率为_______________。
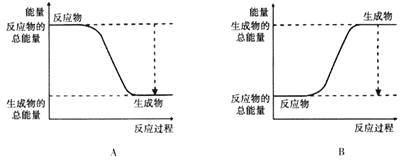
(3)已知N≡N的键能为946 kJ·mol-1,H-H的键能为436 kJ·mol-1,N-H的键能为391 kJ·mol-1,则生成1 mol NH3过程中的热量变化为_______kJ。下图能正确表示该反应中能量变化的是_____(填字母)。
A B
(4)为加快反应速率,可以采取的措施______________。
a.降低温度 b.增大压强 c.恒容时充入He气
d.恒压时充入He气 e.及时分离出NH3
(5)下列说法错误的是____________。
a.使用催化剂是为了加快反应速率,提高生产效率
b.上述条件下,N2不可能100%转化为NH3
c.在一定条件下,合成氨反应有一定的限度
d.250~350 s时,生成物浓度保持不变,反应停止
-
工业合成氨的反应如下:N2 + 3H2  2NH3。
2NH3。
某温度下,在容积恒定为2.0L的密闭容器中充入2.0molN2和2.0molH2,一段时间后反应达平衡状态,实验数据如下表所示:
| t/s | 0 | 50 | 150 | 250 | 350 |
| n(NH3) | 0 | 0.24 | 0.36 | 0.40 | 0.40 |
(1)0~50s内的平均反应速率 v(N2) = 。
(2)250s时,H2的转化率为 。
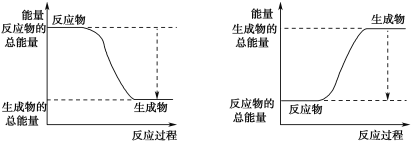
(3)已知 的键能为946kJ/mol,H-H的键能为436kJ/mol,N-H的键能为391kJ/mol,则生成1molNH3过程中的热量变化 kJ。下图能正确表示该反应中能量变化的是________。
的键能为946kJ/mol,H-H的键能为436kJ/mol,N-H的键能为391kJ/mol,则生成1molNH3过程中的热量变化 kJ。下图能正确表示该反应中能量变化的是________。
(4)为加快反应速率,可以采取的措施
a.降低温度
b.增大压强
c.恒容时充入He气
d.恒压时充入He气
e.及时分离NH3
(5)下列说法错误的是
A.使用催化剂是为了加快反应速率,提高生产效率
B.上述条件下,N2不可能100%转化为NH3
C.为了提高N2的转化率,应适当提高H2的浓度
D.250~350s生成物浓度保持不变,反应停止
-
工业合成氨的反应为N2(g)+3H2(g) 2NH3(g)。设在容积为2.0L的密闭容器中充入0.60molN2(g)和1.60 mol H2(g),2min在某温度下达到平衡,此时NH3的物质的量分数(NH3的物质的量与反应体系中总的物质的量之比)为4/7。请计算(写出计算过程):
2NH3(g)。设在容积为2.0L的密闭容器中充入0.60molN2(g)和1.60 mol H2(g),2min在某温度下达到平衡,此时NH3的物质的量分数(NH3的物质的量与反应体系中总的物质的量之比)为4/7。请计算(写出计算过程):
(1)2min内N2的平均速率;
(2)该条件下此反应的平衡常数K。
-
工业合成氨的反应为N2(g)+3H2(g) 2NH3(g)。设在容积为2.0L的密闭容器中充入0.60molN2(g)和1.60 mol H2(g),2min在某温度下达到平衡,此时NH3的物质的量分数(NH3的物质的量与反应体系中总的物质的量之比)为4/7。请计算(写出计算过程):
2NH3(g)。设在容积为2.0L的密闭容器中充入0.60molN2(g)和1.60 mol H2(g),2min在某温度下达到平衡,此时NH3的物质的量分数(NH3的物质的量与反应体系中总的物质的量之比)为4/7。请计算(写出计算过程):
(1)2min内N2的平均速率;
(2)该条件下此反应的平衡常数K。
-
下图是198 K时N2与H2反应过程中能量变化的曲线图。下列叙述正确的是
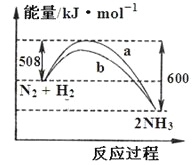
A.该反应的热化学方程式为:N2+ 3H2 2NH3△H =-92 kJ·mol-1
2NH3△H =-92 kJ·mol-1
B.向一密闭容器中加入1 molN2和3 molH2充分反应后,放出92 kJ热量
C.b曲线可能是加入催化剂时的能量变化曲线
D.加入正催化剂可增大正反应速率,降低逆反应速率
-
合成氨是重要的化学工业,为了研究合成氨的反应原理,在一密闭容器内充入1 mol N2和2 mol H2,在一定条件下,使之发生如下反应:N2+3H2  2NH3 。
2NH3 。
Ⅰ:若维持温度不变,且密闭容器的容积固定为1 L。
(1) 当此反应经过2 min达到平衡状态时,测得反应混合物中NH3的物质的量为0.2 moL,则H2在2 min内的平均反应速率为__________________。
(2)如果开始时,向该容器内加入0.5 moL N2 ,要使反应混合物中三种气体的物质的量分数仍与上述平衡时的完全相同,则还必须加入H2 _______mol和NH3 _______mol。
(3)如果开始时加入N2、H2、NH3的物质的量分别为a mol 、b mol 、c mol ,要使反应达到平衡状态时,反应混合物中三种气体的物质的量分数仍与(1)平衡时完全相同,则a、b、c应满足的一般条件是(a、b分别用含c的方程式表示)________ 。
Ⅱ:若温度维持不变,体系压强维持与Ⅰ相同,密闭容器的容积由1 L随反应进行而改变。
(4)开始时加入1 mol N2和2 mol H2,经过一段时间,容器中三种气体的物质的量分数不再发生变化时,则NH3的物质的量为__________(选填一个编号)
(甲)大于0.2 mol (乙)等于0.2 mol
(丙)小于0.2 mol (丁)可能大于、等于或小于0.2mol
作出此判断的理由是__________________________________________。
-
(10分每空2分)室温下,在一个容积为1L的密闭容器中,充入1molN2和3molH2,发生如下反应:N2+3H2 2NH3,5min后到达平衡,平衡后混合气体的压强为起始压强的3\4,此时放出的热量为 42KJ,则:
2NH3,5min后到达平衡,平衡后混合气体的压强为起始压强的3\4,此时放出的热量为 42KJ,则:
(1)平衡时N2的物质的量为 mol
(2)5min内用H2表示的反应速率为 mol/(L.min)
(3)若向该1L密闭容器中再充入1molN2,则H2的转化率 (填变大、变小或不变)
(4)写出N2和H2反应生成NH3的热化学反应方程式:
(5)写出该反应的平衡常数的表达式:
-
(8分)工业合成氨的反应为N2(g)+3H2(g) 2NH3(g)。设在容积为2.0 L的密闭容器中充入0.60 mol N2(g)和1.60 mol H2(g),反应在一定条件下达到平衡时,NH3的物质的量分数(NH3的物质的量与反应体系中总的物质的量之比)为
2NH3(g)。设在容积为2.0 L的密闭容器中充入0.60 mol N2(g)和1.60 mol H2(g),反应在一定条件下达到平衡时,NH3的物质的量分数(NH3的物质的量与反应体系中总的物质的量之比)为 计算:
计算:
(1)该条件下N2的平衡转化率;(小数点后保留一位)
(2)该条件下反应2NH3(g) N2(g)+3H2(g)的平衡常数。(不带单位)
N2(g)+3H2(g)的平衡常数。(不带单位)
-
工业合成氨的反应为N2(g)+3H2(g) 2NH3(g)。设在容积为2.0 L的密闭容器中充入0.60 mol N2(g)和1.60 mol H2(g),反应在一定条件下达到平衡时,NH3的物质的量分数(NH3的物质的量与反应体系中总的物质的量之比)为
2NH3(g)。设在容积为2.0 L的密闭容器中充入0.60 mol N2(g)和1.60 mol H2(g),反应在一定条件下达到平衡时,NH3的物质的量分数(NH3的物质的量与反应体系中总的物质的量之比)为 计算:
计算:
(1)该条件下N2的平衡转化率;(小数点后保留一位)
(2)该条件下反应2NH3(g) N2(g)+3H2(g)的平衡常数。(不带单位)
N2(g)+3H2(g)的平衡常数。(不带单位)
-
已知一定温度下合成氨反应:N2 +3 H2 2 NH3 (每生成2 mol NH3放出92.4 kJ的热量),在恒温、恒压的密闭容器中进行如下实验:①通入1 mol N2和3 mol H2,达平衡时放出热量为Q1,②通入2 mol N2和6 mol H2,达平衡时放出热量为Q2,则下列关系正确的是 ( )
2 NH3 (每生成2 mol NH3放出92.4 kJ的热量),在恒温、恒压的密闭容器中进行如下实验:①通入1 mol N2和3 mol H2,达平衡时放出热量为Q1,②通入2 mol N2和6 mol H2,达平衡时放出热量为Q2,则下列关系正确的是 ( )
A.Q2 =2Q1 B.Q1 < 0.5 Q2 C.Q1 < Q2 < 184.8 kJ D.Q1 = Q2 < 92.4 kJ
 2NH3。
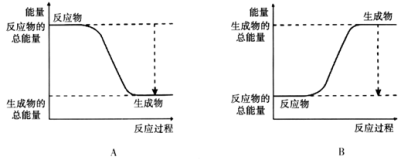
2NH3。 的键能为946kJ/mol,H-H的键能为436kJ/mol,N-H的键能为391kJ/mol,则生成1molNH3过程中的热量变化__________________kJ。下图能正确表示该反应中能量变化的是________。
的键能为946kJ/mol,H-H的键能为436kJ/mol,N-H的键能为391kJ/mol,则生成1molNH3过程中的热量变化__________________kJ。下图能正确表示该反应中能量变化的是________。