-
第四周期的铬、铁、镍、铜等金属及其化合物在工业上有重要用途。
(l)基态铬原子的价电子排布式为___________。
(2)CrO2C12和NaClO均可作化工生产的氧化剂或氯化剂。制备CrO2C12的反应为:
K2Cr2O7 + 3CCl4 = 2KCl+ 2 CrO2C12+ 3COCl2↑
① 上述反应式中非金属元素电负性由大到小的顺序是_______(用元素符号表示)。
② 常温下CrO2C12是一种易溶于CCl4的液体,则固态CrO2C12属于______晶体。
③ COCl2分子中所有原子均满足8电子结构,则COCl2分子中σ键和π键的个数比为____。
(3)NiO、FeO的晶体结构均与氯化钠的晶体结构相同,其中Ni2+和Fe2+的半径分别为6.9×10-2 nm 和7.8×10-2 nm,则熔点:NiO______(填“< ”、“= ”或“>” ) FeO。
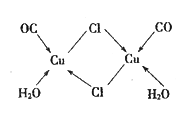
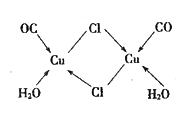
(4)CuCl的盐酸溶液能吸收CO生成复合物氯化羰基亚铜[Cu2Cl2(CO)2·2H2O] ,其结构如图所示。下列说法不正确的是_____(填字母序号)。
A.该复合物中只含有离子键和配位键
B.该复合物中Cl原子的杂化类型为sp3
C.该复合物中只有CO和H2O作为配位体
D.CO与N2的价电子总数相同,其结构为C≡O
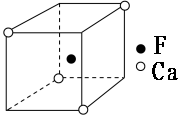
(5)Ca与F形成的晶体M的最小单元“晶胞”如下图所示,则M的化学式为______________;如果M晶体的密度为d g·cm-3,阿伏加德罗常数为NA,则晶体中两个距离最近的F中心间的距离为_____cm。
-
铬、铁、镍、铜等金属及其化合物在工业上有重要用途。
(l)基态铬原子的价电子排布式为___________。
(2)CrO2C12和NaClO均可作化工生产的氧化剂或氯化剂。制备CrO2C12的反应为:
K2Cr2O7 + 3CCl4 = 2KCl+ 2 CrO2C12+ 3COCl2↑
① 上述反应式中非金属元素电负性由大到小的顺序是_______(用元素符号表示)。
② 常温下CrO2C12是一种易溶于CCl4的液体,则固态CrO2C12属于______晶体。
③ COCl2分子中所有原子均满足8电子结构,则COCl2分子中σ键和π键的个数比为_______。
(3)NiO、FeO的晶体结构均与氯化钠的晶体结构相同,其中Ni2+和Fe2+的半径分别为6.9×10-2 nm 和7.8×10-2 nm,则熔点:NiO______(填“< ”、“= ”或“>” ) FeO。
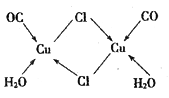
④CuCl的盐酸溶液能吸收CO生成复合物氯化羰基亚铜[Cu2Cl2(CO)2·2H2O] ,其结构如图所示。下列说法不正确的是_____(填字母序号)。
A.该复合物中只含有离子键和配位键 B.该复合物中Cl原子的杂化类型为sp3
C.该复合物中只有CO和H2O作为配位体 D.CO与N2的价电子总数相同,其结构为C≡O
-
钛、铬、铁、镍、铜等金属及其化合物在工业上有重要用途。
(1)Fe的基态原子共有________种不同能级的电子。
(2)制备CrO2Cl2的反应为K2Cr2O7+3CCl4===2KCl+2CrO2Cl2+3COCl2↑。
①已知:Cl元素在元素周期表中的位置可以描述为:第3行第17列,请用相同的形式描述Cr元素在元素周期表中的位置______________________。
②COCl2分子中所有原子均满足8电子构型,中心原子的杂化方式为________。COCl2分子中Cl—C—Cl之间的夹角______Cl—C—O之间的夹角(填“>”、“<”或“=”)。
(3)Ni和La的合金是目前使用广泛的储氢材料,具有大容量、高寿命、耐低温等特点,在日本和中国已实现了产业化。该合金的晶胞结构如图所示。
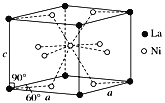
①该晶体的化学式为________________。
②已知该物质的摩尔质量为M g·mol-1,密度为d g·cm-3。设NA为阿伏加德罗常数的值,则该晶胞的体积是________nm3(用含M、d、NA的代数式表示)。
-
钛、铬、铁、镍、铜等金属及其化合物在工业上有重要用途。
(1)钛铁合金是钛系储氢合金的代表,该合金具有放氢温度低、价格适中等优点。
①Ti的基态原子价电子排布式为______________。
②Fe的基态原子共有_________种不同能级的电子。
(2)制备CrO2Cl2的反应为K2Cr2O7+3CCl4═2KCl+2CrO2Cl2+3COCl2↑。
①上述化学方程式中非金属元素电负性由大到小的顺序是_____(用元素符号表示)。
②COCl2分子中所有原子均满足8电子构型,COCl2分子中σ键和π键的个数比为_____,中心原子的杂化方式为_____________。
(3)NiO、FeO的晶体结构均与氯化钠的晶体结构相同,其中Ni2+和Fe2+的离子半径分别为6.9×10﹣2 nm和7.8×10﹣2 nm.则熔点:NiO________(填“>”、“<”或“=”)FeO。
(4)Ni和La的合金是目前使用广泛的储氢材料,具有大容量、高寿命、耐低温等特点,在日本和中国已实现了产业化。该合金的晶胞结构如图所示。
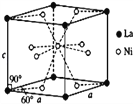
①该晶体的化学式为_____________。
②已知该晶胞的摩尔质量为M g•mol﹣1,密度为d g•cm﹣3.设NA为阿伏加德罗常数的值,则该晶胞的体积是_____ (用含M、d、NA的代数式表示)。
-
金属及其化合物在科学研究和工业生产中具有重要的用途。
(1)三氯化铁溶液用于检验食用香精乙酰乙酸乙酯时,会生成紫色配合物,其配离子结构如图所示:
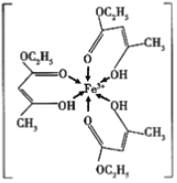
①此配合物中,铁离子价电子排布图为_____;
②此配离子中碳原子的杂化轨道类型为_____;
③此配离子中含有的化学键为_____。
A.离子键 B.金属键 C.极性键 D.非极性键 E.配位键 F.氢键 G.σ键 H.π键
(2)NO2-与钴盐形成的配离子[Co(NO2)6]3-可用于检验K+的存在。NO2-离子的VSEPR模型名称为_____,K3[Co(NO2)6]是黄色沉淀,该物质中四种元素的电负性由大到小的顺序是_____。
(3)研究物质磁性表明:金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5和CrO2,其中适合作录音带磁粉原料的是_____。
(4)锰的一种配合物的化学式为Mn(BH4)2(THF)3,写出两种与BH4-互为等电子体的微粒_____(请写一个分子和一个离子)。
(5)ZnS在荧光体、光导体材料、涂料、颜料等行业中应用广泛,立方ZnS晶体的结构如图所示,a的配位数为_____,已知晶胞密度为ρ g/cm3,则相邻2个b微粒之间的距离为_____nm(列计算式)。
-
(本题15分)铜是重要金属,Cu的化合物在科学研究和工业生产中具有许多用途.请回答以下问题:
(1)Cu+基态核外电子排布式为
(2)与OH-互为等电子体的一种分子为 (填化学式)。
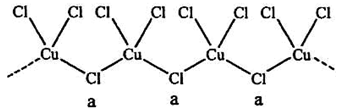
(3)氯和钾与不同价态的铜可生成两种化合物,其阴离子均为无限长链结构(如图),a位置上Cl原子的杂化轨道类型为__________。已知其中一种化合物的化学式为KCuCl3,另一种的化学式为___________;
(4)Cu2O的熔点比Cu2S的 (填“高”或“低”),请解释原因_________。
(5)一种铜金合金晶体具有面心立方最密堆积的结构,在晶胞中Cu原子处于面心,Au原子处于顶点位置,则该合金中Cu原子与Au原子数量之比为_______;该晶体中,原子之间的作用力是________;
(6)上述晶体具有储氢功能,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中。若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构为CaF2的结构相似,该晶体储氢后的化学式应为__________。
(7)将空气或氧气直接通入到铜粉与稀硫酸的混合物中,发现在常温下几乎不反应。向反应液中加少量FeSO4作催化剂,即发生反应,生成硫酸铜。其反应过程的第2步是:2Fe3++Cu===2Fe2++Cu2+,请写出其第l步反应的离子方程式__________________________________。
-
第VIII族元素单质及其化合物在工业生产和科研领域有重要的用途。
(1)过渡元素Co 基态原子价电子排布式为_____。第四电离能I4 (Co) < I4 (Fe) ,其原因是_________。
(2)Ni(CO)4 常用作制备高纯镍粉,其熔点为-19.3 ℃, 沸点为 43 ℃。则:
①Ni(CO)4的熔、沸点较低的原因为__________。
②写出一种与CO互为等电子体的分子的化学式__________。
③Ni(CO)4中σ键和π键的数目之比为__________。
(3)NiSO4 常用于电镀工业,其中 SO42-的中心原子的杂化轨道类型为_______,该离子中杂化轨道的作用是__________。
(4)氧化镍和氯化钠的晶体结构相同,可看成镍离子替换钠离子,氧离子替换氯离子。 则:
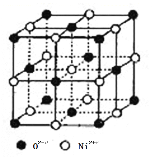
① 镍离子的配位数为__________。
② 若阿伏加德罗常数的值为NA,晶体密度为 ρ g·cm-3,则该晶胞中最近的 O2-之间的距离为__________pm(列出表达式)。
(5)某种磁性氮化铁的结构如图所示,Fe为__________堆积,则该化合物的化学式为__________。 其中铁原子最近的铁原子的个数为__________。

-
[化学-选修3:物质结构与性质]
铁铜是人类最早大规模使用的金属,它们的化合物在科学研究和工业生产中具有许多用途。请回答以下问题:
(1)铁元素在周期表中的位置是________,铜的基态原子核外电子排布式为__________,元素铁与铜的第二电离能分别为:ICu="1958" kJ·mol-1、IFe="1561" kJ·mol-1,ICu比IFe大得多的原因是_______。
(2)二茂铁[Fe(C5H5)2],橙色晶型固体,有类似樟脑的气味,抗磁性。熔点172.5~173℃,100℃以上升华,沸点249℃。据此判断二茂铁晶体类型为______________。
(3)蓝矾(CuSO4·5H2O)的结构如下图所示:
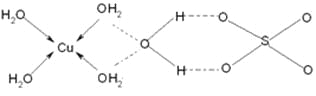
图中虚线表示_____________,SO42-的立体构型是__________,其中S原子的杂化轨道类型是___________;O原子的价电子排布图为__________________。
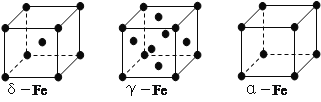
(4)铁有δ、γ、α三种同素异形体,下图是它们的晶体结构图,三种晶体中铁原子周围距离最近的铁原子个数之比为___________。
(5)某种具有储氢功能的铜合金晶体具有立方最密堆积的结构,晶胞中Cu原子处于面心,Au原子处于顶点位置,该晶体中原子之间的作用力是_______________。氢原子可进入到由Cu原子与Au原子构成的四面体空隙中。若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构与 CaF2的结构(晶胞结构如右图)相似,该晶体储氢后的化学式为______________。
-
(9分)硅是一种重要的非金属单质,硅及其化合物的用途非常广泛。根据所学知识回答硅及其化合物的相关问题。
(1)基态硅原子的核外电子排布式为________。
(2)晶体硅的微观结构与金刚石相似,晶体硅中Si-Si键之间的夹角大小约为______。
(3)下面关于SiO2晶体网状结构的叙述正确的是
A..最小的环上,有3个Si原子和3个O原子
B.最小的环上,有6个Si原子和6个O原子
C.存在四面体结构单元,O处于中心,Si处于4个顶角
(4)下表列有三种含硅物质(晶体)的熔点:
| 物质 | SiO2 | SiCl4 | SiF4 |
| 熔点/℃ | 1610 | -69 | -90 |
简要解释熔点差异的原因:
①SiO2和SiCl4:_________________________________________;
② SiCl4和SiF4:_________________________________________
(5)“神七”字航员所穿出仓航天服是由我国自行研制的新型“连续纤维增韧”航空材料做成,其主要成分是由一种由硅及其同主族相邻短周期元素形成的化合物和碳纤维等复合而成的,它是一种新型无机非金属材料。该化合物的化学式为:________。已知该化合物的硬度仅次于金刚石,熔点比SiO2高,该化合物晶体属于________晶体[填“分子”、“原子”或“离子”。
-
铝是当前应用最广泛的金属材料之一,铝制品及其化合物在日常生活和工农业生产中也有着重要的用途。回答下列问题:
(1)基态铝原子的核外电子排布式为____________。
(2)根据元素周期律等知识判断,第一电离能Al____________Mg(填写“大于”或“小于”)。
(3)Al2O3是常用的耐火材料,工业上也是用电解Al2O3方法制取金属Al,据此判断Al2O3的晶体类型是____________。
(4)LiAlH4是一种重要的有机合成试剂,AlH4-的立体构型为____________,LiAlH4中Al原子的杂化轨道类型为____________。
(5)金属铝的晶胞结构如图1所示,原子之间相对位置关系的平面图如图2所示。
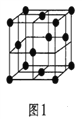
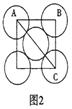
①晶体铝中原子的堆积方式为____________。
②已知铝原子半径为a cm,摩尔质量为Mg·mol-1,阿伏加德罗常数的值为NA,则晶体铝的密度ρ=_______g·cm-3(用含 a、M、NA的代数式来表示)。