-
已知邻苯二甲酸(H2A)的Kal=1.1×10-3,Ka2=3.9×10-6 常温下,用0.l0mol•L-1的NaOH溶液滴定20.0mL0.l0mol•L-1的邻苯二甲酸氢钾(KHA)溶液,溶液pH的变化曲线如图所示。下列叙述正确的是
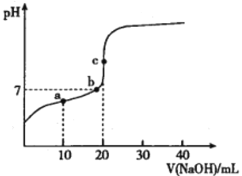
A.a点的混合溶液中:c(K+)>c(HA-)>c(Na+)>c(A2-)
B.b点的混合溶液中:c(Na+)=c(A2-)+c(H2A)
C.c点的混合溶液中:c(OH-)-c(H+)=c(HA-)+2c(H2A)
D.从a点到c点水的电离程度逐渐增大
-
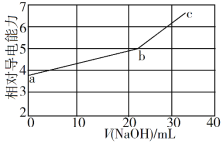
NaOH溶液滴定邻苯二甲酸氢钾(邻苯二甲酸H2A的Ka1=1.1×10−3 ,Ka2=3.9×10−6)溶液,混合溶液的相对导电能力变化曲线如图所示,其中b点为反应终点。下列叙述错误的是
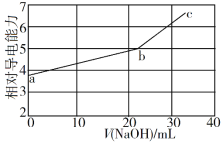
A. 混合溶液的导电能力与离子浓度和种类有关
B. Na+与A2−的导电能力之和大于HA−的
C. b点的混合溶液pH=7
D. c点的混合溶液中,c(Na+)>c(K+)>c(OH−)
-
NaOH溶液滴定邻苯二甲酸氢钾(邻苯二甲酸H2A的Ka1=1.1×10−3 ,Ka2=3.9×10−6)溶液,混合溶液的相对导电能力变化曲线如图所示,其中b点为反应终点。下列叙述错误的是
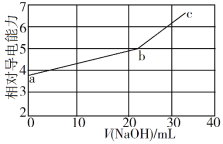
A. 混合溶液的导电能力与离子浓度和种类有关
B. Na+与A2−的导电能力之和大于HA−的
C. b点的混合溶液pH=7
D. c点的混合溶液中,c(Na+)>c(K+)>c(OH−)
-
NaOH溶液滴定邻苯二甲酸氢钾(邻苯二甲酸H2A的Ka1=1.1×10−3 ,Ka2=3.9×10−6)溶液,混合溶液的相对导电能力变化曲线如图所示,其中b点为反应终点。下列叙述错误的是
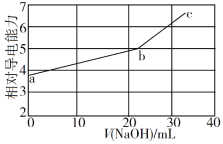
A. 混合溶液的导电能力与离子浓度和种类有关
B. Na+与A2−的导电能力之和大于HA−的
C. b点的混合溶液pH=7
D. c点的混合溶液中,c(Na+)>c(K+)>c(OH−)
-
NaOH溶液滴定邻苯二甲酸氢钾(邻苯二甲酸H2A的Ka1=1.1×10−3 ,Ka2=3.9×10−6)溶液,混合溶液的相对导电能力变化曲线如图所示,其中b点为反应终点。下列叙述错误的是
A. 混合溶液的导电能力与离子浓度和种类有关
B. Na+与A2−的导电能力之和大于HA−的
C. b点的混合溶液pH=7
D. c点的混合溶液中,c(Na+)>c(K+)>c(OH−)
-
已知邻苯二甲酸(H2A)的K a1 =1.1×10−3,K a2=3.9×10−6。常温下,用0.10mol·L−1的NaOH溶液滴定20.0mL0.10mol·L−1的邻苯二甲酸氢钾(KHA)溶液,溶液pH的变化曲线如图所示。下列叙述错误的是
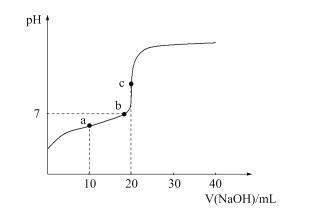
A.a点的混合溶液中:c(K+)>c(A2-)>c(Na+)>c(HA-)
B.b点的混合溶液中:c(Na+)=c(A2-)+c(HA-)
C.c点溶液pH在9~10之间
D.从a点到c点水的电离程度逐渐增大
-
常温下将NaOH溶液添加到某二元弱酸H2A溶液中,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述正确的是( )
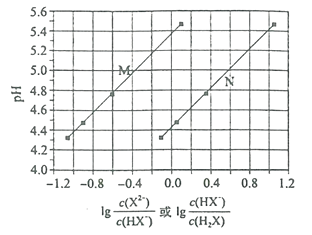
A.Ka2(H2A)的数量级为10-5 B.NaHA溶液中c(H+)>c(OH-)
C.曲线M表示pH与 的变化关系 D.当混合溶液呈中性时:c (Na+) > c (HA-) > c (A2-)> c (OH-)=c (H+)
的变化关系 D.当混合溶液呈中性时:c (Na+) > c (HA-) > c (A2-)> c (OH-)=c (H+)
-
常温下,向20mL0.3mol·L-1H2A溶液中滴加0.3mol·L-1的NaOH溶液。有关微粒(H2A、HA-、A2-)的物质的量变化如图所示,已知x、y对应的pH分别为4和9。下列有关说法不正确的是
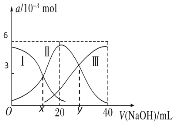
A.Ka2(H2A)=10-9
B.当V(NaOH)=20mL时,溶液呈酸性
C.x处溶液中:c(OH-)+3c(A2-)-c(Na+)=10-4mol·L-1
D.当V(NaOH)=40mL时c(A2-)+c(HA-)+c(H2A)=0.1mol·L-1
-
已知常温下H2A的Ka1=2.7×10-6,Ka2=6.3×10-10,HClO的Ka=3×10-8。下列说法正确的是
A.NaHA溶液中存在:c(Na+)>c(HA-)>c(A2-)>c(H+)>c(OH-)
B.向Na2A溶液中通入少量Cl2的离子方程式:Cl2+2A2-+H2O=Cl-+ClO-+2HA-
C.NaClO溶液中水电离出的c(H+)·c(OH-)大于等浓度的Na2A溶液中水电离出的c(H+)·c(OH-)
D.等浓度、等体积的NaHA和NaClO的混合溶液中存在:c(OH-)=c(H+)+c(ClO-)+c(HA-)+c(HClO)+c(H2A)
-
有机酸种类繁多,甲酸( HCOOH)是常见的一元酸,常温下其Ka=1.8×10-4,草酸(H2C2O4)是常见的二元酸,常温下,Ka1=5.4×10-2,Ka2=5.4×10-5。下列说法正确的是
A. 甲酸钠溶液中:c(Na+)>c(HCOOˉ)>c(H+)>c(OHˉ)
B. 草酸氢钠溶液中加入甲酸钠溶液至中性:c(Na+)=c(HC2O4ˉ)+2c(C2O42-)+c(HCOOˉ)
C. Na2C2O4溶液中;c(HC2O4ˉ)+c(H2C2O4)+c(H+)=c(OHˉ)
D. 足量甲酸与草酸钠溶液反应:2 HCOOH+Na2C2O4==H2C2O4+2 HCOONa







