-
某学习小组探究溴乙烷的消去反应并验证产物。
实验原理:CH3CH2Br + NaOH CH2=CH2↑ + NaBr + H2O
CH2=CH2↑ + NaBr + H2O
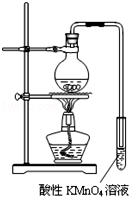
实验过程:组装如图所示装置,检查装置气密性,向烧瓶中注入10mL溴乙烷和15mL饱和氢氧化钠乙醇溶液,微热,观察实验现象。一段时间后,观察到酸性KMnO4溶液颜色褪去。
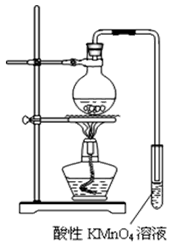
(1)甲同学认为酸性KMnO4溶液颜色褪去说明溴乙烷发生了消去反应,生成了乙烯;而乙同学却认为甲同学的说法不严谨,请说明原因: 。
(2)丙同学认为只要对实验装置进行适当改进,就可避免对乙烯气体检验的干扰,改进方法为: 。
改进实验装置后,再次进行实验,却又发现小试管中溶液颜色褪色不明显。该小组再次查阅资料,对实验进行进一步的改进。
资料一:溴乙烷于55℃时,在饱和氢氧化钠的乙醇溶液中发生取代反应的产物的百分比为99%,而消去反应产物仅为1%。
资料二:溴乙烷发生消去反应比较适宜的反应温度为90℃~110℃,在该范围,温度越高,产生乙烯的速率越快。
资料三:溴乙烷的沸点:38.2℃。
(3)结合资料一、二可知,丙同学改进实验装置后,溶液颜色褪色不明显的原因可能是_______,此时发生反应的化学方程式为: 。
(4)结合资料二、三,有同学认为应将实验装置中烧瓶改成三颈烧瓶并增加两种仪器,这两种仪器是① 。② 。
-
某学习小组探究溴乙烷的消去反应并验证产物。
实验原理:CH3CH2Br + NaOH CH2=CH2↑ + NaBr + H2O
CH2=CH2↑ + NaBr + H2O
实验过程:组装如图所示装置,检查装置气密性,向烧瓶中注入10mL溴乙烷和15mL饱和氢氧化钠乙醇溶液,微热,观察实验现象。一段时间后,观察到酸性KMnO4溶液颜色褪去。
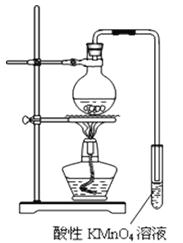
(1)甲同学认为酸性KMnO4溶液颜色褪去说明溴乙烷发生了消去反应,生成了乙烯;而乙同学却认为甲同学的说法不严谨,请说明原因: 。
(2)丙同学认为只要对实验装置进行适当改进,就可避免对乙烯气体检验的干扰,改进方法为: 。
改进实验装置后,再次进行实验,却又发现小试管中溶液颜色褪色不明显。该小组再次查阅资料,对实验进行进一步的改进。
资料一:溴乙烷于55℃时,在饱和氢氧化钠的乙醇溶液中发生取代反应的产物的百分比为99%,而消去反应产物仅为1%。
资料二:溴乙烷发生消去反应比较适宜的反应温度为90℃~110℃,在该范围,温度越高,产生乙烯的速率越快。
资料三:溴乙烷的沸点:38.2℃。
(3)结合资料一、二可知,丙同学改进实验装置后,溶液颜色褪色不明显的原因可能是_______,此时发生反应的化学方程式为: 。
(4)结合资料二、三,有同学认为应将实验装置中烧瓶改成三颈烧瓶并增加两种仪器,这两种仪器是① 。② 。
-
(10分)某学习小组探究溴乙烷的消去反应并验证产物。
实验原理:CH3CH2Br + NaOH CH2=CH2↑ + NaBr + H2O
CH2=CH2↑ + NaBr + H2O
实验过程:组装如图1所示装置,检查装置气密性,向烧瓶中注入10mL溴乙烷和15mL饱和氢氧化钠乙醇溶液,微热,观察实验现象。一段时间后,观察到酸性KMnO4溶液颜色褪去。
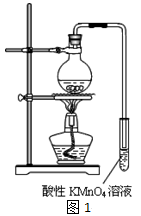
(1)甲同学认为酸性KMnO4溶液颜色褪去说明溴乙烷发生了消去反应,生成了乙烯;而乙同学却认为甲同学的说法不严谨,请说明原因: 。
(2)丙同学认为只要对实验装置进行适当改进,即可避免对乙烯气体检验的干扰,改进方法 。
改进实验装置后,再次进行实验,却又发现小试管中溶液颜色褪色不明显。该小组再次查阅资料,对实验进行进一步的改进。
资料一:溴乙烷于55℃时,在饱和氢氧化钠的乙醇溶液中发生取代反应的产物的百分比为99%,而消去反应产物仅为1%。
资料二:溴乙烷发生消去反应比较适宜的反应温度为90℃~110℃,在该范围,温度越高,产生乙烯的速率越快。
资料三:溴乙烷的沸点:38.2℃。
(3)结合资料一、二可知,丙同学改进实验装置后,溶液颜色褪色不明显的原因可能是 ,此时发生反应的化学方程式为(只写主要发生的反应): 。
(4)结合资料二、三,你认为还应该在实验装置中增加的两种仪器是
① 。
② 。
-
(10分)某学习小组探究溴乙烷的消去反应并验证产物。
实验原理:CH3CH2Br + NaOH  CH2=CH2↑ + NaBr + H2O
CH2=CH2↑ + NaBr + H2O
实验过程:组装如图所示装置,检查装置气密性,向烧瓶中注入10mL溴乙烷和 15mL饱和氢氧化钠乙醇溶液,微热,观察实验现象。一段时间后,观察到酸性KMnO4溶液颜色褪去。
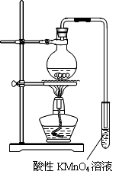
(1)甲同学认为酸性KMnO4溶液颜色褪去说明溴乙烷发生了消去反应,生成了乙烯;而乙同学却认为甲同学的说法不严谨,请说明原因: 。
(2)丙同学认为只要对实验装置进行适当改进,就可避免对乙烯气体检验的干扰,改进方法为: 。
改进实验装置后,再次进行实验,却又发现小试管中溶液颜色褪色不明显。该小组再次查阅资料,对实验进行进一步的改进。
资料一:溴乙烷于55℃时,在饱和氢氧化钠的乙醇溶液中发生取代反应的产物的百分比为99%,而消去反应产物仅为1%。
资料二:溴乙烷发生消去反应比较适宜的反应温度为90℃~110℃,在该范围,温度越高,产生乙烯的速率越快。
资料三:溴乙烷的沸点:38.2℃。
(3)结合资料一、二可知,丙同学改进实验装置后,溶液颜色褪色不明显的原因可能是 ,此时发生反应的化学方程式为: 。
(4)结合资料二、三,有同学认为应将实验装置中烧瓶改成三颈烧瓶并增加两种仪器,
这两种仪器是① 。② 。
-
某学习小组探究溴乙烷的消去反应并验证产物.实验原理:CH3CH2Br+NaOH  CH2=CH2↑+NaBr+H2O实验过程:组装如图1所示装置,检查装置气密性,向烧瓶中注入10mL溴乙烷和15mL饱和氢氧化钠乙醇溶液,微热,观察实验现象.一段时间后,观察到酸性KMnO4溶液颜色褪去.
CH2=CH2↑+NaBr+H2O实验过程:组装如图1所示装置,检查装置气密性,向烧瓶中注入10mL溴乙烷和15mL饱和氢氧化钠乙醇溶液,微热,观察实验现象.一段时间后,观察到酸性KMnO4溶液颜色褪去.
(1)甲同学认为酸性KMnO4溶液颜色褪去说明溴乙烷发生了消去反应,生成了乙烯;而乙同学却认为甲同学的说法不严谨,请说明原因:
(2)丙同学认为只要对实验装置进行适当改进,即可避免对乙烯气体检验的干扰,改进方法:
改进实验装置后,再次进行实验,却又发现小试管中溶液颜色褪色不明显。该小组再次查阅资料,对实验进行进一步的改进。
资料一:溴乙烷于55℃时,在饱和氢氧化钠的乙醇溶液中发生取代反应的产物的百分比为99%,而消去反应产物仅为1%。
资料二:溴乙烷发生消去反应比较适宜的反应温度为90℃~110℃,在该范围,温度越高,产生乙烯的速率越快。
资料三:溴乙烷的沸点:38.2℃.
(3)结合资料一、二可知,丙同学改进实验装置后,溶液颜色褪色不明显的原因可能是
,此时发生反应的化学方程式为: 。
(4)结合资料二、三,你认为还应该在实验装置中增加的两种仪器是
① .② .
-
下列反应的化学方程式(或离子方程式)错误的是 ( )
A.苯酚与氢氧化钠溶液反应
B.溴乙烷与NaOH溶液混和共热CH3CH2Br + NaOH CH2=CH2↑+H2O+NaBr
CH2=CH2↑+H2O+NaBr
C.乙醛与银氨溶液反应 CH3CHO+2[Ag(NH3)2]OH CH3COONH4+2Ag↓+3NH3+H2O
CH3COONH4+2Ag↓+3NH3+H2O
D.乙醇的消去反应 CH3CH2OH CH2 =CH2 ↑+H2O
CH2 =CH2 ↑+H2O
-
下列反应的化学方程式(或离子方程式)错误的是 ( )
A、苯酚与氢氧化钠溶液反应
B、溴乙烷与NaOH溶液混和共热CH3CH2Br + NaOH CH2=CH2↑+H2O+NaBr
CH2=CH2↑+H2O+NaBr
C、乙醛与银氨溶液反应 CH3CHO+2[Ag(NH3)2]OH  CH3COONH4+2Ag↓+3NH3+H2O
CH3COONH4+2Ag↓+3NH3+H2O
D、乙醇的消去反应 CH3CH2OH CH2=CH2 ↑+H2O
CH2=CH2 ↑+H2O
-
下列反应的化学方程式(或离子方程式)错误的是
A.苯酚与氢氧化钠溶液反应 —OH + OH — →
—OH + OH — → —O — + H2O
—O — + H2O
B.溴乙烷与NaOH溶液混和共热CH3CH2Br + NaOH CH2=CH2+H2O+NaBr
CH2=CH2+H2O+NaBr
C.乙醛与银氨溶液反应CH3CHO+2[Ag(NH3)2]OH CH3COONH4+2Ag↓+3NH3+H2O
CH3COONH4+2Ag↓+3NH3+H2O
D.乙醇的消去反应 CH3CH2OH CH2=CH2 ↑+H2O
CH2=CH2 ↑+H2O
-
某学习小组探究溴乙烷的消去反应并验证产物。

实验过程:组装如图1所示装置,检查装置气密性,向烧瓶中注入10mL溴乙烷和15mL饱和氢氧化钠乙醇溶液,微热,观察实验现象。一段时间后,观察到酸性KMnO4溶液颜色褪去。
(1)请写出溴乙烷的消去反应的化学方程式:
(2)甲同学认为酸性KMnO4溶液颜色褪去说明溴乙烷发生了消去反应,生成了乙烯;而乙同学却认为甲同学的说法不严谨,请说明原因: 。
(3)丙同学认为只要对实验装置进行适当改进,即可避免对乙烯气体检验的干扰,改进方法: 。
改进实验装置后,再次进行实验,却又发现小试管中溶液颜色褪色不明显。该小组再次查阅资料,对实验进行进一步的改进。
资料一:溴乙烷于55℃时,在饱和氢氧化钠的乙醇溶液中发生取代反应的产物的百分比为99%,而消去反应产物仅为1%。
资料二:溴乙烷发生消去反应比较适宜的反应温度为90℃~110℃,在该范围,温度越高,产生乙烯的速率越快。
资料三:溴乙烷的沸点:38.2℃。
(4)结合资料一、二可知,丙同学改进实验装置后,溶液颜色褪色不明显的原因可能是 ,此时发生反应的化学方程式为 。
(5)结合资料二、三,你认为还应该在实验装置中增加的两种仪器是
① ②
-
某研究性学习小组的同学设计了如图装置制取溴苯和溴乙烷:
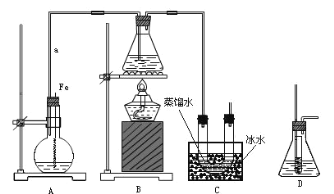
已知:乙醇在加热的条件下可与HBr反应得到溴乙烷(CH3CH2Br),二者某些物理性质如下 表所示:
| 溶解性(本身均可作溶剂) | 沸点(℃) | 密度(g/mL) |
| 乙醇 | 与水互溶,易溶于有机溶剂 | 78.5 | 0.8 |
| 溴乙烷 | 难溶于水,易溶于有机溶剂 | 38.4 | 1.4 |
请回答下列问题:
(1)B中发生反应生成目标产物的化学方程式为______。
(2)导管a的作用是______。
(3)反应完毕后,U形管内的现象是______;分离溴乙烷时所需的玻璃仪器是______。
(4)简述实验中用纯铁丝代替铁粉的优点:______。
(5)实验完成后,某同学在溴乙烷中加入NaOH乙醇溶液并加热,为判断其发生的是水解 反应还是消去反应,该同学设计了甲、乙两个方案:
方案甲:向反应混合液中滴入溴水,若溶液颜色很快褪去,则可证明发生了消去反应
方案乙:向反应混合液中滴入酸性KMnO4溶液,若溶液颜色变浅,则证明发生了消去反应。
则有关上述实验方案的叙述(_____)
A 方案甲正确 B 方案乙正确 C 两个方案都不正确
CH2=CH2↑ + NaBr + H2O








