-
(15分)铜单质及其化合物在很多领域有重要用途,如金属铜用来制造电线电缆,五水硫酸铜可用作杀菌剂。
(1)Cu位于元素周期表第四周期第ⅠB 族。Cu2+的核外电子排布式为 。
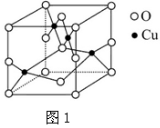
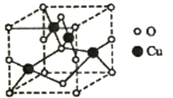
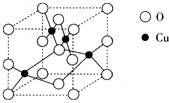
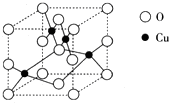
(2)如图1是铜的某种氧化物的晶胞结构示意图,可确定该晶胞中阴离子的个数为 。
(3)胆矾CuSO4·5H2O可写成[Cu(H2O)4]SO4·H2O,其结构示意图如图2:下列说法正确的是 (填字母)。
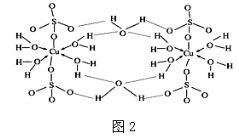
A.在上述结构示意图中,所有氧原子都采用sp3杂化
B.在上述结构示意图中,存在配位键、共价键和离子键
C.胆矾是分子晶体,分子间存在氢键
D.胆矾中的水在不同温度下会分步失去
(4)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子。已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是: 。
(5)Cu2O的熔点比Cu2S的 (填“高”或“低”),请解释原因: 。
(6)S单质的常见形式为S8,其环状结构如图所示,S原子采用的轨道杂化方式是________
(7)原子的第一电离能是指气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量,O、S、Se原子的第一电离能由大到小的顺序为____________________;
-
铜单质及其化合物在很多领域有重要的用途,如金属铜用来制造电线电缆,五水硫酸铜可用作杀菌剂。
(1)Cu位于元素周期表第IB族。元素基态原子3d能级上有__________种不冋运动状态的电子;Cu2+的核外电子排布式为______________________
(2)右图是铜的某种氧化物的晶胞结构示意图,可确定该晶胞中阴离子的个数为__________。
(3)胆矾CuSO4·5H2O可写成[Cu(H2O)]SO4·H2O,其结构示意图如图,下列说法正确的是______(填字母)。
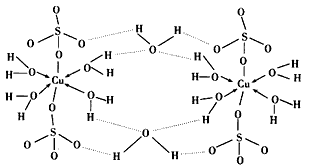
A.在上述结构示意图中,所有氧原子都采用sp3杂化
B.在上述结构示意图中,存在配位键、共价键和离子键
C.胆矾是分子晶体,分子间存在氢键
D.胆矾中的水在不同温度下会分步失去
(4)S、H、O三种元素的电负性由小到大的顺序是________________。
(5)往硫酸铜溶液中加入过量氨水,首先形成蓝色沉淀,继续添加氨水,沉淀溶解,得到深蓝色透明溶液,可生成[Cu(NH3)4]2+配离子。写出沉淀转化为深蓝色溶液的的离子方程式__________________;已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是_______________________。
(6)Cu2O的熔点比Cu2S的____________(填“高”或“低”),请解释原因____________________。
-
铜单质及其化合物在很多领域有重要的用途,如金属铜用来制造电线电缆,五水硫酸铜可用作杀菌剂.
(1)Cu位于元素周期表第I B族.Cu2+的核外电子排布式为______.
(2)右图是铜的某种氧化物的晶胞结构示意图,可确定该晶胞中阴离子的个数为______.
(3)胆矾CuSO4•5H2O可写成[Cu(H2O4)]SO4•H2O,其结构示意图如下:
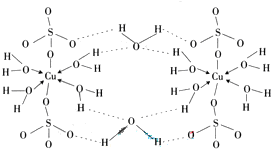
下列说法正确的是______(填字母).
A.在上述结构示意图中,所有氧原子都采用sp3杂化
B.在上述结构示意图中,存在配位键、共价键和离子键
C.胆矾是分子晶体,分子间存在氢键
D.胆矾中的水在不同温度下会分步失去
(4)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子.已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是______.
(5)Cu2O的熔点比Cu2S的______(填“高”或“低”),请解释原因______.
-
铜单质及其化合物在很多领域有重要的用途,如金属铜用来制造电线电缆,五水硫酸铜可用作杀菌剂.
(1)Cu位于元素周期表第I B族.Cu2+的核外电子排布式为______.
(2)右图是铜的某种氧化物的晶胞结构示意图,可确定该晶胞中阴离子的个数为______.
(3)胆矾CuSO4•5H2O可写成[Cu(H2O4)]SO4•H2O,其结构示意图如下:
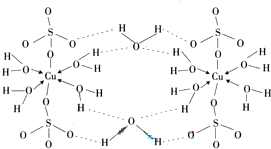
下列说法正确的是______(填字母).
A.在上述结构示意图中,所有氧原子都采用sp3杂化
B.在上述结构示意图中,存在配位键、共价键和离子键
C.胆矾是分子晶体,分子间存在氢键
D.胆矾中的水在不同温度下会分步失去
(4)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子.已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是______.
(5)Cu2O的熔点比Cu2S的______(填“高”或“低”),请解释原因______.
-
(12分)【化学——物质结构与性质】
铜单质及其化合物在很多领域有重要用途,如金属铜用来制造电线电缆,无水合硫酸铜可用作杀菌剂等。
(1)Cu2+的核外电子排布式为________________。
(2)科学家通过X射线测胆矾中既含有配位键,又含有氢键,其结构示意图可简单表示如下:
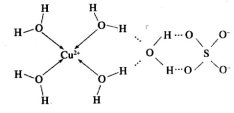
①胆矾的化学式用配合物的形式表示为______。
②胆矾中 的空间构型为_________,H2O中O原子的杂化方式为____________。
的空间构型为_________,H2O中O原子的杂化方式为____________。
(3)向硫酸铜溶液中加入过量氨水,可生成 配离子。已知
配离子。已知 的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是____________________________。
的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是____________________________。
(4) N形成的晶体结构如图所示,N3-的配位数是________。设晶胞边长为a cm,密度为b g/cm3,则阿伏加德罗常数可表示为___________(用含a、b的式子表示)。
N形成的晶体结构如图所示,N3-的配位数是________。设晶胞边长为a cm,密度为b g/cm3,则阿伏加德罗常数可表示为___________(用含a、b的式子表示)。

-
铜单质及其化合物在很多领域有重要的用途.
 一
一 如金属铜用来制造电线电缆,超细铜粉可应用于导电材料、催化剂等领域中;CuCl和
如金属铜用来制造电线电缆,超细铜粉可应用于导电材料、催化剂等领域中;CuCl和 都是重要的化工原料,常用作催化剂、颜料、防腐剂和消毒剂等.
都是重要的化工原料,常用作催化剂、颜料、防腐剂和消毒剂等.
(1)超细铜粉的某制备方法如下:

 中所含的化学键有 ______ .
中所含的化学键有 ______ .
(2)氯化亚铜 的制备过程是:向
的制备过程是:向 溶液中通入一定量
溶液中通入一定量 ,微热,反应一段时间后即生成CuCl白色沉淀.反应的离子方程式为 ______ .
,微热,反应一段时间后即生成CuCl白色沉淀.反应的离子方程式为 ______ .
 二
二 波尔多液是一种保护性杀菌剂,广泛应用于树木、果树和花卉上,鲜蓝色的胆矾晶体是配制波尔多液的主要原料.已知
波尔多液是一种保护性杀菌剂,广泛应用于树木、果树和花卉上,鲜蓝色的胆矾晶体是配制波尔多液的主要原料.已知 的部分结构可表示如下:
的部分结构可表示如下:

(1)写出铜原子价电子层的电子排布式 ______ ,与铜同周期的所有元素的基态原子中最外层电子数与铜原子相同的元素有 ______  填元素符号
填元素符号 .
.
(2)请在上图中把 结构中的化学键用短线“--”表示出来.______
结构中的化学键用短线“--”表示出来.______
(3)往浓 溶液中加入过量较浓的
溶液中加入过量较浓的 直到原先生成的沉淀恰好溶解为止,得到深蓝色溶液.小心加入约和溶液等体积的
直到原先生成的沉淀恰好溶解为止,得到深蓝色溶液.小心加入约和溶液等体积的 并使之分成两层,静置.经过一段时间后可观察到在两层“交界处”下部析出深蓝色
并使之分成两层,静置.经过一段时间后可观察到在两层“交界处”下部析出深蓝色 晶体.实验中所加
晶体.实验中所加 的作用是 ______ .
的作用是 ______ .
(4) 晶体中呈正四面体的原子团是 ______ ,杂化轨道类型是
晶体中呈正四面体的原子团是 ______ ,杂化轨道类型是 杂化的原子是 ______ .
杂化的原子是 ______ .
-
铜单质及其化合物在很多领域有重要的用途.
 一
一 如金属铜用来制造电线电缆,超细铜粉可应用于导电材料、催化剂等领域中;CuCl和
如金属铜用来制造电线电缆,超细铜粉可应用于导电材料、催化剂等领域中;CuCl和 都是重要的化工原料,常用作催化剂、颜料、防腐剂和消毒剂等.
都是重要的化工原料,常用作催化剂、颜料、防腐剂和消毒剂等.
(1)超细铜粉的某制备方法如下:

 中所含的化学键有 ______ .
中所含的化学键有 ______ .
(2)氯化亚铜 的制备过程是:向
的制备过程是:向 溶液中通入一定量
溶液中通入一定量 ,微热,反应一段时间后即生成CuCl白色沉淀.反应的离子方程式为 ______ .
,微热,反应一段时间后即生成CuCl白色沉淀.反应的离子方程式为 ______ .
 二
二 波尔多液是一种保护性杀菌剂,广泛应用于树木、果树和花卉上,鲜蓝色的胆矾晶体是配制波尔多液的主要原料.已知
波尔多液是一种保护性杀菌剂,广泛应用于树木、果树和花卉上,鲜蓝色的胆矾晶体是配制波尔多液的主要原料.已知 的部分结构可表示如下:
的部分结构可表示如下:

(1)写出铜原子价电子层的电子排布式 ______ ,与铜同周期的所有元素的基态原子中最外层电子数与铜原子相同的元素有 ______  填元素符号
填元素符号 .
.
(2)请在上图中把 结构中的化学键用短线“--”表示出来.______
结构中的化学键用短线“--”表示出来.______
(3)往浓 溶液中加入过量较浓的
溶液中加入过量较浓的 直到原先生成的沉淀恰好溶解为止,得到深蓝色溶液.小心加入约和溶液等体积的
直到原先生成的沉淀恰好溶解为止,得到深蓝色溶液.小心加入约和溶液等体积的 并使之分成两层,静置.经过一段时间后可观察到在两层“交界处”下部析出深蓝色
并使之分成两层,静置.经过一段时间后可观察到在两层“交界处”下部析出深蓝色 晶体.实验中所加
晶体.实验中所加 的作用是 ______ .
的作用是 ______ .
(4) 晶体中呈正四面体的原子团是 ______ ,杂化轨道类型是
晶体中呈正四面体的原子团是 ______ ,杂化轨道类型是 杂化的原子是 ______ .
杂化的原子是 ______ .
-
铜单质及其化合物在很多领域有重要的用途.
I.如金属铜用来制造电线电缆,超细铜粉可应用于导电材料、催化剂等领域中;CuCl和 都是重要的化工原料,常用作催化剂、颜料、防腐剂和消毒剂等.
都是重要的化工原料,常用作催化剂、颜料、防腐剂和消毒剂等.
(1)超细铜粉的某制备方法如图所示, 中所含的化学键有 ______ .
中所含的化学键有 ______ .

(2)氯化亚铜 的制备过程是:向
的制备过程是:向 溶液中通入一定量
溶液中通入一定量 ,微热,反应一段时间后即生成CuCl白色沉淀.反应的离子方程式为 ______ .
,微热,反应一段时间后即生成CuCl白色沉淀.反应的离子方程式为 ______ .
II.波尔多液是一种保护性杀菌剂,广泛应用于树木、果树和花卉上,鲜蓝色的胆矾晶体是配制波尔多液的主要原料.已知 的部分结构可表示如下:
的部分结构可表示如下:

(1)写出铜原子价电子层的电子排布式 ______ ,与铜同周期的所有元素的基态原子中最外层电子数与铜原子相同的元素有 ______  填元素符号
填元素符号 .
.
(2)请在上图中把 结构中的化学键表示出来._____________
结构中的化学键表示出来._____________
(3) 晶体中配位体是 ______ ,杂化轨道类型是
晶体中配位体是 ______ ,杂化轨道类型是 杂化的原子是 ______ .
杂化的原子是 ______ .
(4)金属晶体Cu中原子的堆积方式如下图甲所示,其晶胞特征如图乙所示,原子之间相互位置关系的平面图如下图丙所示.
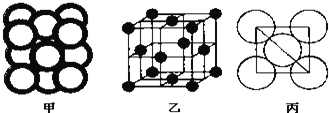
已知 代表阿伏加德罗常数,Cu的相对原子质量为M,Cu单质晶体的密度为d
代表阿伏加德罗常数,Cu的相对原子质量为M,Cu单质晶体的密度为d  该晶体的空间利用率是 ______ ,Cu原子半径的表达式为 ______
该晶体的空间利用率是 ______ ,Cu原子半径的表达式为 ______  用含
用含  、M、d的代数式表示
、M、d的代数式表示
-
铜单质及其化合物在很多领域有重要的用途.如金属铜用来制造电线电缆,超细铜粉可应用于导电材料、催化剂等领域中;CuCl和CuCl2都是重要的化工原料,常用作颜料、防腐剂和消毒剂等.
Ⅰ.超细铜粉的某制备方法如图1:

(1)N、O、S三种元素的第一电离能由大到小顺序为________.
(2)化合物NH4CuSO3中,金属阳离子的核外电子排布式为________.
(3)化合物Cu(NH3)4SO4中,N原子的杂化方式为________,SO42-的空间构型为________.
Ⅱ.氯化亚铜(CuCl)的某制备过程是:向CuCl2溶液中通入一定量SO2,微热,反应一段时间后即生成CuCl白色沉淀.
(4)写出上述制备CuCl的离子方程式________.
(5)CuCl的晶胞结构如图2所示,其中Cl原子的配位数为________.
(6)CuCl的熔点比CuO的熔点________(选填“高”或“低”).
-
(14分)非金属元素H、C、O、S、Cl能形成的化合物种类很多,单质及化合物的用途很广泛。
(1)O2-的离子结构示意图为 ,CS2的晶体类型为 晶体;
(2)O、Cl两元素形成的单质和化合物常用来杀菌消毒,试举例________(写化学式,任写两种);
(3)CH3OH在常温下为液态,沸点高于乙烷的主要原因是 ;
(4)Cl2是一种大气污染物,液氯储存区贴有的说明卡如下(部分):
| 危险性 | 
|
| 储运要求 | 远离金属粉末、氨、烃类、醇类物质;设置氯气检测仪 |
| 泄漏处理 | NaOH、NaHSO3溶液吸收 |
| 包装 | 钢瓶 |
①用离子方程式表示“泄漏处理”中NaHSO3溶液的作用 。
②若液氯泄漏后遇到苯,在钢瓶表面氯与苯的反应明显加快,原因是 。
③将Cl2通入适量KOH溶液中,产物中可能有KCl、KClO、KClO3。当溶液中c(Cl-):c(ClO-)=11:1时,则c(ClO-):c(ClO3-)比值等于 。
(5)镁是一种较活泼的金属,Mg与Ca类似,也能与C形成某种易水解的离子化合物。已知该化合物0.1mol与水完全反应后,产生0.1mol的某种气体。该气体被溴水全部吸收后,溴水增重2.6g。请写出该水解反应方程式 。