-
某班同学用如下实验探究Fe2+、Fe3+的性质。回答下列问题:
(1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.1mol/L的溶液。在FeCl2液中需加入少量铁属,其目的是 。
(2)甲组同学取2mlFeCl2溶液.加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化。FeCl2溶液与氯水反应的离子方程式为___________。
(3)乙组同学认为甲组的实验不够严谨,该组同学在2mLFeCl2溶液中先加入0.5ml煤油,再于液面下依次加入几滴氯水和l滴KSCN溶液,溶液变红,煤油的作用是 。
(4)丙组同学取10 mL0.1mol/LKI溶液,加入6mL0.1mol/LFeCl3溶液混合。分别取2mL此溶液于3支试管中进行如下实验:
①第一支试管中加入1mLCCl4充分振荡、静置,CCl4层呈紫色;
②第二只试管中加入1滴K3[Fe(CN)6] 溶液,生成蓝色沉淀:
③第三支试管中加入1滴KSCN溶液,溶液变红。
实验②检验的离子是_________(填离子符号);实验①和③说明:在I-过量的情况下,溶液中仍含有__________(填离子符号),由此可以证明该氧化还原反应为__________。
(5)丁组同学向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液·变成棕黄色,发生反应的离子方程式为________ ;一段时间后.溶液中有气泡出现,并放热.随后有红褐色沉淀生成。产生气泡的原因是__________;生成沉淀的原因是__________(用平衡移动原理解释)。
高三化学填空题困难题查看答案及解析
-
某班同学用如下实验探究 Fe2+、Fe3+的性质。回答下列问题:
(1)分别取一定量氯化铁、氯化亚铁固体,均配制成 100mL 0.1mol/L 的溶液.配制过 程中所需要的玻璃仪器有量筒、玻璃棒、烧杯、________________、____________________ ,配制氯化亚 铁溶液时所用溶剂需除去溶解其中的氧,除去水中氧的简单操作为__________,用饱和氯 化铁溶液制备 Fe(OH)3 胶体的离子方程式为________________________________________________。
(2)甲组同学取 2mL FeCl2 溶液,先加入 1 滴 KSCN 溶液,无现象,再加入几滴氯水, 溶液变 红,说明 Cl2 可将 Fe2+氧化。FeCl2 溶液与氯水反应的离子方程式为_____。
(3)乙组同学认为甲组的实验不够严谨,该组同学在 2mLFeCl2 溶液中先加入 0.5mL 煤 油,再于液面下依次加入 l 滴 KSCN 溶液和几滴氯水,溶液变红,煤油的作用是_____。
(4)丙组同学取 10 mL 0.1mol/LKI 溶液,加入 6mL 0.1mol/LFeCl3 溶液混合。分别取
2mL 此溶 液于 3 支试管中进行如下实验:
① 第一支试管中加入 1mLCCl4 充分振荡、静置,CCl4 层呈紫色 ;在水层中加入硝酸酸化 的硝酸银溶液,有黄色沉淀生成;
② 第二只试管中加入 1 滴铁氰化钾溶液,生成蓝色沉淀;
③ 第三支试管中加入 1 滴 KSCN 溶液,溶液变红。 实验②的离子方程式为_____________; 实验①和③说明:在I-过量的情况下,溶液中仍含有_____(填离子符号),由此可以证 明该氧化还原反应为_____。
(5)丁组同学向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液变成棕黄色,发 生反应的离子方程式为_____;一段时间后.溶液中有气泡出现,并放热,随后有红褐色沉淀生成。产生气泡的原因是_____;生成沉淀的原因是_____(用平衡移动原理解释)。
高三化学实验题中等难度题查看答案及解析
-
[2016·新课标II卷]某班同学用如下实验探究Fe2+、Fe3+的性质。回答下列问题:
(1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.1 mol/L的溶液。在FeCl2溶液中需加入少量铁屑,其目的是__________________________。
(2)甲组同学取2 mL FeCl2溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化。FeCl2溶液与氯水反应的离子方程式为_______________________________。
(3)乙组同学认为甲组的实验不够严谨,该组同学在2 mL FeCl2溶液中先加入0.5 mL煤油,再于液面下依次加入几滴氯水和l滴KSCN溶液,溶液变红,煤油的作用是______。
(4)丙组同学取10 mL 0.1 mol/L KI溶液,加入6 mL 0.1 mol/L FeCl3溶液混合。分别取2 mL此溶液于3 支试管中进行如下实验:
①第一支试管中加入1 mL CCl4充分振荡、静置,CCl4层呈紫色;
②第二支试管中加入1滴K3[Fe(CN)6] 溶液,生成蓝色沉淀:
③第三支试管中加入1滴KSCN溶液,溶液变红。
实验②检验的离子是__________(填离子符号);实验①和③说明:在I− 过量的情况下,溶液中仍含有___________(填离子符号),由此可以证明该氧化还原反应为_____________________。
(5)丁组同学向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液变成棕黄色,发生反应的离子方程式为_______________________________;一段时间后,溶液中有气泡出现,并放热,随后有红褐色沉淀生成。产生气泡的原因是____________________________________________;生成沉淀的原因是___________________________________(用平衡移动原理解释)。
高三化学填空题中等难度题查看答案及解析
-
(一)某班同学用如下实验探究Fe2+、Fe3+的性质。回答下列问题:
(1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.1 mol/L 的溶液。在FeCl2溶液中需加入少量铁屑,其目的是__________________________。
(2)甲组同学取2mLFeCl2溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化。FeCl2溶液与氯水反应的离子方程式为_______________。
(3)乙组同学认为甲组的实验不够严谨,该组同学在2mLFeCl2溶液中先加入0.5mL煤油,再于液面下依次加入几滴氯水和1滴KSCN溶液,溶液变红,煤油的作用是_____________。
(二)铝土矿(主要成分为Al2O3,还含有SiO2、Fe2O3)是工业上制备氧化铝的主要原料.工业上提取氧化铝的工艺流程如下:
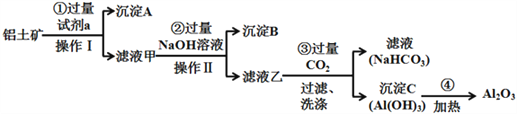
(1)沉淀A的成分是(填化学式)_________。
(2)步骤②中加入过量NaOH溶液发生反应的离子方程式,除了H++OH﹣=H2O还有:
_____________________________、________________________________;
(3)步骤③中通入过量CO2气体的离子方程式有______________________。
高三化学综合题中等难度题查看答案及解析
-
(一)某班同学用如下实验探究Fe2+、Fe3+的性质。回答下列问题:
(1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.1 mol/L 的溶液。在FeCl2溶液中需加入少量铁屑,其目的是__________________________。
(2)甲组同学取2mLFeCl2溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化。FeCl2溶液与氯水反应的离子方程式为_______________。
(3)乙组同学认为甲组的实验不够严谨,该组同学在2mLFeCl2溶液中先加入0.5mL煤油,再于液面下依次加入几滴氯水和1滴KSCN溶液,溶液变红,煤油的作用是_____________。
(二)工业上用赤铁矿(含Fe2O3、FeO,也含有Al2O3、MnO2、CuO、SiO2等)制备绿矾FeSO4·7H2O的流程如下:
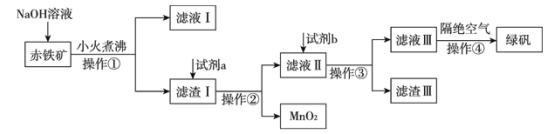
(1)氢氧化钠溶液加入赤铁矿中发生反应的离子方程式为____________;_________________。
(2)向滤渣Ⅰ中加入过量的试剂a为___________,过量的试剂b投入到滤液Ⅱ发生的所有反应的离子方程式为______________;_________________;________________。
(3)实验室中操作①②③的名称为_________________________。
(4)操作④隔绝空气的目的是_______________________________________________。
高三化学填空题困难题查看答案及解析
-
某班同学用如下实验探究Fe2+、Fe3+的性质。回答下列问题:
(1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.1mol/L的溶液.在FeCl2溶液中需加入少量铁屑,其目的是________。
(2)甲组同学取2mL FeCl2溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化。FeCl2溶液与氯水反应的离子方程式为_______。
(3)乙组同学认为甲组的实验不够严谨,该组同学在2mLFeCl2溶液中先加入0.5mL煤油,再于液面下依次加入几滴氯水和l滴KSCN溶液,溶液变红,煤油的作用是______。
(4)丙组同学取10 mL0.1mol/LKI溶液,加入6mL0.1mol/LFeCl3溶液混合。分别取2mL此溶液于3 支试管中进行如下实验:
①第一支试管中加入1mLCCl4充分振荡、静置,CCl4层呈紫色;
②第二只试管中加入1滴K3[Fe(CN)6] 溶液,生成蓝色沉淀:
③第三支试管中加入1滴KSCN溶液,溶液变红。
实验②检验的离子是_____(填离子符号);实验①和③说明:在I- 过量的情况下,溶液中仍含有______(填离子符号),由此可以证明该氧化还原反应为______。
(5)丁组同学向盛有H2O2溶液的试管中加入几滴酸化的FeCl3溶液,溶液变成棕黄色,发生反应的离子方程式为________;一段时间后.溶液中有气泡出现,并放热,随后有红褐色沉淀生成。产生气泡的原因是______;生成沉淀的原因是______(用平衡移动原理解释)。
高三化学填空题简单题查看答案及解析
-
某班同学用如下实验探究Fe2+、Fe3+的性质。回答下列问题:
(1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.1mol/L的溶液.在FeCl2溶液中需加入少量铁屑,其目的是________。
(2)甲组同学取2mL FeCl2溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化。FeCl2溶液与氯水反应的离子方程式为_______。
(3)乙组同学认为甲组的实验不够严谨,该组同学在2mLFeCl2溶液中先加入0.5mL煤油,再于液面下依次加入几滴氯水和l滴KSCN溶液,溶液变红,煤油的作用是______。
(4)丙组同学取10 mL0.1mol/LKI溶液,加入6mL0.1mol/LFeCl3溶液混合。分别取2mL此溶液于3 支试管中进行如下实验:
①第一支试管中加入1mLCCl4充分振荡、静置,CCl4层呈紫色;
②第二只试管中加入1滴K3[Fe(CN)6] 溶液,生成蓝色沉淀:
③第三支试管中加入1滴KSCN溶液,溶液变红。
实验②检验的离子是_____(填离子符号);实验①和③说明:在I- 过量的情况下,溶液中仍含有______(填离子符号),由此可以证明该氧化还原反应为______。
(5)丁组同学向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液变成棕黄色,发生反应的离子方程式为________;
高三化学实验题困难题查看答案及解析
-
某班同学用如下实验探究Fe2+、Fe3+的性质。回答下列问题:
(1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.1mol/L的溶液。在FeCl2溶液中需加入少量铁屑,其目的是_____ ___。
(2)甲组同学取2mL FeCl2溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化。FeCl2溶液与氯水反应的离子方程式为_____ __。
(3)乙组同学认为甲组的实验不够严
谨,该组同学在2mLFeCl2溶液中先加入0.5mL煤油,再于液面下依次加入几滴氯水和l滴KSCN溶液,溶液变红,煤油的作用是____ __。
(4)丙组同学取10 mL0.1mo
l/L KI溶液,加入6mL0.1mol/LFeCl3溶液混合。分别取2mL此溶液于3 支试管中进行如下实验:
① 第一支试管中加入1mLCCl4充分振荡、静置,CCl4层呈紫色;
② 第二只试管中加入1滴K3Fe(CN)6] 溶液,生成蓝色沉淀:
③ 第三支试管中加入1滴K
SCN溶液,溶
液变红。
实验②检验的离子是_____________(填离子符号);实验①和③说明:在I- 过量的情况下,溶液中仍含有 ___(填离子符号),由此可以证明该氧化还原反应为___ ___。
(5)丁组同学向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液变成棕黄色,发生反应的离子方程式为_______ _;一段时间后.溶液中有气泡出现,并放热,随后有红褐色沉淀生成。产生气泡的原因是__ ____;生成沉淀的原因是____ __(用平衡移动原理解释)。
高三化学实验题困难题查看答案及解析
-
某班同学用如下实验探究Fe2+、Fe3+的性质。回答下列问题:
(1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.1mol/L的溶液.在FeCl2溶液中需加入少量铁屑,其目的是________。
(2)甲组同学取2mL FeCl2溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化。FeCl2溶液与氯水反应的离子方程式为______________________。
(3)乙组同学认为甲组的实验不够严谨,该组同学在2mLFeCl2溶液中先加入0.5mL煤油,再于液面下依次加入几滴氯水和l滴KSCN溶液,溶液变红,煤油的作用是___________。
(4)丙组同学向盛有H2O2溶液的试管中加入几滴酸化的FeCl3溶液,溶液变成棕黄色,发生反应的离子方程式为________;一段时间后.溶液中有气泡出现,并放热,随后有红褐色沉淀生成。产生气泡的原因是______。
高三化学填空题简单题查看答案及解析
-
某班同学用如下实验探究Fe2+、Fe3+的性质。回答下列问题:
(1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.1 mol/L 的溶液。在FeCl2溶液中需加入少量铁屑,其目的是__________________________。
(2)甲组同学取2 mLFeCl2溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化。FeCl2溶液与氯水反应的离子方程式为_______________。
(3)乙组同学认为甲组的实验不够严谨,该组同学在2 mL FeCl2溶液中先加入0.5 mL 煤油,再于液面下依次加入几滴氯水和1滴KSCN溶液,溶液变红,煤油的作用是_____________。
(4)丙组同学取10 ml 0.1 mol·L-1KI溶液,加入6 mL 0.1 mol·L-1 FeCl3溶液混合。分别取 2 mL 此溶液于3支试管中进行如下实验:
①第一支试管中加入1 mL CCl4充分振荡、静置,CCl4层显紫色;
②第二支试管中加入1滴K3[Fe(CN)6]溶液,生成蓝色沉淀;
③第三支试管中加入1滴KSCN溶液,溶液变红。
实验②检验的离子是________(填离子符号);实验①和③说明:在I-过量的情况下,溶液中仍含有______(填离子符号),由此可以证明该氧化还原反应为_______。
高三化学实验题困难题查看答案及解析