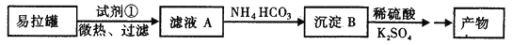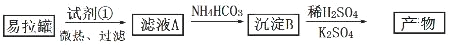-
明矾[KAl(SO4)2·12H2O]在生产、生活中有广泛用途:饮用水的净化;造纸工业上作施胶剂;食品工业的发酵剂等.利用炼铝厂的废料﹣铝灰(含Al、Al2O3及少量SiO2和FeO·xFe2O3)可制备明矾.工艺流程如下:
回答下列问题:
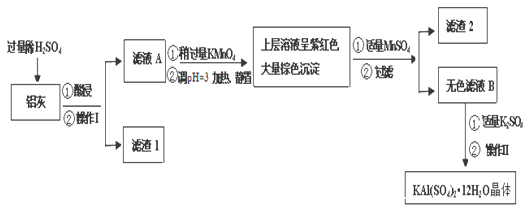
(1)明矾净水的原理是(用离子方程表示)________________;
(2)操作Ⅰ是________,操作Ⅱ是蒸发浓缩、________、过滤、洗涤、干燥.
(3)检验滤液A中是否存在Fe2+的试剂是________(只用一种试剂)
(4)在滤液A中加入高锰酸钾发生反应的离子方程式为(该条件下Fe2+ 转化为Fe3+,MnO4﹣转化为Mn2+)________________。
已知:生成氢氧化物沉淀的pH如下表所示
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
注:金属离子的起始浓度为0.1mol·L﹣1
根据表中数据解释调pH=3的目的________________。
(5)已知:在pH=3、加热条件下,MnO4﹣可与Mn2+反应生成MnO2.加入MnSO4发生反应的离子方程式为________________________。
-
化学平衡移动原理在生产、生活、科研中有重要应用。
(1)生活中明矾[KAl(SO4)2·12H2O]常用作净水剂,其净水的原理是_____(用离子方程式表示)。
(2)工业上在850℃时用钠还原熔融态氯化钾的方法制备金属钾,发生的反应方程式为:Na(l) + KCl(l) NaCl(l) + K(g),能制备钾的原因是_______。
NaCl(l) + K(g),能制备钾的原因是_______。
(3)测得某工厂废水中含Cr2O72–的浓度为3.0×10–4 mol·L−1,常温下,对该有害离子的处理流程如下:{已知:绿矾的化学式为FeSO4·7 H2O, Ksp [Cr(OH)3]=6.0×10–31 }

① 步骤(Ⅰ)中发生反应的离子方程式为_________。
② 若忽略加入各种试剂后的废水体积变化,则Cr3+开始沉淀的pH为_________。
(4)为了研究沉淀溶解平衡和沉淀转化,某同学查阅资料并设计如下实验。查阅资料:25℃时,Ksp (AgCl)=1.8×10–10,Ksp (AgI)=8.3×10–17。
| 操作步骤 | 现象 |
| 步骤1:向2 mL 0.1 mol·L−1AgNO3溶液中加入2 mL 0.1 mol·L−1 NaCl溶液,得到浊液a,过滤。 | 得滤液b和白色沉淀c |
| 步骤2:向滤液b中滴加0.1 mol·L−1 KI溶液。 | 出现浑浊 |
| 步骤3:向白色沉淀c中滴加0.1 mol·L−1 KI溶液。 | 白色沉淀变为黄色 |
① 浊液a中存在沉淀溶解平衡(用方程式表示)______________。
② 用化学平衡原理解释步骤3中的实验现象_________。
-
生活中常用的净水剂KAl(SO4)2·12H2O(明矾)是一种复盐,在造纸等方面应用广泛。实验室中,采用废易拉罐( 主要成分为Al,含有少量的Fe、Mg杂质)制备明矾的过程如下图所示。回答下列问题:
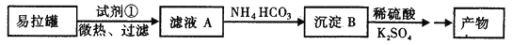
(1)为尽量少引入杂质,试剂①应选用__________ (填标号)。
A.HCl溶液 B.H2SO4 溶液 C.氨水 D.NaOH溶液
(2)沉淀B的化学式为______________;将少量明矾溶于水,溶液呈弱酸性,其原因是_________________________________ (用离子方程式表示)。
(3)科学研究证明NaAlO2 在水溶液中实际上是Na[Al(OH)4](四羟基合铝酸钠),易拉罐溶解过程中主要反应的化学方程式为_______________________________________。
(4)常温下,等pH的NaAlO2 和NaOH两份溶液中,由水电离出的c(OH-)前者为后者
的108倍,则两种溶液的pH=__________。
-
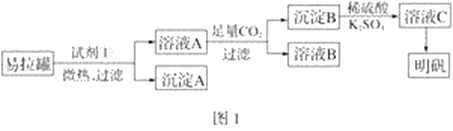
Ⅰ.KAl(SO4)2·12H2O(明矾)是一种复盐,在造纸等方面应用广泛。实验室中, 采用废易拉罐(主要成分为 Al,含有少量的 Fe、Mg 杂质)制备明矾的过程如下图所示。 回答下列问题:
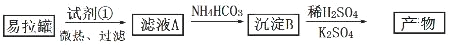
(1)为尽量少引入杂质,试剂①应选用______________(填标号)。
a.HCl 溶液 b.H2SO4 溶液 c.氨水 d.NaOH 溶液
(2)易拉罐溶解过程中主要反应的化学方程式为_________________________。
(3)沉淀 B 的化学式为______________________
II.毒重石的主要成分 BaCO3(含 Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备BaCl2·2H2O 的流程如下:

(4)毒重石用盐酸浸取前需充分研磨,目的是_________________________________。
| Ca2+ | Mg2+ | Fe3+ |
| 开始沉淀时的pH | 11.9 | 9.1 | 1.9 |
| 完全沉淀时的pH | 13.9 | 11.1 | 3.2 |
(5)滤渣Ⅱ中含 (填化学式)。加入 H2C2O4 时应避免过量,原因是_________________________________。已知:Ksp(BaC2O4) =1.6×10-7, Ksp(CaC2O4)=2.3×10-9
-
KAl(SO4)2·12H2O(明矾)是一种复盐,在造纸等方面应用广泛。实验室中,采用废易拉罐(主要成分为Al,含有少量的Fe、Mg杂质)制备明矾的过程如下图所示。回答下列问题:

(1)为尽量少引入杂质,试剂①应选用___(填标号)。
| A.HCl溶液 | B.H2SO4溶液 | C.氨水 | D.NaOH溶液 |
(2)易拉罐溶解过程中主要反应的化学方程式为________。
(3)沉淀B的化学式为________;将少量明矾溶于水,溶液呈弱酸性,其原因是__________。
(4)已知:Kw=1.0×10-14,Al(OH)3 AlO2-+H++H2O K=2.0×10-13。Al(OH)3溶于NaOH溶液反应的平衡常数等于_________。
AlO2-+H++H2O K=2.0×10-13。Al(OH)3溶于NaOH溶液反应的平衡常数等于_________。
-
明矾[KAl(SO4)2·12H2O]是一种复盐,在造纸等方面应用广泛。某兴趣小组采用10.0 g废易拉罐(含90%的Al,还含有少量的Fe、Mg等杂质)制备明矾的实验方案如图1:
(1)试剂①应选用________(填代号)。
a.盐酸 b.H2SO4溶液
c.氨水 d.NaOH溶液
(2)易拉罐溶解过程中主要反应的化学方程式为___________________________。
(3)溶液B中溶质的主要成分为________________(填化学式)。
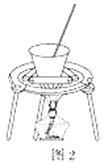
(4)从溶液C中得到明矾的实验操作步骤为蒸发浓缩、________(填操作名称)、过滤、洗涤、干燥。如图2所示,蒸发操作中的一处错误是________________________________。
(5)该小组在实验完成之后,得到118.5 g明矾,则明矾的回收率为________。(已知:明矾的摩尔质量为474 g·mol-1)
-
化学与生产、生活、社会密切相关,下列说法正确的是
A.明矾[KAl(SO4)2·12H2O]溶于水会形成胶体,因此可用于自来水的杀菌消毒。
B.煤燃烧时加入少量的生石灰可以减少废气中二氧化硫排放。
C.钢铁制品和铜制品既能发生吸氧腐蚀又能发生析氢腐蚀。
D.聚氟乙烯是纯净物。
-
化学与生产、生活密切相关,下列叙述错误的是( )·
A.用热的的纯碱溶液清除灶具上的油污
B.用硫酸清洗锅炉中的水垢
C.用明矾[KAl(SO4)2 ·12H2O]作净水剂,除去水中悬浮的杂质
D.用Na2S作沉淀剂,除去废水中的Cu2+和Hg2+
-
下列过程或现象与盐类水解无关的是( )
A.纯碱溶液去油污 B.明矾KAl(SO4)2•12H2O净化水
C.加热氯化铁溶液颜色变深 D.钢铁在潮湿的环境下生锈
-
化学与生产、生活密切相关,下列叙述错误的是
A.用热的纯碱溶液清除灶具上的油污
B.用Na2S作沉淀剂,除去废水中的Cu2+和Hg2+
C.用硫酸清洗锅炉中的水垢
D.用明矾[KAl(SO4)2·12H2O]作净水剂,除去水中悬浮的杂质