-
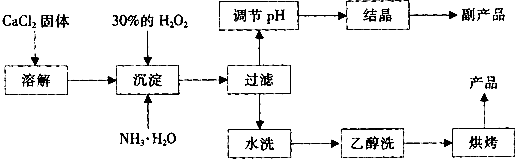
纯净的过氧化钙(CaO2)是白色的结晶粉末,难溶于水,不溶于乙醇、乙醚,常温下较为稳定,是一种新型水产养殖增氧剂,常用于鲜活水产品的运输.
已知:①在潮湿空气中CaO2能够发生反应:CaO2+2H2O→Ca(OH)2+H2O2 2CaO2+2CO2→2CaCO3+O2
②CaO2与稀酸反应生成盐和H2O2:CaO2+2H+→Ca2++H2O2
在实验室可用钙盐制取CaO2•8H2O,再经脱水制得CaO2.CaO2•8H2O在0℃时稳定,在室温时经过几天就分解,加热至130℃时逐渐变为无水CaO2.
其制备过程如下:
根据以上信息,回答下列问题:
(1)用上述方法制取CaO2•8H2O的化学方程式是______;
(2)为了控制沉淀温度为0℃左右,在实验室宜采取的方法是______;
(3)该制法的副产品为______(填化学式),为了提高副产品的产率,结晶前要将溶液的pH调整到合适范围,可加入的试剂是______. A.盐酸 B.氨水
(4)为了检验“水洗”是否合格,可取少量洗涤液于试管中,再滴加______.
(5)测定产品中CaO2的含量的实验步骤是:
第一步,准确称取a g产品于有塞锥形瓶中,加入适量蒸馏水和过量的b g KI晶体,再滴入少量2mol/L的H2SO4溶液,充分反应.
第二步,向上述锥形瓶中加入几滴淀粉溶液.
第三步,逐滴加入浓度为c mol/L的Na2S2O3溶液至反应完全,消耗Na2S2O3溶液V mL.(已知:I2+2S2O32-→2I-+S4O62-(无色))
①第三步中说明反应恰好完全的现象是______;②CaO2的质量分数为______ (用字母表示).
-
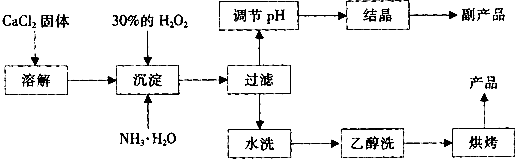
纯净的过氧化钙(CaO2)是白色的结晶粉末,难溶于水,不溶于乙醇、乙醚,常温下较为稳定,是一种新型水产养殖增氧剂,常用于鲜活水产品的运输.
已知:①在潮湿空气中CaO2能够发生反应:CaO2+2H2O→Ca(OH)2+H2O2 2CaO2+2CO2→2CaCO3+O2
②CaO2与稀酸反应生成盐和H2O2:CaO2+2H+→Ca2++H2O2
在实验室可用钙盐制取CaO2•8H2O,再经脱水制得CaO2.CaO2•8H2O在0℃时稳定,在室温时经过几天就分解,加热至130℃时逐渐变为无水CaO2.
其制备过程如下:
根据以上信息,回答下列问题:
(1)用上述方法制取CaO2•8H2O的化学方程式是______;
(2)为了控制沉淀温度为0℃左右,在实验室宜采取的方法是______;
(3)该制法的副产品为______(填化学式),为了提高副产品的产率,结晶前要将溶液的pH调整到合适范围,可加入的试剂是______. A.盐酸 B.氨水
(4)为了检验“水洗”是否合格,可取少量洗涤液于试管中,再滴加______.
(5)测定产品中CaO2的含量的实验步骤是:
第一步,准确称取a g产品于有塞锥形瓶中,加入适量蒸馏水和过量的b g KI晶体,再滴入少量2mol/L的H2SO4溶液,充分反应.
第二步,向上述锥形瓶中加入几滴淀粉溶液.
第三步,逐滴加入浓度为c mol/L的Na2S2O3溶液至反应完全,消耗Na2S2O3溶液V mL.(已知:I2+2S2O32-→2I-+S4O62-(无色))
①第三步中说明反应恰好完全的现象是______;②CaO2的质量分数为______ (用字母表示).
-
纯净的过氧化钙(CaO2)是白色粉末,难溶于水,不溶于乙醇、乙醚,常温下较为稳定,是一种新型水产养殖增氧剂,常用于鲜活水产品的运输。已知:在实验室可用钙盐制取CaO2·8H2O,再经脱水制得CaO2。其制备过程如下:

(1)“溶解”过程需要的玻璃仪器有 ;“沉淀”时需控制反应温度在0℃左右,比较简单易行的方法是 ;为检验“水洗”是否合格,可取少量洗涤液于试管中,再滴加 (填试剂),无明显现象说明“水洗”合格。
(2)“沉淀”时发生反应的离子方程式为 ;该制法的副产品为 (填化学式);若称取11.1g无水CaCl2,理论上应该量取质量分数30﹪、密度1.1g/cm3的H2O2溶液 mL。
(3)测定产品中CaO2的含量的实验步骤是:
第一步,准确称取a g产品于有塞锥形瓶中,加入适量蒸馏水和过量的b g KI晶体,再滴入少量2 mol/L的H2SO4溶液,充分反应;
第二步,向上述锥形瓶中加入几滴淀粉溶液;
第三步,逐滴加入浓度为c mol/L的Na2S2O3溶液至反应完全,消耗Na2S2O3溶液V mL。【已知:I2+2S2O32-→ 2I-+S4O62-(无色)】
①第三步中说明反应恰好完全的现象是 。
②CaO2的质量分数为 (用字母表示);
③某同学第一步和第二步的操作都很规范,第三步滴速太慢,这样测得的CaO2的质量分数可能 (填“偏高”、“偏低”、“无影响”、“不能确定”)
-
纯净的过氧化钙(CaO2)是白色的粉末,难溶于水,不溶于乙醇、乙醚,常温下较为稳定,是一种新型水产养殖增氧剂,常用于鲜活水产品的运输。实验室可用钙盐制取CaO2·8H2O,再经脱水制得CaO2。CaO2·8H2O在0℃时稳定,在室温时经过几天就分解,加热至130℃时逐渐变为无水CaO2。
其制备过程如下:
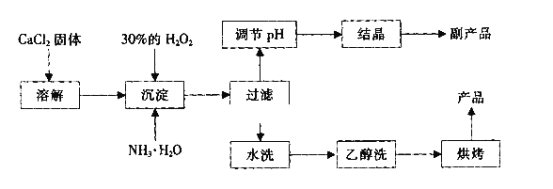
(1)用化学方程式表示出过氧化钙用做水产养殖增氧剂的原理:_______________。
(2)为了控制沉淀温度为0℃左右,在实验室宜采取的方法是__________________。
(3)该制法的副产品为___________(填化学式),为了提高副产品的产率,结晶前要将溶液的pH调整到合适范围,可加入下列试剂中的____________(填写A或B)。
A.盐酸 B.氨水
(4)为了检验“水洗”是否合格,可取少量洗涤液于试管中,再滴加__________进行检查。
(5)测定产品中CaO2的含量的实验步骤是:
第一步,准确称取ag产品于有塞锥形瓶中,加入适量蒸馏水和过量的bgKI晶体,再滴入少量2 mol·L—1的H2SO4溶液,充分反应。
第二步,向上述锥形瓶中加入几滴淀粉溶液。
第三步,逐滴加入浓度为c mol/L的Na2S2O3溶液至反应完全,消耗Na2S2O3溶液VmL。 (已知:I2+2S2O32-=2I-+S4O62-(无色))
①第三步中说明反应恰好完全的现象是___________________________________;
②CaO2的质量分数为______________________________________(用字母表示)
-
纯净的过氧化钙(CaO2)是白色的结晶粉末,难溶于水,不溶于乙醇、乙醚,常温下较为稳定,是一种新型水产养殖增氧剂,常用于鲜活水产品的运输。在实验室可用钙盐制取CaO2•8H2O,再经脱水制得CaO2。CaO2•8H2O在0℃时稳定,在室温时经过几天就分解,加热至130℃时逐渐变为无水CaO2。其制备过程如下:

回答下列问题:
(1)用上述方法制取CaO2•8H2O的化学方程式是 。为了控制沉淀温度为0℃左右,在实验室宜采取的方法是 。
(2)该制法的副产品为 (填化学式),为了提高副产品的产率,结晶前要将溶液的pH调整到合适范围,可加入的试剂是 。
(3)为了检验“水洗”是否合格,可取少量洗涤液于试管中,再滴加 。
(4)测定产品中CaO2的含量的实验步骤是:
第一步:准确称取a g产品于有塞锥形瓶中,加入适量蒸馏水和过量的b g KI晶体,再滴入少量2mol/L的H2SO4溶液,充分反应。
第二步:向上述锥形瓶中加入几滴淀粉溶液。
第三步:用浓度为c mol/L的Na2S2O3溶液进行滴定,消耗Na2S2O3溶液V mL。
(已知:I2+2S2O32-=2I-+S4O62-)
①第三步中滴定终点的现象是 ;
②CaO2的质量分数为 (用字母表示)。
(5)已知CaO2在350℃迅速分解生成CaO和O2。某实验小组设计下图装置测定产品中CaO2含量(夹持装置省略)。

①若所取产品质量是m g,测得气体体积为V mL(已换算成标准状况),则产品中CaO2的质量分数为 (用字母表示)。
②CaO2的含量也可用重量法测定,需要测定的物理量有 。
-
过氧化钙可用于治理赤潮、应急供氧等。已知:过氧化钙,为白色或淡黄色结晶粉末,难溶于水,不溶于乙醇、乙醚等有机溶剂,常温下干燥品很稳定,能溶于稀酸生成过氧化氢。某小组同学探究过氧化钙的制法和性质:
(1)甲、乙两位同学设计的过氧化钙实验室制法如下,其中产率较低的是______(填A、B)
方法A Ca (OH)2 (s) + H2O2 ⇌ CaO2 (s) + 2H2O
方法B CaCl2 (s) + H2O2 ⇌ CaO2 (s) + 2HCl
方法A所得产品中纯度不高,所含杂质主要是 ___________(填化学式)
如果不加入稳定剂,则两种方法都需在5℃以下进行实验,原因可能是______________。
(2)丙同学认为CO2、SO2与过氧化钙的反应原理相同,丁同学认为SO2具有较强的还原性,而CO2没有,故而反应原理不相同。他们设计了如下实验装置,通过测量装置E中所得气体体积判断反应情况:
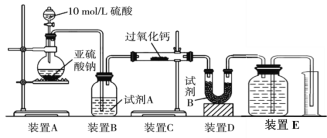
①试剂B的作用是____________________。
②若实验中SO2足量,且与过氧化钙充分反应,取反应后的固体进行探究,以验证过氧化钙与SO2反应的生成物。若SO2未被氧化,则反应的化学方程式为:______________________________。
③装置E中收集到的氧气体积为V L(已换算成标准状况下),若SO2完全被氧化,则V =______。
(3)某工厂利用电石渣(主要成分为氢氧化钙)生产过氧化钙的生产流程如下:

用上述方法制备过氧化钙(CaO2·8H2O),搅拌步骤的化学方程式是______________。
②某小组釆用单变量法确定温度、H2O2浓度对产率的影响,结果如下,则实际生产应选择的适宜条件为__________。
| H2O2 % | 30% | 25% | 20% | 15% | 10% | 5% |
| 产率 | 60.40 | 62.42 | 64.54 | 63.20 | 63.10 | 62.40 |
| 温度(℃) | 50 | 40 | 30 | 20 | 10 | 0 |
| 产率 | 43.24 | 52.80 | 64.54 | 63.80 | 60.45 | 52.40 |
| | | | | | | | | | | | |
-
过氧化钙可用于治理赤潮、应急供氧等。已知:过氧化钙,为白色或淡黄色结晶粉末,难溶于水,不溶于乙醇、乙醚等有机溶剂,常温下干燥品很稳定,能溶于稀酸生成过氧化氢。某小组同学探究过氧化钙的制法和性质:
(1)甲、乙两位同学设计的过氧化钙实验室制法如下,其中产率较低的是______(填A、B)
方法A Ca (OH)2 (s) + H2O2 ⇌ CaO2 (s) + 2H2O
方法B CaCl2 (s) + H2O2 ⇌ CaO2 (s) + 2HCl
方法A所得产品中纯度不高,所含杂质主要是 ___________(填化学式)
如果不加入稳定剂,则两种方法都需在5℃以下进行实验,原因可能是______________。
(2)丙同学认为CO2、SO2与过氧化钙的反应原理相同,丁同学认为SO2具有较强的还原性,而CO2没有,故而反应原理不相同。他们设计了如下实验装置,通过测量装置E中所得气体体积判断反应情况:

①试剂B的作用是____________________。
②若实验中SO2足量,且与过氧化钙充分反应,取反应后的固体进行探究,以验证过氧化钙与SO2反应的生成物。若SO2未被氧化,则反应的化学方程式为:______________________________。
③装置E中收集到的氧气体积为V L(已换算成标准状况下),若SO2完全被氧化,则V =______。
(3)某工厂利用电石渣(主要成分为氢氧化钙)生产过氧化钙的生产流程如下:

用上述方法制备过氧化钙(CaO2·8H2O),搅拌步骤的化学方程式是______________。
②某小组釆用单变量法确定温度、H2O2浓度对产率的影响,结果如下,则实际生产应选择的适宜条件为__________。
| H2O2 % | 30% | 25% | 20% | 15% | 10% | 5% |
| 产率 | 60.40 | 62.42 | 64.54 | 63.20 | 63.10 | 62.40 |
| 温度(℃) | 50 | 40 | 30 | 20 | 10 | 0 |
| 产率 | 43.24 | 52.80 | 64.54 | 63.80 | 60.45 | 52.40 |
| | | | | | | | | | | | |
-
(12分)纯净的过氧化钙(CaO2)难溶于水、乙醇,常温下较为稳定。CaO2·8H2O在0℃时稳定,加热至130℃时逐渐变为无水CaO2。在实验室可用钙盐制取CaO2·8H2O,再经脱水制得CaO2。其制备过程如下:
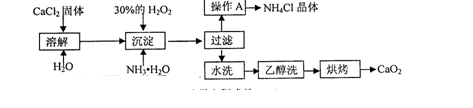
根据以上信息,同答下列问题:
(1)用上述方法制取CaO2·8H2O的化学方程式是________;
(2)操作A的步骤为________;
(3)检验“水洗”已经洗净的方法是________;
(4)测定产品中CaO2的含量的实验步骤是(己知:I2+2S2O32-=2I-+S4O62-):
第一步:准确称取a g产品于锥形瓶中,加入适量蒸馏水和过量的b g KI品体,再滴入适量2 mol·L-1的H2SO4溶液,充分反应:
第二步:向上述锥形瓶中加入几滴淀粉溶液:
第三步:逐滴加入浓度为c mol·L-1的Na2S2O3溶液至反应完全,消耗Na2S2O3溶液VmL。
①第三步反应完全时的现象为________;
②产品中CaO2的质量分数为________(用字母表示);
③某同学经实验测得产品中CaO2的质量分数偏高,造成偏高的原因是(测定过程中由操作产生的误差忽略不计,用离子方程式表示)________。
-
Ⅰ)纯净的过氧化钙(CaO2)难溶于水、乙醇,常温下较为稳定。CaO2·8H2O在0℃时稳定,加热至130℃时逐渐变为无水CaO2。在实验室可用钙盐制取CaO2·8H2O,再经脱水制得CaO2。其制备过程如下:

根据以上信息,回答下列问题:
⑴用上述方法制取CaO2·8H2O的化学方程式是_▲_;
⑵测定产品中CaO2的含量的实验步骤是(己知:I2+2S2O32-=2I-+S4O62-):
第一步:准确称取ag产品于锥形瓶中,加入适量蒸馏水和过量的bgKI品体,再滴入适量2mol·L-1的H2SO4溶液,充分反应:
第二步:向上述锥形瓶中加入几滴淀粉溶液:
第三步:逐滴加入浓度为cmol·L-1的Na2S2O3溶液至反应完全,消耗Na2S2O3溶液VmL。
①第三步反应完全时的现象为 ▲ ;
②产品中CaO2的质量分数为 ▲ (用字母表示);
③某同学经实验测得产品中CaO2的质量分数偏高,造成偏高的原因是(测定过程中由操作产生的误差忽略不计,用离子方程式表示) ▲ 。
Ⅱ)硫酸铜是一种重要的化工原料,工业上常用硫酸为原料来制备硫酸铜。
⑴工业上生产硫酸过程中,焙烧硫铁矿时产生的废渣是一种二次资源。
①为了从废渣中磁选获得品位合格的铁精矿,高温下利用CO使弱磁性Fe2O3转化为强磁性Fe3O4。写出该反应的化学方程式_ ▲ _;实验发现:CO太多或太少都会导致磁铁矿产率降低,原因是 ▲ 。
②氯化焙烧工艺是将废渣用氯化钙水溶液调和、成球、高温焙烧,废渣中SiO2与CaCl2等在高温下反应放出HCl,HCl与金属氧化物等反应生成氯化物。反应生成的各金属氯化物以气态形式逸出,进而回收有色金属和回返氯化钙溶液。写出氯化焙烧工艺中生成HCl的化学方程式 ▲ 。
⑵测定硫酸铜品体中结品水含量的实验步骤为:
步骤1:准确称量一个洁净、干燥的坩埚;
步骤2:将一定量的硫酸铜晶体试样研细后,放入坩埚中称重
步骤3:将盛有试样的坩埚加热,待晶体变成白色粉末时,停止加热;
步骤4:将步骤3中的坩埚放入干燥器,冷却至室温后,称重:
步骤5: ▲ ;
步骤6:根据实验数据计算硫酸铜晶体试样中结晶水的质量分数。
请完成实验步骤5。
(3)已知硫酸铜晶体受热可以逐步失去结晶水,温度升高还可以分解生成铜的氧化物。取25.0gCuSO4·5H2O晶体均匀受热,缓慢升温至1200℃并恒温1小时,实验测得固体残留率(剩余固体的质量/原始固体质量)与温度的关系如下图所示:

在110℃时所得固体的成分为 ▲ ;在1200℃并恒温1小时,反应所得气态产物除去水后,物质的量为 ▲ 。(填字母)
A.0mol B.0.1mol C.0.125mol D.大于0.125mol
-
过氧化钙(CaO2)常用作种子及谷物的无毒性消毒剂,常温下为白色的固体,微溶于水,且不溶于乙醇、乙醚和碱性溶液,但溶于酸。
某实验小组拟探究CaO2的性质及其实验室制法。
(1)实验探究CaO2与酸的反应。
| 操作 | 现象 |
| 向盛有4 g CaO2的大试管中加入10mL稀盐酸得溶液a | 剧烈反应,产生能使带火星木条复燃的气体 |
| 取5 mL溶液a于试管中,滴入两滴石蕊试液 | 溶液变红,一段时间后溶液颜色明显变浅,稍后,溶液变为无色 |
①CaO2与盐酸反应的化学方程式为_______________________________。
②加入石蕊试液后溶液褪色可能是因为溶液a中存在较多的_________。
(2)用如图所示装置制备过氧化钙,其反应原理为Ca+O2 CaO2。
CaO2。
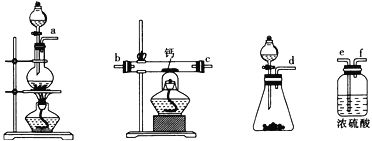
①请选择实验所需要的装置,按气流方向连接的顺序为______________________(填仪器接口的字母,上述装置可不选用也可重复使用)。
②根据完整的实验装置进行实验,实验步骤如下:Ⅰ.检验装置的气密性后,装入药品;Ⅱ.打开分液漏斗活塞,通入气体一段时间,加热药品;Ⅲ.反应结束后,_________________________________(填操作);Ⅳ.拆除装置,取出产物。
(3)利用反应:Ca2++ H2O2+2NH3+8H2O=CaO2·8H2O↓+2NH4+在碱性环境下制取CaO2的装置如图所示。
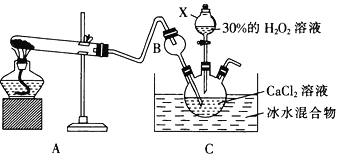
①NH3在Ca2+和H2O2的反应过程中所起的作用是______________________。
②反应结束后,经过滤、洗涤、低温烘干可获得CaO2·8H2O。过滤需要的玻璃仪器是_________;将沉淀进行洗涤的操作为_____________________________________________。
(4)设计实验证明CaO2的氧化性比FeCl3的氧化性强:____________________________。














