-
(8分)氨是一种重要的化工原料,氨的合成和应用是当前的重要研究内容之一。
传统哈伯法合成氨工艺中相关的反应式为:N2+3H2 2NH3 ⊿H<0。
2NH3 ⊿H<0。
(1)该反应的平衡常数K的表达式为:K=______________。降低温度,K值______(填“增大”“减小”或“不变”)。
(2)不同温度、压强下,合成氨平衡体系中NH3的物质的量分数见下表(N2和H2的起始物质的量之比为1∶3)。分析表中数据,________(填温度和压强)时H2转化率最高,实际工业生产不选用该条件的主要原因是________。
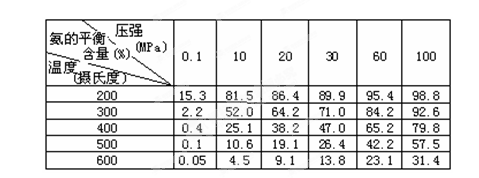
-
氨是一种重要的化工原料,氨的合成和应用是当前的重要研究内容之一。
(1)传统哈伯法合成氨工艺中相关的反应式为:


 。
。
①该反应的平衡常数K的表达式为:K=_________。升高温度,K值________(填“增大”“减小”或“不变”)。
②不同温度、压强下,合成氨平衡体系中NH3的物质的量分数见下表(N2和H2的起始物质的量之比为1:3)。分析表中数据,__________(填温度和压强)时H2转化率最高,实际工业生产不选用该条件的主要原因是________________。
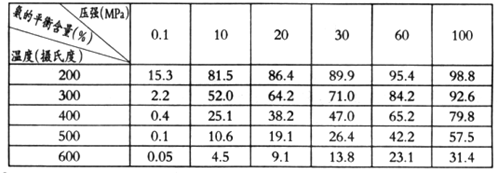
③下列关于合成氨说法正确是___________(填字母)
A. 使用催化剂可以提高氮气的转化率
B. 寻找常温下的合适催化剂是未来研究的方向
C. 由于△H<0、△S>0,故合成氨反应一定能自发进行
(2)最近美国Simons等科学家发明了不必使氨先裂化为氢就可直接用于燃料电池的方法。它既有液氢燃料电池的优点,又克服了液氢不易保存的不足。其装置为用铂黑作为电极,加入电解质溶液中,一个电极通人空气,另一电极通入氨气。其电池反应为
你认为电解质溶液应显______性(填“酸性”、“中性”、“碱性”),写出负极电极反应式________。
-
(12分)氨是一种重要的化工原料,氨的合成和应用是当前的重要研究内容之一。
(1)传统哈伯法合成氨工艺中相关的反应式为:N2(g)+3H2(g) 2NH3(g),ΔH<0
2NH3(g),ΔH<0
①该反应的平衡常数K的表达式为:K=___________。升高温度,K值______(填“增大”“减小”或“不变”)。
②不同温度、压强下,合成氨平衡体系中NH3的物质的量分数见下表(N2和H2的起始物质的量之比为1∶3)。分析表中数据, (填温度和压强)时H2转化率最高,实际工业生产中不选用该条件的主要原因是 。
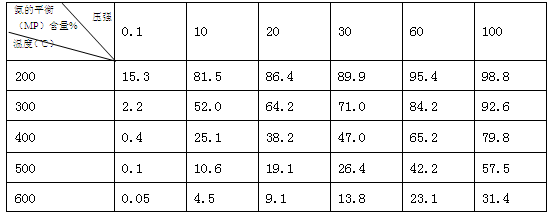
③下列关于合成氨说法正确是 (填字母)
A.使用催化剂可以提高氮气的转化率
B.寻找常温下的合适催化剂是未来研究的方向
C.由于ΔH<0、ΔS>0,故合成氨反应一定能自发进行
(2)最近美国Simons等科学家发明了不必使氨先裂化为氢就可直接用于燃料电池的方法。其装置为用铂黑作为电极,加入碱性电解质溶液中,一个电极通入空气,另一电极通入氨气。其电池反应为4NH3+3O2=2N2+6H2O,写出负极电极反应式 。
-
氨是一种重要的化工原料,氨的合成和应用是当前的重要研究内容之一。
传统哈伯法合成氨工艺中相关的反应式为:N2+3H2 2NH3 ⊿H<0。
2NH3 ⊿H<0。
该反应的平衡常数K的表达式为:K=______________。升高温度,K值______(填“增大”“减小”或“不变”)。
-
二氧化碳在石油开采、人工降雨、消防、有机合成等领域有着广泛的应用。
(1)甲醇是重要的化工原料。利用合成气(CO、CO2、H2)在催化剂作用下合成甲醇,已知反应相关的化学键键能数据如下:
| 化学键 | H-H | C-O | C=O | H-O | C-H |
| E/(KJ/mol) | 436 | 343 | 803 | 465 | 413 |
写出CO2和H2在催化剂作用下生成CH3OH(g)和H2O(g)的热化学方程式________
(2)CH4超干重整CO2的催化转化原理示意图如图所示:
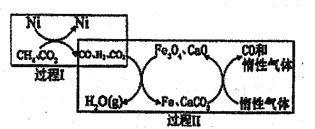
①过程Ⅰ,生成1molH2时吸收123.5kJ热量,其热化学方程式是_______
②过程Ⅱ,实现了含然物种与含碳物种的分离,生成H2O(g)的化学方程式是________
-
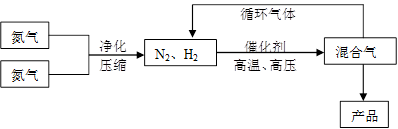
(15分)氨是最重要的氮肥,是产量最大的化工产品之一。课本里介绍的合成氨技术叫哈伯法,是德国人哈伯在1905年发明的,其合成原理为:N2(g)+3H2(g)  2NH3(g);△H<0他因此获得了1918年诺贝尔化学奖。工业上合成氨的部分工艺流程如下:
2NH3(g);△H<0他因此获得了1918年诺贝尔化学奖。工业上合成氨的部分工艺流程如下:
| 气体 | 氮气 | 氢气 | 氨 |
| 熔点(℃) | -210.01 | -252.77 | -77.74 |
| 沸点(℃) | -195.79 | -259.23 | -33.42 |
反应体系中各组分的部分性质见上表:
(1)合成氨反应的平衡常数很小,所以在工业上采取气体循环的流程。即反应后通过把混合气体的温度降低到________℃使混合气体分离出来产品;继续循环的气体是________。
(2)工业上采取用上述(1)操作的目的:________
________。
(3)已知拆开1molH-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为________________________________。
(4)合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的反应: N2(g)+3H2(g) 2NH3(g),在673K,30MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是
2NH3(g),在673K,30MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是
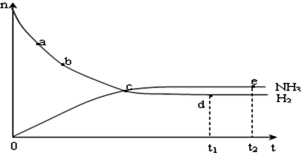
A.点a的正反应速率比点b的大
B.点 c处反应达到平衡
C.点d (t1时刻) 和点 e (t2时刻) 处n(N2)不一样
D.其他条件不变,773K下反应至t1时刻, n(H2)比上图中d点的值大
-
合成气(CO和H2)是重要的化工原料,在工业生产中有着广泛的应用。
(1)工业上用甲烷和水蒸气在高温条件下发生反应制备合成气(CO和H2),4g甲烷完全反应吸收51.5KJ热量,写该反应的热化学方程式
(2)工业上常用合成气来冶炼金属,其中CO还原氧化铁来冶炼生铁方程式如下:
3CO(g)+Fe2O3(s)  3CO2(g)+ 2Fe(s) △H<0
3CO2(g)+ 2Fe(s) △H<0
①如果上述反应在体积不变的密闭容器中发生,当反应达到平衡时, 。
A.容器中Fe2O3的质量不随时间而变化 B.反应物不再转化为生成物
C.n (CO) :n (CO2) = 1:1 D.容器中气体的压强不随时间而变化
②在一个容积为4L的密闭容器中,1000℃时加入4mol CO(g)和足量Fe2O3(s),反应2分钟后达到平衡,测得此时容器内气体的密度为40g/L,求该时间范围内反应的平均反应速率υ(CO2)= ___、CO的平衡转化率= _____、该反应的化学平衡常数K= 。
-
合成气(CO和H2)是重要的化工原料,在工业生产中有着广泛的应用.
(1)工业上用甲烷和水蒸气在高温条件下发生反应制备合成气(CO和H2),4g甲烷完全反应吸收51.5KJ热量,写该反应的热化学方程式______
(2)已知:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-802kJ•mol-1,由反应(1)制备的合成气10m3(已折成标况),完全燃烧所提供的能量为______kJ
(3)工业上常用合成气来冶炼金属,其中CO还原氧化铁来冶炼生铁方程式如下:
3CO(g)+Fe2O3(s)═3CO2(g)+2Fe(s)△H<0
①如果上述反应在体积不变的密闭容器中发生,当反应达到平衡时,______.
A.容器中Fe2O3的质量不随时间而变化 B.反应物不再转化为生成物
C.n (CO):n (CO2)=1:1 D.容器中气体的压强不随时间而变化
②在一个容积为4L的密闭容器中,1000℃时加入4mol CO(g)和足量Fe2O3(s),反应2分钟后达到平衡,测得此时容器内气体的密度为40g/L,求该时间范围内反应的平均反应速率υ(CO2)=______、CO的平衡转化率=______、该反应的化学平衡常数K=______.
③如果在3分钟时向②的平衡体系中再加入2mol CO(g),其它条件不变,经过2分钟反应又达到平衡.请画出②、③c(CO)、c(CO2) 随时间变化的图象.
-
氨是重要的氮肥,是产量较大的化工产品之一。课本里介绍的合成氨技术称为哈伯法,是德国人哈伯在1905年发明的,其合成原理为:
N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1
2NH3(g) ΔH=-92.4 kJ·mol-1
他因此获得了1918年诺贝尔化学奖。试回答下列问题:
(1)合成氨工业中采取的下列措施可用勒夏特列原理解释的是________。
A.采用较高压强
B.采用500 ℃的高温
C.用铁触媒作催化剂
D.将生成的氨液化并及时从体系中分离出来,剩余N2和H2循环到合成塔
中,并补充N2和H2
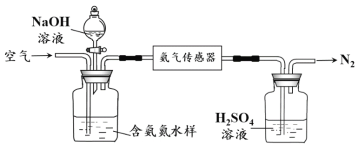
(2)下图是实验室模拟工业合成氨的简易装置,简述检验有氨气生成的方法:
_________________________________________________________________。
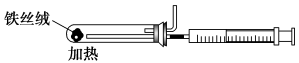
(3)在298 K时,将10 mol N2和30 mol H2通入合成塔中,放出的热量小于924kJ,原因是______________________________
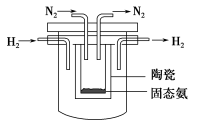
(4)1998年希腊亚里斯多德大学的Marmellos和Stoukides采用高质子导电性
的SCY陶瓷(能传递H+),实现了高温、常压下高转化率的电化学合成氨。其
实验装置如下图,则其阴极的电极反应式为____________________________。
-
甲烷作为一种新能源在化学领域应用广泛,请回答下列问题:
(1)以天然气为原料制H2是合成氨的一条重要的路线。甲烷的部分氧化可得到合成氨的原料气H2,其反应式如下:①CH (g)+1/2O
(g)+1/2O (g)══CO(g)+2H
(g)══CO(g)+2H (g) ΔH1=-35.6kJ·mol
(g) ΔH1=-35.6kJ·mol ,试判断常温下,上述反应能否自发进行:___________(填”能”或”否”)。
,试判断常温下,上述反应能否自发进行:___________(填”能”或”否”)。
有研究认为甲烷部分氧化的机理为:
②CH (g)+2O
(g)+2O (g)=CO2(g)+2H2O(g) ΔH2=-890.3kJ·mol
(g)=CO2(g)+2H2O(g) ΔH2=-890.3kJ·mol ;
;
③CH (g)+CO
(g)+CO (g)=2CO(g)+2H
(g)=2CO(g)+2H (g) ΔH3=+247.3kJ·mol
(g) ΔH3=+247.3kJ·mol ,请结合以上三个反应与条件写出CH4和H2O(g)生成CO和H2的热化学反应方程式:________________________________。
,请结合以上三个反应与条件写出CH4和H2O(g)生成CO和H2的热化学反应方程式:________________________________。
(2)恒温下,向一个2L的密闭容器中充入1 mol N2和2.6 molH2,反应过程中对NH3的浓度进行检测,得到的数据如下表所示:
| 时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
| c(NH3)/( mol ·/L-1) | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |
此条件下,该反应达到化学平衡时,氮气的浓度为_______________。
(3)如下图所示,装置Ⅰ为甲烷燃料电池(电解质溶液为KOH溶液),通过装置Ⅱ实现铁棒上镀铜。
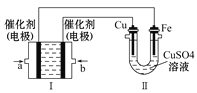
①b处电极上发生的电极反应式是_____________________________。
②电镀结束后,装置Ⅰ中溶液的pH___________(填写“变大”、“变小”或“不变”,下同),装置Ⅱ中Cu 的物质的量浓度___________________。
的物质的量浓度___________________。
③若完全反应后,装置Ⅱ中阴极质量增加12.8g,则装置Ⅰ中理论上消耗甲烷_________L (标准状况下)。
 2NH3(g) △H=-92kJ·mol-1,工业合成氨温度选择700K的原因是________。
2NH3(g) △H=-92kJ·mol-1,工业合成氨温度选择700K的原因是________。