-
铬是一种银白色金属,化学性质稳定,在化合物中常见价态为+2、+3和+6价等。工业上以铬铁矿(主要成分为FeO·Cr2O3,含有Al2O3、SiO2等杂质)为主要原料生产金属铬和重铬酸钠Na2Cr2O7·2H2O(已知Na2Cr2O7是一种强氧化剂) ,其主要工艺流程如图所示:
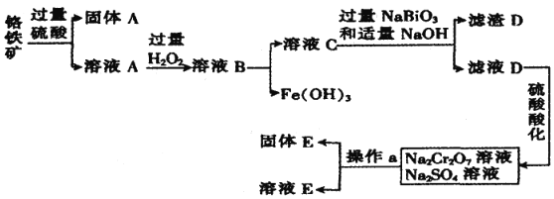
查阅资料得知:常温下,NaBiO3不溶于水有强氧化性,在碱性条件下能将Cr3+转化为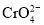 。回答下列问题:
。回答下列问题:
(1)工业上常采用热还原法制备金属铬,写出以Cr2O3为原料,利用铝热反应制取金属铬的化学方程式:____________。
(2)酸化滤液D时,不选用盐酸的原因是____________ 。
(3)固体E的主要成分是Na2SO4,根据工艺流程图分析操作a为______、_____、洗涤、干燥。
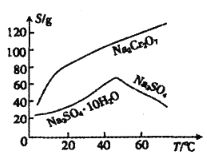
(4)已知含+6价铬的污水会污染环境,电镀厂产生的镀铜废水中往往含有一定量的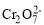 。
。
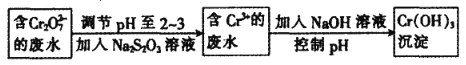
①Cr(OH)3的化学性质与Al(OH)3 相似。在上述生产过程中加入NaOH溶液时要控制溶液的pH不能过高,是因为________(用离子方程式表示)。
②下列溶液中可以最佳代替上述流程中Na2S2O3溶液的是_______(填字母)。
A.FeSO4溶液 B.浓H2SO4 C.酸性KMnO4溶液 D.Na2SO3溶液
③上述流程中,每消耗0.1 mol Na2S2O3转移0.8 mol e-,则加入Na2S2O3溶液时发生反应的离子方程式为__________________。
-
工业上以铬铁矿(主要成分为FeO•Cr2O3)、碳酸钠、氧气、和硫酸为原料生产重铬酸钠(Na2Cr2O7•2H2O),其主要反应为:
(1)4FeO•Cr2O3+8Na2CO3+7O2 8Na2CrO4+2Fe2O3+8CO2
8Na2CrO4+2Fe2O3+8CO2
(2)2Na2CrO4+H2SO4 Na2SO4+Na2Cr2O7+H2O
Na2SO4+Na2Cr2O7+H2O
下列说法正确的是( )
A. 反应(1)和(2)均为氧化还原反应
B. 反应(1)的氧化剂是O2,还原剂是FeO•Cr2O3
C. 高温下,O2的氧化性强于Fe2O3,弱于Na2CrO4
D. 反应(1)中每生成1molNa2CrO4时电子转移3mol
-
重铬酸钾(K2Cr2O7)是工业生产和实验室的重要氧化剂,工业上常用铬铁矿(主要成分为FeO·Cr2O3)为原料生产重铬酸钾。实验室模拟工业法用铬铁矿制K2Cr2O7的主要工艺如下图所示。反应器中涉及的主要反应是:6 FeO·Cr2O3 + 24NaOH + 7KClO3 = 12Na2CrO4 + 3Fe2O3 + 7KCl + 12H2O
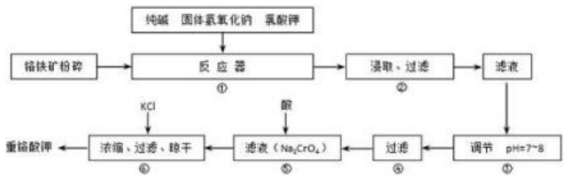
试回答下列问题:
(1)在反应器①中,有Na2CrO4生成,同时Fe2O3转变为NaFeO2,杂质SiO2、Al2O3与纯碱反应的原理相同均转变为可溶性盐。写出氧化铝与碳酸钠反应的化学方程式:______________________。
(2)操作⑤中加酸酸化后CrO42-转化为Cr2O72-,写出转化的离子方程式:_________________。
(3)步骤③中测定pH值的操作为:________________。
(4)某同学设计的检验上述工艺流程④的滤渣中Fe、Al、Si元素成分的探究实验如下,请帮助完成该实验,并填写表中空格:
| 操作步骤 | 实验现象 | 结论 |
| ①取滤渣样少量于试管中,加足量稀HCl,搅拌,静置。 | 试管中仍有固体物质 | 固体为_____________ |
| ②操作①后,过滤;在滤液中加入过量的____________。 | 有红褐色沉淀产生 | 沉淀为Fe (OH)3 |
| ③将操作②后的红褐色沉淀滤去,在滤液中通入足量CO2。 | _____________ | 生成物为Al (OH)3; |
(5)称取重铬酸钾(其式量为294)试样2.5000 9配成250 mL溶液,用移液管取出25. 00 mL于碘量瓶中,加入10 mL 2 mol/L H2SO4和足量碘化钾(铬的还原产物为Cr3+),放置于暗处5 min,然后加入100 mL水,加入3 mL淀粉指示剂,用0.1200 mol/L Na2S2O3标准溶液滴定(I2+2S2O32-=2I-+S4O62-)。
①配制溶液时所需的玻璃仪器除烧杯、玻璃棒外,还需________和________________。
②若实验中共用去Na2S2O3标准溶液40. 00 mL,则所得产品中重铬酸钾的纯度为(设整个过程中其他杂质不参与反应)____________。(保留2位小数)
-
工业上以铬铁矿(主要成分为FeO·Cr2O3)、碳酸钠、氧气和硫酸为原料生产重铬酸钠(Na2Cr2O7),其主要反应为
①4FeO·Cr2O3+8Na2CO3+7O2 8Na2CrO4+2Fe2O3+8CO2
8Na2CrO4+2Fe2O3+8CO2
②2Na2CrO4+H2SO4 Na2SO4+Na2Cr2O7+H2O
Na2SO4+Na2Cr2O7+H2O
下列说法中正确的是( )
A. 反应①和②均为氧化还原反应
B. 反应①,转移4 mol电子时,被氧化的为O2为1mol
C. 反应①的氧化剂是O2,还原剂是FeO·Cr2O3
D. 生成1 mol Na2Cr2O7时共转移5 mol电子
-
红矾钠(Na2Cr2O7·2H2O)是重要的化工原料,工业上用铬铁矿(主要成分是FeO·Cr2O3)制备红矾钠的过程中会发生如下反应:
4FeO(s)+4Cr2O3(s)+8Na2CO3(s)+7O2(g)  8Na2CrO4(s)+2Fe2O3(s)+8CO2(g) ΔH<0
8Na2CrO4(s)+2Fe2O3(s)+8CO2(g) ΔH<0
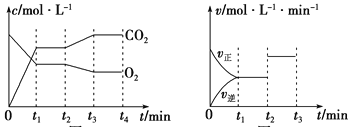
(1)如图为上述反应的浓度—时间图像,由图像判断反应进行至t2时刻时,改变的条件是_________________________,如图为上述反应的速率—时间图像,表示上述反应在t1时达到平衡, 在t2时因改变某个条件而使曲线发生变化。由图判断,t2时刻曲线变化的原因可能是________(填写序号)。
a.升高温度 b.加催化剂
c.通入O2 d.缩小容器体积
(2)工业上可利用上述反应的副产物CO2来生产甲醇:CO2(g)+3H2(g)  CH3OH(g)+H2O(g)。
CH3OH(g)+H2O(g)。
①一定温度下,在容积为1L的密闭容器中,充入2 mol CO2和4 mol H2,一段时间后达到平衡,测得CH3OH的物质的量浓度为1mol/L,则该温度下此反应的平衡常数为_________,某时刻测得CO2、H2、CH3OH和H2O的物质的量分别为2mol,1mol,1mol,1mol,则这一时刻v(正)___________v(逆)
②在T1温度时,将1 mol CO2和3 mol H2充入一密闭容器中,充分反应达到平衡后,CO2转化率为α,则容器内的压强与起始压强之比为_______________。
-
红矾钠(Na2Cr2O7·2H2O)是重要的化工原料,工业上用铬铁矿(主要成分是FeO·Cr2O3)制备红矾钠的过程中会发生如下反应:4FeO(s)+4Cr2O3(s)+8Na2CO3(s)+7O2(g)  8Na2CrO4(s)+2Fe2O3(s)+8CO2(g) ΔH<0
8Na2CrO4(s)+2Fe2O3(s)+8CO2(g) ΔH<0
(1)请写出上述反应的化学平衡常数表达式:K=__________________。
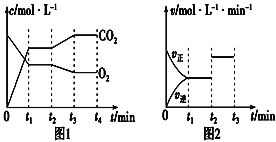
(2)图1、图2表示上述反应在t1时达到平衡、在t2时因改变某个条件而发生变化的曲线。由图1判断,反应进行至t2时,曲线发生变化的原因是___________________(用文字表达);由图2判断,t2到t3的曲线变化的原因可能是________(填写序号)。
a.升高温度 b.加催化剂 c.通入O2 d.缩小容器体积
(3)工业上可用上述反应中的副产物CO2来生产甲醇:CO2(g)+3H2(g)  CH3OH(g)+H2O(g)。
CH3OH(g)+H2O(g)。
①已知该反应能自发进行,则下列图像正确的是___________。
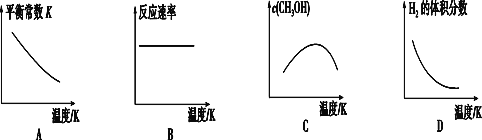
②在T1温度时,将1 mol CO2和3 mol H2充入一密闭容器中,反应达到平衡后,CO2转化率为α,则容器内平衡时的压强与起始压强之比为________。
-
(共12分)红矾钠(重铬酸钠:Na2Cr2O7·2H2O)是重要的化工原料,工业上用铬铁矿(主要成分是FeO·Cr2O3)制备红矾钠的过程中会发生如下反应:4FeO(s)+Cr2O3(s)+8Na2CO3(s)+7O2(g) 8Na2CrO4(s)+2Fe2O3(s)+8CO2(g) ΔH<0
8Na2CrO4(s)+2Fe2O3(s)+8CO2(g) ΔH<0
(1)请写出上述反应的化学平衡常数表达式:K=__________________。
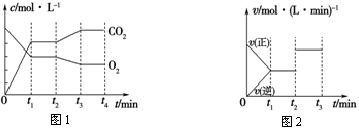
(2)图1、图2表示上述反应在t1时达到平衡,在t2时因改变某个条件而发生变化的曲线。
由图1判断,反应进行至t2时,曲线发生变化的原因是________________(用文字表达);
由图2判断,t2到t3的曲线变化的原因可能是________(填写序号)。
a.升高温度 b.加了催化剂 c.通入O2 d.缩小容器体积
(3)工业上可用上述反应中的副产物CO2来生产甲醇:CO2(g)+3H2(g) CH3OH(g)+H2O(g),
CH3OH(g)+H2O(g),
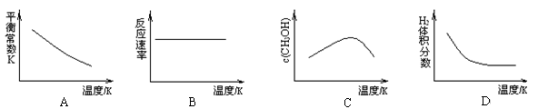
①已知该反应能自发进行,则下列图像正确的是________________
②在容积为2L的密闭容器中,由CO2和H2合成甲醇,在其他条件不变得情况下,考查温度对反应的影响,实验结果如图所示(注:T1、T2均大于300℃);下列说法正确的是______(填序号)
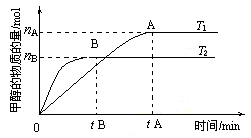
A.温度为T1时,从反应开始到平衡,生成甲醇的平均速率:v(CH3OH)= mol·L-1·min-1
mol·L-1·min-1
B.该反应在T1时的平衡常数比T2时的小
C.该反应为放热反应
D.处于A点的反应体系从T1变到T2,达到平衡时 增大
增大
③在T1温度时,将1molCO2和3molH2充入一密闭恒容器中,充分反应达到平衡后,CO2转化率为a,则容器内的压强与起始压强之比为___________。
-
以铬铁矿(主要成分为FeO·Cr2O3,还含有Al2O3等杂质)为原料制备金属铬的工艺流程如图所示:
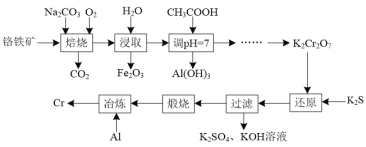
(1)“焙烧”后所得固体为Na2CrO4、Fe2O3和NaAlO2。
①“焙烧”时FeO·Cr2O3发生反应的化学方程式为____。
②“焙烧”时Al2O3发生反应的化学方程式为____。
(2)“调pH=7”时生成Al(OH)3的离子方程式为____。
(3)“过滤”所得滤渣为Cr(OH)3,“还原”反应的离子方程式为____。
(4)“冶炼”时的化学方程式为____。
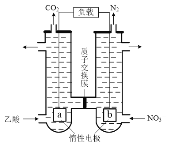
(5)含醋酸的酸性废水可用图2所示方法处理,写出负极的电极反应式:____。
-
铬是一种具有战略意义的金属,它具有多种价态,单质铬熔点为1857 ℃。
(1)工业上以铬铁矿[主要成分是Fe(CrO2)2]为原料冶炼铬的流程如图所示:
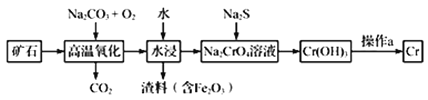
①Fe(CrO2)2中各元素化合价均为整数,则铬为_______价。
②高温氧化时反应的化学方程式为______________。
(2)Cr(OH)3是两性氢氧化物,请写出其分别与NaOH、稀硫酸反应时生成的两种盐的化学式______________。
(3)铬元素能形成含氧酸及含氧酸盐,若测得初始浓度为1 mol/L的铬酸(H2CrO4)溶液中各种含铬元素的微粒浓度为:c(CrO42-)=0.0005 mol/L、c(HCrO4-)=0.1035 mol/L、c(Cr2O72-)=a mol/L、则a =____,KHCrO4溶液中c(OH−)_____c(H+)(填“>”、“<”或“=”),原因是__________________。
(4)水中的铬元素对水质及环境均有严重的损害作用,必须进行无害化处理。处理含有Cr2O72-的污水方法通常为:用铁作电极电解污水,Cr2O72-被阳极区生成的离子还原成为Cr3+,生成的Cr3+与阴极区生成的OH−结合生成Cr(OH)3沉淀除去。则阴极上的电极反应式为_____,若要处理含10 mol Cr2O72-的污水,则至少需要消耗的铁为_______g。
-
工业上以铬铁矿(主要成分为FeO·Cr2O3)、碳酸钠、氧气和硫酸为原料生产重铬酸钠(Na2Cr2O7·2H2O),其主要反应为:
(1)4(FeOCr2O3)8Na2CO37O2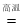 8Na2CrO42Fe2O38CO2
8Na2CrO42Fe2O38CO2
(2)2Na2CrO4H2SO4Na2SO4Na2Cr2O7H2O
下列说法中正确的是( )
A.反应(1)和(2)均为氧化还原反应
B.反应(1)中FeO·Cr2O3既是氧化剂又是还原剂
C.高温下O2的氧化性大于Fe2O3小于Na2CrO4
D.生成1mol的Na2Cr2O7时转移7mol电子

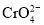 。回答下列问题:
。回答下列问题:
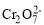 。
。










 8Na2CrO42Fe2O38CO2
8Na2CrO42Fe2O38CO2