-
(1)2017年5月,我国在南海成功开采“可燃冰”(甲烷水合物),标志着在技术方面取得了突破性进展。甲烷是优质的清洁能源,综合开发利用能有效缓解大气污染问题。
已知:CH4(g)+2O2(g)=CO2(g) +2H2O(g) ΔH =- 802 kJ·mol-1
2CO(g)+O2(g)=2CO2(g) ΔH =-566kJ·mol-1
H2O(g)=H2O(l) ΔH =- 44kJ·mol-1
则1mol CH4(g)不完全燃烧生成CO和H2O(l) 的热化学方程式为:________________。
(2)甲烷转化为CO和H2的反应为:CH4(g)+H2O(g) CO(g)+3H2(g) ΔH>0。
CO(g)+3H2(g) ΔH>0。
①一定条件下,CH4的平衡转化率与温度、压强的关系如下图1所示。则P1________P2(填“<”、“>”或“=”) ;A、B、C 三点处对应的平衡常数(KA、KB、KC)由大到小的顺序为___________________。
②将CH4和H2O(g)按等物质的量混合,一定条件下反应达到平衡,CH4转化率为50%。则反应前与平衡后,混合气体的平均相对分子质量之比为________________。
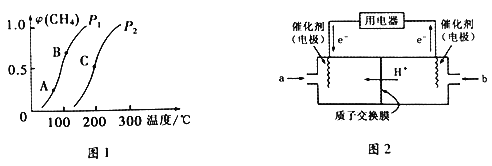
(3)甲烷燃料电池工作原理如上图2所示。a气体是______________,b气体通入电极的反应式为__________。
-
(1)2017年5月,我国在南海成功开采“可燃冰”(甲烷水合物),标志着在技术方面取得了突破性进展。甲烷是优质的清洁能源,综合开发利用能有效缓解大气污染问题。
已知:CH4(g)+2O2(g)=CO2(g) +2H2O(g) ΔH =- 802 kJ·mol-1
2CO(g)+O2(g)=2CO2(g) ΔH =-566kJ·mol-1
H2O(g)=H2O(l) ΔH =- 44kJ·mol-1
则1mol CH4(g)不完全燃烧生成CO和H2O(l) 的热化学方程式为:___________________________。
(2)甲烷转化为CO和H2的反应为:CH4(g)+H2O(g) CO(g)+3H2(g) ΔH>0。
CO(g)+3H2(g) ΔH>0。
①一定条件下,CH4的平衡转化率与温度、压强的关系如下图1所示。则P1________P2(填“<”、“>”或“=”) ;A、B、C 三点处对应的平衡常数(KA、KB、KC)由大到小的顺序为___________________。
②将CH4和H2O(g)按等物质的量混合,一定条件下反应达到平衡,CH4转化率为50%。则反应前与平衡后,混合气体的平均相对分子质量之比为________________。
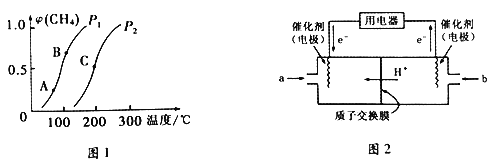
(3)甲烷燃料电池工作原理如上图2所示。a气体是______________,b气体通入电极的反应式为__________。用该燃料电池作电源、以石墨作电极电解硫酸铜溶液,一段时间后,若将0.1mol Cu2(OH)2CO3溶解于该溶液,恰好使溶液恢复至起始成分和浓度,则燃料电池中理论上消耗CH4的体积(标准状况)为_________________。
(4)25℃时,H2CO3的电离常数分别为:Ka1=4.4×10-7mol·L-1;Ka2=5.0×10-11 mol·L-1。在20mL0.1 mol·L-1Na2CO3溶液中逐滴加入0.1 mol·L-1HCl溶液20mL,所得溶液pH=8。此溶液中各阴离子的物质的量浓度大小关系为__________________, =__________________。
=__________________。
-
化学在能源开发与利用中起着十分重要的作用。
(1)蕴藏在海底的可燃冰是高压下形成的外观像冰的甲烷水合物固体。2017年我国在南海北部进行的可燃冰采取试验获得成功,标志着我国成为第一个实现在海域可燃冰试开采中获得连续稳定燃气的国家。已知:25℃、101 kPa下,1 g甲烷完全燃烧生成CO2和液态水时放热55.6kJ。甲烷燃烧的热化学方程式为_____________。相同条件下,356 g可燃冰(分子式为CH4·9H2O,Mr= 178 )释放的甲烷气体完全燃烧生成CO2和液态水,放出的热量为_____kJ。
(2)二甲醚(CH3OCH3)是无色气体,可作为一种新型能源,具有清洁、高效的优良性能。由合成气(组成为H2、CO和少量的CO2)直接制备二甲醚,其中的主要过程包括以下四个反应:
甲醇合成反应:(i)CO(g)+ 2H2(g)  CH3OH(g) △H1=-90.1 kJ/ mol
CH3OH(g) △H1=-90.1 kJ/ mol
(ii)CO2(g) + 3H2(g)  CH3OH(g)+ H2O(g) △H2=-49.0kJ/ mol
CH3OH(g)+ H2O(g) △H2=-49.0kJ/ mol
水煤气变换反应: (iii) CO(g)+ H2O(g)  CO2(g) + H2(g) △H3=-41.1kJ/mol
CO2(g) + H2(g) △H3=-41.1kJ/mol
二甲醚合成反应:(iv) 2CH3OH(g)  CH3OCH3(g) + H2O(g) △H4= -24.5kJ/ mol
CH3OCH3(g) + H2O(g) △H4= -24.5kJ/ mol
①分析二甲醚合成反应(iv)对于CO转化率的影响____________________。
②由H2和CO直接制备二甲醚(另一产物为水蒸气)的热化学方程式为:______________。 根据化学反应原理,分析增加压强对直接制备二甲醚反应的影响__________________________。
(3)二甲醚直接燃料电池具有启动快、效率高等优点。若电解质为碱性,二甲醚直接燃料电池的负极反应为____ ,一个二甲醚分子经过电化学氧化,可以产生______个电子的电量。
-
2017年5月18日国土资源部中国地质调查局宣布,我国正在南海北部神孤海域进行的可燃冰试采获得成功,这也标志着我国成为全球第一个实现了在海域可燃冰试开采中获得连续稳定产气的国家。可燃冰中甲烷含虽为80%~99.9%,甲烷的用途很广,可用来作为燃料及制造氢气、一氧化碳、甲醇等物质的原料。
回答下列问题:
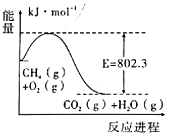
(l)甲烷可用作燃料。右图是lmolCH4在O2充分燃烧生成CO2气体与水蒸气过程中能量变化示意图,已知H2O(l)=H2O(g) △H=+44.0kJ/mol,则1molCH4在O2充分燃烧生成CO2气体与液态水的热化学方程式为_________。
(2)甲烷可以合成甲醇来代替日益供应紧张的燃油。工业上用甲烷为原料制备甲醇分为两个阶段:
① 制备合成气:CH4(g)+H2O(g) CO(g)+3H2(g)。在恒温恒容的密闭容器中,下列各项能作为判断该反应达到化学平衡状态依据的是______(填标号)。
CO(g)+3H2(g)。在恒温恒容的密闭容器中,下列各项能作为判断该反应达到化学平衡状态依据的是______(填标号)。
a.v(CH4)正=3v(H2)逆
b.混合气体的密度不发生变化
c.容器内混合气体的总压强不发生变化
d.混合气体的平均摩尔质且不发生变化
② 合成甲醇:CO(g)+2H2(g) CH3OH(g)。实验室在恒温(500℃)、恒容(1L)密闭容器中进行模拟合成实验。将lmolCO和2molH2通入容器中,l0min、40min、50min时分别测得容器中甲醇的浓度为0.60mol/L、0.80mol/L、0.80mol/L。则此条件下该反应开始10min内,H2的平均反应速率为_______;平衡常数K的数值为________。
CH3OH(g)。实验室在恒温(500℃)、恒容(1L)密闭容器中进行模拟合成实验。将lmolCO和2molH2通入容器中,l0min、40min、50min时分别测得容器中甲醇的浓度为0.60mol/L、0.80mol/L、0.80mol/L。则此条件下该反应开始10min内,H2的平均反应速率为_______;平衡常数K的数值为________。
(3)甲烷可以用作如图燃料电池的燃料。
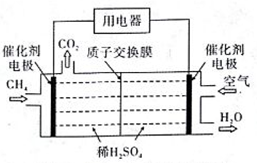
① 负极的电极反应式为_______。
② 常温下,用此电池电解0.5L饱和食盐水(足量),若两极(均为惰性电极)共生成气体l.12L (已折算为标准状况下的体积),则电解后溶液的pH为_______(忽略溶液的体积变化)。
-
我国在南海北部神弧海域进行的可燃冰试采成功,这标志着我国成为全球第一个实现了在海域可燃冰试开采中获得连续稳定产气的国家。可燃冰主要成分是甲烷,可以用作燃料和制氢原料。甲烷自热重整是先进的制氢方法,包含甲烷氧化和蒸气重整两个过程。发生的主要反应如下:
| 化学方程式 | 焓变ΔH/(kJ·mol-1) | 活化能Ea/(kJ·mol-1) |
| 甲烷氧化 | CH4(g)+2O2(g) CO2(g)+2H2O(g) CO2(g)+2H2O(g) | -802.6 | 125.6 |
| CH4(g)+O2(g) CO2(g)+2H2(g) CO2(g)+2H2(g) | -322.0 | 172.5 |
| 蒸气重整 | Ⅰ.CH4(g)+H2O(g) CO(g)+3H2(g) CO(g)+3H2(g) | +206.2 | 240.1 |
| Ⅱ.CH4(g)+2H2O(g) CO2(g)+4H2(g) CO2(g)+4H2(g) | +165 | 243.9 |
下列说法不正确的是
A.CO(g)+H2O(g) CO2(g)+H2(g) ΔH=+41.2kJ·mol-1
CO2(g)+H2(g) ΔH=+41.2kJ·mol-1
B.反应Ⅱ逆反应活化能Ea=78.9kJ·mol-1
C.初始阶段:甲烷氧化的速率大于甲烷蒸气重整的速率
D.甲烷自热重整方法的突出优点是能量循环利用
-
2017年5月18日中共中央国务院公开致电祝贺南海北部神狐海域进行的“可燃冰”试采成功。“可燃冰”是天然气水合物,外形像冰,在常温常压下迅速分解释放出甲烷,被称为未来新能源。
(1)“可燃冰”作为能源的优点是__________(回答一条即可)。
(2)甲烷自热重整是先进的制氢方法,包含甲烷氧化和蒸汽重整两个过程。向反应系统同时通入甲烷,氧气和水蒸气,发生的主要化学反应如下:
| 反应过程 | 化学方程式 | 焓变△H(kJ.mol-l) | 活化能E.(kJ.mol-1) |
| 甲烷氧化 | CH4(g)+O2(g) CO(g )+2H2O(g) CO(g )+2H2O(g) | -802.6 | 125.6 |
| CH4(g)+O2(g) CO2(g )+2H2(g) CO2(g )+2H2(g) | -322.0 | 172. 5 |
| 蒸气重整 | CH4(g)+H2O(g) CO(g)+3H2(g) CO(g)+3H2(g) | +206.2 | 240.1 |
| CH4(g)+2H2O(g) CO2(g)+4H2(g) CO2(g)+4H2(g) | + 158. 6 | 243.9 |
回答下列问题:
①在初始阶段,甲烷蒸汽重整的反应速率______(填“大于”“小于”或“等于”)甲烷氧化的反应速率。
②反应CH4(g)+H2O(g) CO(g)+3H2(g) 的平衡转化率与温度、压强关系[其中n(CH4):n(H2O)=1:1]如图所示。
CO(g)+3H2(g) 的平衡转化率与温度、压强关系[其中n(CH4):n(H2O)=1:1]如图所示。
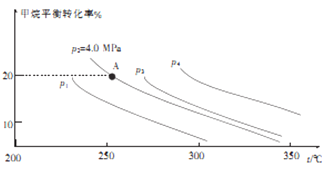
该反应在图中A点的平衡常数Kp=________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数),图中压强(p1、p2、p3、p4)由大到小的顺序为___________。
③从能量角度分析,甲烷自热重整方法的先进之处在于___________。
④如果进料中氧气量过大,最终会导致H2物质量分数降底,原因是__________。
(3)甲烷超干重整CO2技术可得到富含CO的气体,其能源和开境上的双重意义重大,甲烷超干重整CO2的催化转化原理如图所示。
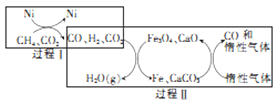
①过程II中第二步反应的化学方程式为_____________。
②只有过程I投料比 _______,过程II中催化剂组成才会保持不变。
_______,过程II中催化剂组成才会保持不变。
③该技术总反应的热化学方程式为______________。
-
2017年5月18日中共中央国务院公开致电祝贺南海北部神狐海域进行的“可燃冰”试采成功。“可燃冰”是天然气水合物,外形像冰,在常温常压下迅速分解释放出甲烷,被称为未来新能源。
(1)“可燃冰”作为能源的优点是__________(回答一条即可)。
(2)甲烷自热重整是先进的制氢方法,包含甲烷氧化和蒸汽重整两个过程。向反应系统同时通入甲烷,氧气和水蒸气,发生的主要化学反应如下:
| 反应过程 | 化学方程式 | 焓变△H(kJ.mol-l) | 活化能E.(kJ.mol-1) |
| 甲烷氧化 | CH4(g)+O2(g) CO(g )+2H2O(g) CO(g )+2H2O(g) | -802.6 | 125.6 |
| CH4(g)+O2(g) CO2(g )+2H2(g) CO2(g )+2H2(g) | -322.0 | 172. 5 |
| 蒸气重整 | CH4(g)+H2O(g) CO(g)+3H2(g) CO(g)+3H2(g) | +206.2 | 240.1 |
| CH4(g)+2H2O(g) CO2(g)+4H2(g) CO2(g)+4H2(g) | + 158. 6 | 243.9 |
回答下列问题:
①在初始阶段,甲烷蒸汽重整的反应速率______(填“大于”“小于”或“等于”)甲烷氧化的反应速率。
②反应CH4(g)+H2O(g) CO(g)+3H2(g) 的平衡转化率与温度、压强关系[其中n(CH4):n(H2O)=1:1]如图所示。
CO(g)+3H2(g) 的平衡转化率与温度、压强关系[其中n(CH4):n(H2O)=1:1]如图所示。
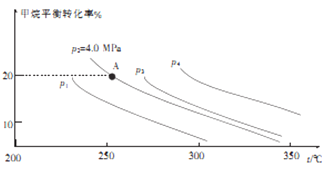
该反应在图中A点的平衡常数Kp=________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数),图中压强(p1、p2、p3、p4)由大到小的顺序为___________。
③从能量角度分析,甲烷自热重整方法的先进之处在于___________。
④如果进料中氧气量过大,最终会导致H2物质量分数降底,原因是__________。
(3)甲烷超干重整CO2技术可得到富含CO的气体,其能源和开境上的双重意义重大,甲烷超干重整CO2的催化转化原理如图所示。
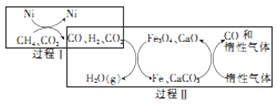
①过程II中第二步反应的化学方程式为_____________。
②只有过程I投料比 _______,过程II中催化剂组成才会保持不变。
_______,过程II中催化剂组成才会保持不变。
③该技术总反应的热化学方程式为______________。
-
2017年5月18日,中国国土资源部地质调查局宣布,我国在南海进行的可燃冰试采获得成功,成为全球第一个海域试采可燃冰成功的国家,可燃冰即天然气水合物,甲烷含量占80%至99.9%。化工生产中用甲烷和水蒸气反应得到以CO和H2为主的混合气体,这种混合气体可用于生产甲醇或合成氨,回答下列问题:
(1)对甲烷而言,有如下两个主要反应:
①CH4(g)+1/2O2(g)=CO(g)+2H2(g) △H1 =-36kJ·mol-1
②CH4(g)+H2O(g)=CO(g)+3H2(g) △H2 =+216kJ·mol-1
若不考虑热量耗散,物料转化率均为100%,最终炉中出来的气体只有CO、H2,为维持热平衡,每生产lmolCO,转移电子的数目为__________。
(2)甲醇是一种用途广泛的化工原料,工业上常用下列两种反应制备甲醇:
CO(g)+2H2(g)=CH3OH(g) △H1 =-90kJ·mol-1 K1
CO2(g)+3H2(g)= CH3OH(g)+H2O(l) △H2 K2
己知: CO(g)+H2O(g)= CO2(g)+H2(g) △H3 =-41.1kJ·mol-1 K3
H2O(l)=H2O(g) △H4 =+44.0kJ·mol-1 K4
则△H2=______ K2=_______ (用含K1、K3、K 4的代数式表示)
(3)在一恒温恒容密闭容器中充入1molCO2和3molH2模拟工业合成甲醇的反应:CO2(g)十3H2(g)  CH3OH(g)十H2O(g)
CH3OH(g)十H2O(g)
①下列能说明该反应已达到平衡状态的是______________________。
A.混合气体平均相对分子质量不变 B.混合气体密度不变
C.容器内压强恒定不变 D.反应速率满足以下关系:V正(CO2)=3V逆(H2)
E.CO2、H2、CH3OH、H2O物质的量浓度之比为1:3:1:1
F.单位时间内断裂3NAH-H键的同时形成2molH-O键
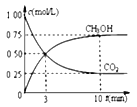
②模拟过程中测得CO2和CH3OH(g)浓度随时间变化如图所示,若此时容器内压强为P,则用平衡分压代替平衡浓度表示的化学平衡常数KP为_____________(用含P的代数式表示,数值保留两位小数),若此时再向容器内充入0.25molCO2和0.25molCH3OH的混合气体,则平衡______(填“正向“逆向“不”)移动。(已知:气体分压=气体总压×体积分数)
(4)甲醇可在电解银催化作用下制甲醛,从贵金属阳极泥中可提取“粗银”“粗银”(含Ag、Cu、Au)可用电解槽电解精炼,纯银作阴极,采用AgNO3和稀HNO3的混合液作电解液,阴极的主要电极反应式为_____。阴极还有少量副反应发生,产生的气体遇空气迅速变为红棕色,该副反应的电极反应式为_______。硝酸浓度不能过大,其原因是___________________________________________。
-
2017年5月10日中国在南海成功开采出可燃冰,下列有关说法中正确的是
A. 可燃冰是冰的另一种存在形态
B. 可燃冰无毒,可以放心大规摸开采
C. 相比煤、石油,可燃冰属于一种较清沽能源
D. 常温常压下,可燃冰呈固态,可像煤一样开采
-
2017年3月28 日,中国成功开采可燃冰,主要成分为甲烷,属于一次能源。下列不属于 一次能源的是( )
A. 石油 B. 风能 C. 太阳能 D. 氢能
CO(g)+3H2(g) ΔH>0。

=__________________。







