-
某小组研究溶液中Fe2+与NO2−、NO3−的反应。资料: [Fe(NO)]2+在溶液中呈棕色。

(1)研究现象a中的黄色溶液。
①用______溶液检出溶液中含有Fe3+。
②甲认为是O2氧化了溶液中的Fe2+。乙认为O2不是主要原因,理由是______。
③进行实验Ⅱ,装置如图。左侧烧杯中的溶液只变为黄色,不变为棕色,右侧电极上产生无色气泡,经检验该气体为NO。
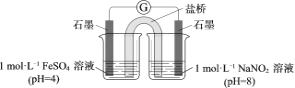
产生NO的电极反应式是______。
实验Ⅱ的目的是______。
(2)研究现象a中的棕色溶液。
①综合实验Ⅰ和实验Ⅱ,提出假设:现象a中溶液变为棕色可能是NO与溶液中的Fe2+或Fe3+发生了反应。进行实验Ⅲ,证实溶液呈棕色只是因为Fe2+与NO发生了反应。实验Ⅲ的操作和现象是______。
②加热实验Ⅰ中的棕色溶液,有气体逸出,该气体在接近试管口处变为红棕色,溶液中有红褐色沉淀生成。解释产生红褐色沉淀的原因是______。
(3)研究酸性条件下,溶液中Fe2+与NO2−、NO3−的反应。
| 序号 | 操作 | 现象 |
| ⅰ | 取1 mol·L−1的NaNO2溶液,加醋酸至pH=3,加入1 mol·L−1FeSO4溶液 | 溶液立即变为棕色 |
| ⅱ | 取1 mol·L−1的NaNO3溶液,加醋酸至pH=3,加入1 mol·L−1FeSO4溶液 | 无明显变化 |
| ⅲ | 分别取0.5 mL 1 mol·L−1的NaNO3溶液与1 mol·L−1的FeSO4溶液,混合,小心加入0.5 mL浓硫酸 | 液体分为两层,稍后,在两层液体界面上出现棕色环 |
①ⅰ中溶液变为棕色的离子方程式是______、______。
②ⅲ中出现棕色的原因是______。
实验结论:本实验条件下,溶液中NO2−、NO3−的氧化性与溶液的酸碱性等有关。
-
某小组研究溶液中Fe2+与 、
、 的反应。
的反应。

已知:[Fe(NO)]2+在溶液中呈棕色。
(1)研究现象a中的黄色溶液。
①用__________溶液检出溶液中含有Fe3+。
②甲认为是O2氧化了溶液中的Fe2+。乙认为O2不是主要原因,理由是_____________。
③进行实验Ⅱ,装置如图所示。左侧烧杯中的溶液只变为黄色,不变为棕色,右侧电极上产生无色气泡,经检验该气体为NO。产生NO的电极反应式为_______实验Ⅱ的目的是________。

(2)研究现象a中的棕色溶液。综合实验I和实验Ⅱ,提出假设:现象a中溶液变为棕色可能是NO与溶液中的Fe2+或Fe3+发生了反应。进行实验Ⅲ,证实溶液呈棕色只是因为Fe2+与NO发生了反应。实验Ⅲ的操作和现象是_______。
(3)研究酸性条件下,溶液中Fe2+与 、
、 的反应。
的反应。
| 序号 | 操作 | 现象 |
| i | 取1 mol·L-l的NaNO2溶液,加稀硫酸至pH = 3,加入1 mol·L-l FeSO4溶液 | 溶液立即变为棕色 |
| ii | 取1 mol·L-l的NaNO3溶液,加硫酸至pH = 3,加入1 mol·L-l FeSO4溶液 | 无明显变化 |
| iii | 分别取0.5 mL l mol·L-l的NaNO3溶液与1 mol·L-l的FeSO4溶液,混合,小心加入0.5 mL浓硫酸 | 液体分为两层,稍后,在两层液体界面上出现棕色环 |
i中溶液变为棕色的离子方程式为_______、__________。
实验结论:本实验条件下,溶液中 、
、 的氧化性与溶液的酸碱性等有关。
的氧化性与溶液的酸碱性等有关。
-
某小组研究溶液中Fe2+与 、
、 的反应。
的反应。

已知:[Fe(NO)]2+在溶液中呈棕色。
(1)研究现象a中的黄色溶液。
①用__________溶液检出溶液中含有Fe3+。
②甲认为是O2氧化了溶液中的Fe2+。乙认为O2不是主要原因,理由是_____________。
③进行实验Ⅱ,装置如图所示。左侧烧杯中的溶液只变为黄色,不变为棕色,右侧电极上产生无色气泡,经检验该气体为NO。产生NO的电极反应式为_______实验Ⅱ的目的是________。

(2)研究现象a中的棕色溶液。综合实验I和实验Ⅱ,提出假设:现象a中溶液变为棕色可能是NO与溶液中的Fe2+或Fe3+发生了反应。进行实验Ⅲ,证实溶液呈棕色只是因为Fe2+与NO发生了反应。实验Ⅲ的操作和现象是_______。
(3)研究酸性条件下,溶液中Fe2+与 、
、 的反应。
的反应。
| 序号 | 操作 | 现象 |
| i | 取1 mol·L-l的NaNO2溶液,加稀硫酸至pH = 3,加入1 mol·L-l FeSO4溶液 | 溶液立即变为棕色 |
| ii | 取1 mol·L-l的NaNO3溶液,加硫酸至pH = 3,加入1 mol·L-l FeSO4溶液 | 无明显变化 |
| iii | 分别取0.5 mL l mol·L-l的NaNO3溶液与1 mol·L-l的FeSO4溶液,混合,小心加入0.5 mL浓硫酸 | 液体分为两层,稍后,在两层液体界面上出现棕色环 |
i中溶液变为棕色的离子方程式为_______、__________。
实验结论:本实验条件下,溶液中 、
、 的氧化性与溶液的酸碱性等有关。
的氧化性与溶液的酸碱性等有关。
-
某小组研究溶液中Fe2+与NO2-、NO3-的反应。
| 实验I | 试剂 | 现象 |
| 滴管 | 试管 |
| 
2mL | 1 mol·L-1 FeSO4溶液(pH=4) | 1 mol·L-1 NaNO2溶液(pH=8) | a.滴入1滴FeSO4溶液,溶液变黄色,继续滴加,溶液变为棕色。2小时后,无明显变化 |
| 1 mol·L-1 NaNO3溶液(加NaOH溶液至pH=8) | b.持续滴加FeSO4溶液,无明显变化。 |
资料:[Fe(NO)]2+在溶液中呈棕色。[Fe(NO)]2+ Fe2++NO。
Fe2++NO。
(1)研究现象a中的黄色溶液。
①用______溶液(填试剂名称)检出溶液中含有Fe3+。
②甲认为是O2氧化了溶液中的Fe2+。乙认为O2不是主要原因,理由是________________________。
③进行实验Ⅱ,装置如图。证实了Fe2+被NO2-氧化为Fe3+。装置左侧烧杯中的试剂为:______________,实验过程中右侧电极上产生无色气泡,电极反应式为_____________________,左侧烧杯中的现象为:_____________________。
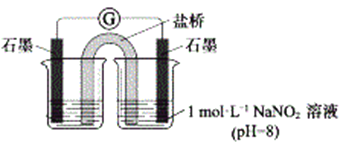
(2)研究现象a中的棕色溶液。
①综合实验Ⅰ和实验Ⅱ,提出假设:现象a中溶液变为棕色可能是NO与溶液中的Fe2+或Fe3+发生了反应。进行实验Ⅲ,证实溶液呈棕色只是因为Fe2+与NO发生了反应。实验Ⅲ的操作和现象是____________________________________________。
②加热实验Ⅰ中的棕色溶液,有气体逸出,该气体在接近试管口处变为红棕色,溶液中有红褐色沉淀生成。解释产生红褐色沉淀的原因是________________________________________。
(3)研究酸性条件下,溶液中Fe2+与NO2-、NO3-的反应。
| 序号 | 操作 | 现象 |
| ⅰ | 取1 mol·L-1的NaNO2溶液,加醋酸至pH=3,加入1 mol·L-1FeSO4溶液 | 溶液立即变为棕色 |
| ⅱ | 取1 mol·L-1的NaNO3溶液,加醋酸至pH=3,加入1 mol·L-1FeSO4溶液 | 无明显变化 |
| ⅲ | 分别取0.5 mL 1 mol·L-1的NaNO3溶液与1 mol·L-1的FeSO4溶液,混合,小心加入0.5 mL浓硫酸 | 液体分为两层,稍后,在两层液体界面上出现棕色环 |
①ⅰ中溶液变为棕色的离子方程式是____________________________、Fe2++NO =[Fe(NO)]2+。
②ⅲ中出现棕色的原因是________________________________。
实验结论:本实验条件下,溶液中NO2−、NO3−的氧化性与溶液的酸碱性等有关。
-
下列实验“操作和现象”与“结论”对应关系正确的是
| 操作和现象 | 结论 |
| A | 向装有Fe(NO3)2溶液的试管中加入少量稀H2SO4,在管口观察到红棕色气体 | 溶液中NO3-被Fe2+还原成NO2 |
| B | 用铂丝蘸取溶液进行焰色反应,观察到火焰呈黄色 | 该溶液一定是钠盐溶液 |
| C | 向饱和Na2CO3溶液中通入足量CO2,溶液变浑浊 | 有NaHCO3晶体析出 |
| D | 常温下,将Al箔插入浓硫酸中,无明显现象 | 铝和浓硫酸常温不反应 |
-
固体硝酸盐加热易分解且产物较复杂,某学习小组以Fe(NO3)2为研究对象,通过实验探究其热分解的产物,查阅资料,根据硝酸盐受热分解的规律,提出如下4种猜想:
甲:Fe2O3、NO2乙:Fe2O3、NO2、O2丙:Fe3O4、NO2、O2丁:FeO、NO2、N2
(1).实验前,小组成员经讨论认定猜想丁不成立,理由是__________________.
针对上述猜想,设计如图所示的实验装置(图中加热、夹持仪器等均省略):

(2).实验过程
①仪器连接后,放人固体试剂之前,应______________
②称取Fe(NO3)2固体3.6g置于A中,加热前先打开K,___________,后再关闭K,用酒精灯加热
③观察到A中有红棕色气体出现,C、D中未见明显变化.
④待样品完全分解,A装置冷却至室温、称量,测得剩余固体的质量为1.6g
⑤取少量剩余固体于试管中,加人适量水,未见明显现象.
(3).实验结果分析讨论:
①根据实验现象和剩余固体的质量经分析,可初步确认分解产物中有____________。
②根据D中无明显现象,一位同学认为不能确认分解产物中有O2,因为若有O2,D中溶液颜色会退去;另一个同学认定分解产物中有O2存在,未检侧到的原因是_________________。
③为了验证是否有O2,某同学另称Fe(NO3)2固体3.6g,充分加热,收集气体,假设产生的气体全部收集,将集满气体的试管倒放在水槽中,观察到的现象是红棕色消失,液面上升,进入试管中的溶液大于2/3,通入一定量的O2后,气体全部被吸收,请写出Fe(NO3)2受热分解的化学方程式______________,通入O2的物质的量为_____________。
④小组讨论后达成的共识是上述实验设计仍不完善,需改进装置进一步研究。写一点不足之处:__________________________。
-
下列实验中,对应的现象以及结论都正确且两者具有因果关系的是
| 选项 | 实验 | 现象 | 结论 |
| A | 将稀H2SO4滴加到Fe(NO3)2溶液中 | 溶液变棕黄色,有红棕色气体生成 | HNO3分解生成NO2 |
| B | 将CO2气体依次通过NaHSO3溶液、品红溶液 | 品红溶液不褪色 | H2SO3的酸性比H2CO3强 |
| C | 常温下将大小相同的铝片分别加入到浓硝酸和稀硝酸中 | 浓硝酸比稀硝酸反应更剧烈 | 反应物浓度越大,反应速率越快 |
| D | 将H2O2溶液滴加到酸性KMnO4溶液中 | 紫色溶液褪色 | H2O2具有氧化性 |
-
下列实验中,对应的现象以及结论都正确,且两者具有因果关系的是( )
| 选项 | 实验 | 现象 | 结论 |
| A | 将盐酸滴入0.5 mol/LFe(NO3)2溶液中 | 溶液变黄色,有无色气体逸出,后又变成红棕色 | Fe2+被HNO3氧化 |
| B | 向淀粉溶液中加入稀硫酸加热几分钟冷却后再加入新制的Cu(OH)2悬浊液,加热 | 得到蓝色溶液 | 淀粉没有水解 |
| C | 向FeCl3和BaCl2混合溶液中通入足量的SO2 | 溶液变为浅绿色,且有白色沉淀生成 | 沉淀为BaSO3,BaSO4的混合物 |
| D | 用湿润的蓝色石蕊试纸检验某气体 | 试纸变红 | 该气体是氨气 |
A.A B.B. C.C D.D
-
某小组以亚硝酸钠(NaNO2)溶液为研究对象,探究NO2-的性质。
资料:[Fe(NO)] 2+在溶液中呈棕色。
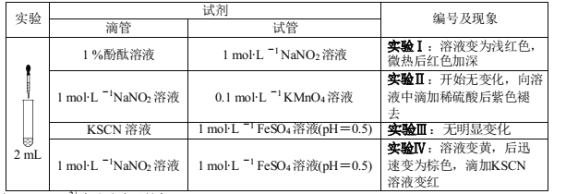
(1)结合化学用语解释实验Ⅰ“微热后红色加深”的原因 ___;
(2)实验Ⅱ证明NO2-具有 ____性;
(3)实验Ⅳ证明NO2-具有_____性;写出此反应溶液先变黄后变成棕色的离子反应方程式 ____;
(4)探究实验Ⅳ中的棕色溶液
①为确定棕色物质是NO 与 Fe2+ 而非与 Fe3+ 发生络合反应的产物,设计如下实验,请补齐实验方案。
| 实验 | 溶液a | 现象 |
| 
| 1mol/LFeSO4溶液(pH=0.5) | 溶液由________色迅速变为____色 |
| __________________ | 无明显变化 |
②加热实验Ⅳ中的棕色溶液,有气体逸出,该气体在接近试管口处变为红棕色,溶液中有红褐色沉淀生成。解释上述现象产生的原因 ___ 。
-
某强酸性溶液X,可能含有Al3+、Ba2+、NH4+、Fe2+、Fe3+、CO32-、SiO32-、NO3-的一种或几种离子,取该溶液进行实验.其现象及转化如图。反应过程中有一种气体是红棕色。
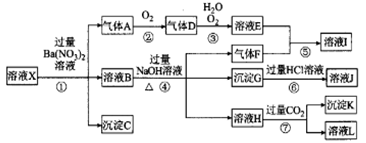
请回答下列问题:
(1)由强酸性条件即可到断溶液X中一定不存在的离子有_____________。
(2)溶液X中,关于NO3-的判断一定正确的是___________。
a.一定有 b.一定没有 c.可能有
(3)产生气体A的离子方程式为____________。
(4)转化⑥发生反应的现象为____________。
(5)转化④中产生H的离子方程式为____________。
(6)若转化③中,D、H2O、O2三种物质恰好发生化合反应生成E,则反应中D与O2的物质的量之比为_____________。
(7)对不能确定是否存在的离子,可以另取X溶液,加入下列溶液中的一种,根据现象即可判断,该试剂最好是______________。
①NaOH溶液 ②KSCN溶液 ③石蕊试剂 ④pH试纸











