-
空气质量日报中有一项重要检测指标是SO2的含量,结合所学知识回答下列问题。工业制硫酸的过程中,SO2催化氧化的原理:
2SO2(g)+O2(g)  2SO3(g) △H<0
2SO3(g) △H<0
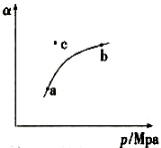
(1)某温度下,测得SO2(g)的平衡转化率( )与体系总压强( p )的关系如上图所示。a、b两点对应的平衡常数K(a) K(b) (填“>”“<”或“=
)与体系总压强( p )的关系如上图所示。a、b两点对应的平衡常数K(a) K(b) (填“>”“<”或“= ”,下同)SO3浓度c(a) c(b) c点,反应速率υ(正) υ(逆)。
”,下同)SO3浓度c(a) c(b) c点,反应速率υ(正) υ(逆)。
(2)将一定量的SO2(g)和O2(g)分别通入到体积为2L的恒容密闭容器中,在不同温度下进行,反应得到如下表中的两组数据:
| 实验编号 | 温度/℃ | 起始量/mol | 平衡量/mol |
| SO2 | O2 | SO2 | O2 |
| 1 | T1 | 4 | 2 | x | 0.8 |
| 2 | T2 | 4 | 2 | 0.4 | y |
| | | | | |
实验1从开始到反应达到化学平衡时,用去时间t 分钟,则υ(SO2)表示的反应速率为 ,温度T1大于T2的理由是 。
-
(共14分)SO2的含量是空气质量日报中一项重要检测指标,请结合所学知识回答下列问题。
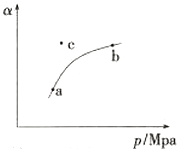
(1)工业制硫酸过程中,SO2催化氧化的原理为:2SO2(g)+O2(g) 2SO3(g) 。T℃时,向某密闭容器中充入一定SO2(g)和O2(g),发生上述反应,测得SO2(g)的平衡转化率(a)与体系总压强(p)的关系如图所示。
2SO3(g) 。T℃时,向某密闭容器中充入一定SO2(g)和O2(g),发生上述反应,测得SO2(g)的平衡转化率(a)与体系总压强(p)的关系如图所示。
①a、b两点对应的平衡常数K(a) K(b)(填“>”、“<”或“=”,下同),SO2浓度c(a) c(b)。
②c点时,反应速率v(正) v(逆)。
(2)电化学法处理SO2。
硫酸工业尾气中的SO2经分离后,可用于制备硫酸,同时获得电能,装置如下图所示(电极均为惰性材料):
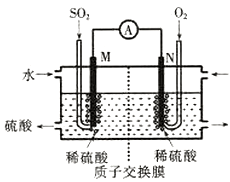
①M极发生的电极反应式为 。
②若使该装置的电流强度达到2.0A,理论上每分钟应向负极通入标准状况下气体的体积为 L(已知:1个e-所带电量为1.6×10-19C)。
(3)溶液法处理SO2。已知常温下H2SO3和H2CO3的电离常数如下表所示:

常温下,将SO2缓慢通入100mL 0.2mol•L-1的Na2CO3溶液中,当通入448mLSO2时(已折算为标准状况下的体积,下同),发生的离子方程式为 ;当通入896mLSO2时,所得溶液呈弱酸性,溶液中各离子浓度由大到小的顺序为 。
-
空气质量日报中有一项重要检测指标是SO2的含量,结合所学知识回答下列问题。
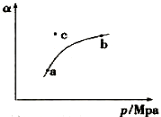
工业制硫酸的过程中,SO2催化氧化的原理为:2SO2(g)+O2(g)  2SO3(g) + Q
2SO3(g) + Q
某温度下,测得SO2(g)的平衡转化率( )与体系总压强( p )的关系如上图所示。
)与体系总压强( p )的关系如上图所示。
28.a、b两点对应的平衡常数K(a) K(b) (填“>”、 “<”或“=”,下同),SO3浓度c(a) c(b)。c点时,反应速率υ(正) υ(逆)。
将一定量的SO2(g)和O2(g)分别通入到体积为2L的恒容密闭容器中,在不同温度下进行反应得到如下表中的两组数据:
| 实验编号 | 温度/℃ | 起始量/mol | 平衡量/mol |
| SO2 | O2 | SO2 | O2 |
| 1 | T1 | 4 | 2 | x | 0.8 |
| 2 | T2 | 4 | 2 | 0.4 | y |
| | | | | |
29.实验1从开始到反应达到化学平衡时,用去时间t 分钟,则υ(SO2)表示的反应速率为 ,温度T1大于T2的理由是 。
30.制取SO2的尾气用NaOH溶液吸收,可得到Na2SO3和NaHSO3两种盐。
①0.1 mol/L的NaHSO3溶液中c(H+) >c(OH-),用水解和电离理论的角度解释其原因 ,若往溶液中加入氨水至中性,则c(Na+) c(HSO3-)+c(SO32-)+c(H2SO3) (填“>”、 “﹤”或 “=”)。
②往0.1 mol/L 的Na2SO3溶液加入少量NaOH固体,完全溶解后溶液中c(Na+) : c(SO32-)的比值 (填“变大”、“变小”或“保持不变”)。
-
SO2的含量是空气质量日报中一项重要检测指标,也是最近雾霾天气肆虐我国大部分地区的主要原因之一。加大SO2的处理力度,是治理环境污染的当务之急。
I.电化学法处理SO2。
硫酸工业尾气中的SO2经分离后,可用于制备硫酸,同时获得电能,装置如右图所示(电极均为惰性材料):
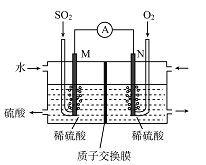
(1)M极发生的电极反应式为________________。
(2)若使该装置的电流强度达到2.0A,理论上每分钟应向负极通入标准状况下气体的体积为________L(已知:1个e-所带电量为1.6×10-19C)。
Ⅱ.溶液与电化学综合(钠碱循环法)处理SO2。
(3)钠碱循环法中,用Na2SO3溶液作为吸收液来吸收SO2,该反应的离子方程式为______________。
(4)吸收液吸收SO2的过程中,pH随n(SO32-)/n(HSO3-)变化关系如右图所示:
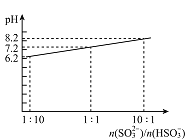
①用图中数据和变化规律说明NaHSO3溶液呈酸性的原因________________。
②n(SO32-)/n(HSO3-)=1:1时,溶液中离子浓度由大到小的顺序是_____________。
(5)当吸收液的pH降至约为6时,需送至电解槽处理,直至得到pH>8的吸收液再循环利用,其电解示意图如下:
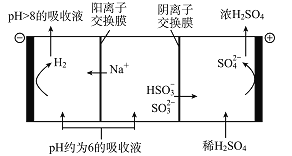
①写出阳极发生的电极反应式________________;
②当电极上有2 mol电子转移时阴极产物的质量为______________。
-
S02的含量是空气质量日报中一项重要检测指标,也是最近雾霾天气肆虐我国大部分地区的主要原因之一。加大S02的处理力度,是治理环境污染的当务之急。
I.电化学法处理SO2。
硫酸工业尾气中的SO2经分离后,可用于制备硫酸,同时获得电能,装置如右图所示(电极均为惰性材料):
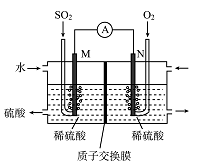
(1)M极发生的电极反应式为________________。
(2)若使该装置的电流强度达到2.0A,理论上每分钟应向负极通入标准状况下气体的体积为 L(已知:1个e所带电量为1.6×10-19C)。
Ⅱ,溶液与电化学综合(钠碱循环法)处理SO2。
(3)钠碱循环法中,用Na2SO3溶液作为吸收液来吸收SO2,该反应的离子方程式为 。
(4)吸收液吸收SO2的过程中,pH随n(SO32-)/n(HSO3-)变化关系如右图所示:
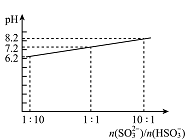
①用图中数据和变化规律说明NaHSO3溶液呈酸性的原因 。
②n(SO32-)/n(HSO3-)=1:1时,溶液中离子浓度由大到小的顺序是 。
(5)当吸收液的pH降至约为6时,需送至电解槽处理,直至得到pH>8的吸收液再循环利用,其电解示意图如下:
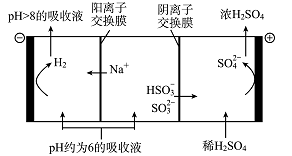
①写出阳极发生的电极反应式 ;
②当电极上有2 mol电子转移时阴极产物的质量为 。
-
运用所学知识回答下列问题。
(1)工业上制备H2S的一种方法是在催化剂、高温条件下,用天然气与SO2反应,同时生成两种能参与大气循环的氧化物。该反应的化学方程式为:__。
(2)煤化工原料气脱硫过程的反应原理为
i.COS(g)+H2(g) H2S(g)+CO(g) △H=+7kJ•mol-1;
H2S(g)+CO(g) △H=+7kJ•mol-1;
ii.CO(g)+H2O(g) CO2(g)+H2(g) △H=-42kJ•mol-1;
CO2(g)+H2(g) △H=-42kJ•mol-1;
①则COS(g)+H2O(g) H2S(g)+CO2(g)△H=___kJ•mol-1;
H2S(g)+CO2(g)△H=___kJ•mol-1;
②向10L容积不变的密闭容器中充入1molCOS(g)、1molH2(g)和1molH2O(g),进行上述两个反应。其他条件不变时,体系内CO的平衡体积分数与温度(T)的关系如图所示。随着温度升高,CO的平衡体积分数增大的原因是__。
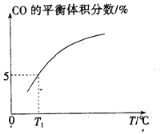
T1℃时,测得平衡时体系中COS的物质的量为0.80mol。则该温度下,COS的平衡转化率为___;反应i的平衡常数为__(小数点后保留两位)。
-
(14分)已知CO2、SO2、NOx是对环境影响较大的气体,请你运用所学知识参与环境治理,使我们周围的空气更好。
(1)硫酸生产中,SO2催化氧化生成SO3,反应混合体系
中SO3的百分含量和温度的关系如右图所示(曲线上
点均为平衡状态)。由图可知:
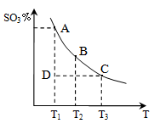
①2SO2(g) + O2(g) 2SO3(g)的△H____0(填“>”或“<”),若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡 移动(填“向左”、“向右”或“不移动”);
2SO3(g)的△H____0(填“>”或“<”),若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡 移动(填“向左”、“向右”或“不移动”);
②若温度为T1时,反应进行到状态D时,v(正)_______v(逆)(填“>”、“<”或“=”);
③硫酸厂的SO2尾气用过量的氨水吸收,对SO2可进行回收及重新利用,反应的化学方程式为 、 ;
④新型氨法烟气脱硫技术是采用氨水吸收烟气中的SO2,再用一定量的磷酸与上述吸收产物反应。其优点除了能回收利用SO2外,还能得到一种复合肥料,该复合肥料可能的化学式为:________(只要求写一种);
(2)汽车尾气(含有烃类、CO、NOx等物质)是城市空气的污染源。治理的方法之一是在汽车的排气管上装一个“催化转换器”(用铂、钯合金作催化剂)。其前半部反应方程式为:
2CO+2NO  2CO2+N2。它的优点是 ;
2CO2+N2。它的优点是 ;
(3)有人设想用图所示装置,运用电化学原理将CO2、SO2转
化为重要化工原料。
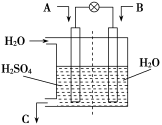
①若A为CO2,B为H2,C为CH3OH,则正极电极反应式为
;
②若A为SO2,B为O2,C为H2SO4。科研人员希望每分钟
从C处获得100 mL 10 mol/L H2SO4,则A处通入烟气(SO2
的体积分数为1%)的速率为 L/min(标准状况)。
-
SO2的含量是衡量大气污染的一个重要指标,工业上常采用催化还原法或吸收法处理SO2。利用催化还原SO2不仅可消除SO2污染,而且可得到有经济价值的单质S。
(1)在复合组分催化剂作用下,CH4可使SO2转化为S,同时生成CO2和H2O。
己知CH4和S的燃烧热(△H)分别为-890.3 kJ /mol和-297.2 kJ /mol,则CH4和SO2反应的热化学方程式为 _________________________________________________。
(2)用H2还原SO2生成S的反应分两步完成,如图1所示,该过程中相关物质的物质的量浓度随时间的变化关系如图2所示:
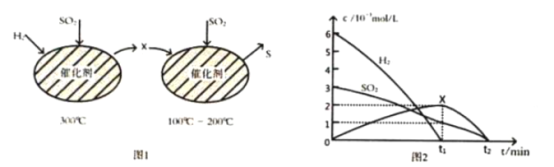
①分析可知X为________(写化学式), 0~t1时间段的温度为_____, 0~t1时间段用SO2表示的化学反应速率为 ___________________________。
②总反应的化学方程式为__________________________________________________________。
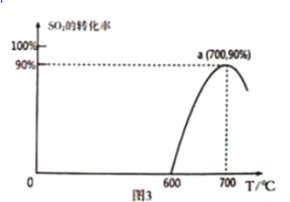
(3)焦炭催化还原SO2生成S2,化学方程式为:2C(s)+2SO2(g) S2(g)+2CO2(g),恒容容器中,1 mol/LSO2与足量的焦炭反应,SO2的转化率随温度的变化如图3所示。
S2(g)+2CO2(g),恒容容器中,1 mol/LSO2与足量的焦炭反应,SO2的转化率随温度的变化如图3所示。
①该反应的△H _________________________ 0 (填“>”或“<”)
②计算700℃该反应的平衡常数为____________________ 。
-
SO2的含量是衡量大气污染的一个重要指标,工业上常采用催化还原法或吸收法处理SO2。利用催化还原SO2不仅可消除SO2污染,而且可得到有经济价值的单质S。
(1)在复合组分催化剂作用下,CH4可使SO2转化为S,同时生成CO2和H2O。
己知CH4和S的燃烧热(△H)分别为-890.3 kJ /mol和-297.2 kJ /mol,则CH4和SO2反应的热化学方程式为 _________________________________________________。
(2)用H2还原SO2生成S的反应分两步完成,如图1所示,该过程中相关物质的物质的量浓度随时间的变化关系如图2所示:
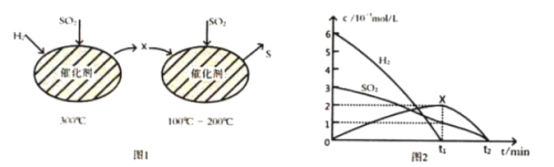
①分析可知X为________(写化学式), 0~t1时间段的温度为_____, 0~t1时间段用SO2表示的化学反应速率为 ___________________________。
②总反应的化学方程式为__________________________________________________________。
(3)焦炭催化还原SO2生成S2,化学方程式为:2C(s)+2SO2(g) S2(g)+2CO2(g),恒容容器中,1 mol/LSO2与足量的焦炭反应,SO2的转化率随温度的变化如图3所示。
S2(g)+2CO2(g),恒容容器中,1 mol/LSO2与足量的焦炭反应,SO2的转化率随温度的变化如图3所示。
①该反应的△H _________________________ 0 (填“>”或“<”)
②计算700℃该反应的平衡常数为____________________ 。
-
SO2的含量是衡最大气污染的一个重要指标,工业上常采用催化还原法或吸收法处理SO2。利用催化还原SO2不仅可消除SO2污染,而且可得到有经济价值的单质S。
(1)在复合组分催化剂作用下,CH4可使SO2转化为S,同时生成CO2和H2O。己知CH4和S的燃烧热(△H)分别为-890.3kJ/mol和-297.2kJ/mol,则CH4和SO2反应的热化学方程式为_____________。
(2)用H2还原SO2生成S的反应分两步完成,如图1所示,该过程中相关物质的物质的量浓度随时间的变化关系如图2所示:
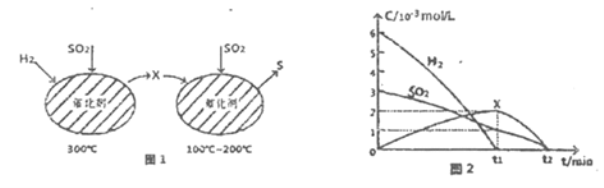
①分析可知X为______(写化学式),0~t1时间段的温度为_____,0~t1时间段用SO2表示的化学反应速率为________。
②总反应的化学方程式为_____________。
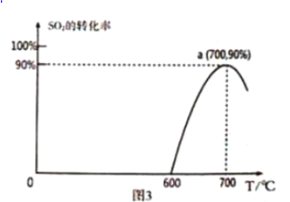
(3)焦炭催化还原SO2生成S2,化学方程式为:2C(s)+2SO2(g) S2(g)+2CO2(g),恒容容器中,1mol/LSO2与足量的焦炭反应,SO2的转化率随温度的变化如图3所示。
S2(g)+2CO2(g),恒容容器中,1mol/LSO2与足量的焦炭反应,SO2的转化率随温度的变化如图3所示。
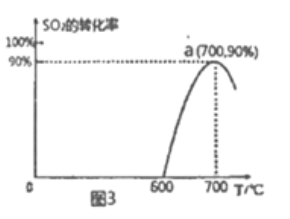
①该反应的△H____0(填“>”或“<”)。
②算a点的平衡常数为_________。
(4)工业上可用Na2SO3溶液吸收法处理SO2,25℃时用1mo/L的Na2SO3溶液吸收SO2。当溶液pH=7时,溶液中各离子浓度的大小关系为________。已知:H2SO3的电离常数K1=1.3×10-2,K2=6.2×10-8。

2SO3(g) 。T℃时,向某密闭容器中充入一定SO2(g)和O2(g),发生上述反应,测得SO2(g)的平衡转化率(a)与体系总压强(p)的关系如图所示。


















