-
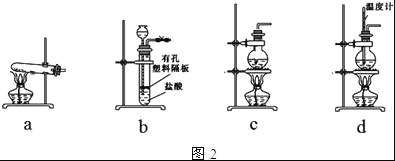
纯碱(Na2CO3)在生产生活中具有广泛的用途。以下是实验室模拟制碱原理制取Na2CO3的流程图。
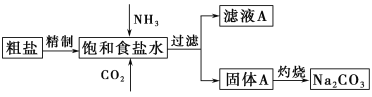
已知:向饱和食盐水中通入NH3、CO2后发生的反应为NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl。回答以下问题:
(1)粗盐中含有的杂质离子有Ca2+、Mg2+、SO42-等。精制除杂的步骤顺序是a→________→________→________→b(填字母编号)。
a.粗盐溶解,滤去沉渣 b.加入盐酸调pH c.加入Ba(OH)2溶液d.加入Na2CO3溶液 e.过滤
(2)向饱和食盐水中先通入_______,后通入________
制得的碳酸钠样品中往往含有少量NaCl,现欲测定样品中Na2CO3的质量分数,某探究性学习小组分别设计了如下实验方案.请回答下列有关问题:
方案一:把一定质量的样品溶解后加入过量的CaCl2溶液,将所得沉淀过滤、洗涤、烘干、称量、计算。
(3)洗涤沉淀的具体操作是_____________________________。
方案二:利用下图所示装置来测定纯碱样品中碳酸钠的质量分数(铁架台、铁夹等在图中均已略去)。实验步骤如下:
①按图连接装置,并检查气密性;
②准确称得盛有碱石灰的干燥管D的质量为33.4g;
③准确称得6g纯碱样品放入容器b中;
④打开分液漏斗a的旋塞,缓缓滴入稀硫酸,至不再产生气泡为止;
⑤打开弹簧夹,往试管A中缓缓鼓入空气数分钟,然后称得干燥管D的总质量为35.6g。

(4)装置A中试剂X应选用_________________。
(5)根据实验中测得的有关数据,计算纯碱样品Na2CO3的质量分数为___________(结果保留小数点后一位)。
-
纯碱(Na2CO3) 在生产生活中具有广泛的用途。以下是实验室模拟制碱原理制取Na2CO3的流程图:
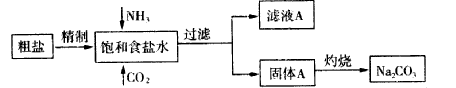
已知:向饱和食盐水中通入NH3、CO2后发生的反应为NaCl+NH3+CO2+H2O→NaHCO3↓+NH4Cl。请回答以下问题:
(1)粗盐中含有的杂质离子有Ca2+、Mg2+、SO42-等。
精制除杂的步骤顺序a→_______→________→________→b(填字母编号)。
a.粗盐溶解,滤去沉渣;
b.加入盐酸调pH;
c.加入Ba(OH) 2溶液;
d.加入Na2CO3溶液;
e.过滤
向饱和食盐水中先通入NH3,后通入CO2,理由是_____________________。
(2)灼烧固体A制Na2CO3应在_____(填字母序号)中进行。
a.坩埚 b.蒸发皿 c.烧杯 d.锥形瓶
证明滤液A中含有NH4+的方法是 。对滤液A进行重结晶能够获得NH4HCO3,向pH=13含Na+、K+的溶液中加入少量NH4HCO3,使pH降低,反应的离子方程式______________________。
(3)下图装置中常用于实验室制备CO2的是_____(填字母编号);用b示意的装置制备NH3时,分液漏斗中盛放的试剂______(填试剂名称),烧瓶内可加入的固体试剂 (填试剂名称)。

(4)一种天然碱晶体成分是aNa2CO3·bNa2SO4·cH2O,某同学利用下列提供的试剂,设计了如下简单合理测定Na2CO3的质量分数的实验方案。请把实验方案补充完整(仪器自选):
供选择的试剂:1.0 mol·L-1H2SO4溶液、1.0 mol·L-1BaCl2溶液、稀氨水、碱石灰、Ca(OH) 2溶液、蒸馏水
①称取m1 g一定量天然碱晶体样品,溶于适量蒸馏水中;
②_________________________________________________________________;
③_________________________________________________________________;
④计算天然碱晶体中含Na2CO3的质量分数。
-
纯碱(Na2CO3)在生产生活中具有广泛的用途。以下是实验室模拟制碱原理制取Na2CO3的流程图。

已知:向饱和食盐水中通入NH3、CO2后发生的反应为NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl。请回答以下问题:
(1)粗盐中含有的杂质离子有Ca2+、Mg2+、SO42-等。
精制除杂的步骤顺序是a→ → → →b(填字母编号)。
a.粗盐溶解,滤去沉渣
b.加入盐酸调pH
c.加入Ba(OH)2溶液
d.加入Na2CO3溶液
e.过滤
向饱和食盐水中先通入NH3,后通入CO2,理由是 。
(2)灼烧固体A制Na2CO3在 (填字母序号)中进行。
a.坩埚 b.蒸发皿 c.烧杯 d.锥形瓶
证明滤液A中含有NH4+的方法是 。
对滤液A进行重结晶能够获得NH4HCO3,向pH=13含Na+、K+的溶液中加入少量NH4HCO3使pH降低,反应的离子方程式为 。
(3)下图装置中常用于实验室制备CO2的是 (填字母编号);用b装置制备NH3,分液漏斗中盛放的试剂是 (填试剂名称),烧瓶内可加入的固体试剂是 (填试剂名称)。

(4)一种天然碱晶体成分是aNa2CO3·bNa2SO4·cH2O,某同学利用下列提供的试剂,设计了如下简单合理测定Na2CO3的质量分数的实验方案。(仪器自选)请把实验方案填全:
供选择的试剂:1.0 mol·L-1 H2SO4溶液、1.0 mol·L-1 BaCl2溶液、稀氨水、碱石灰、Ca(OH)2溶液、蒸馏水
①称取m1g天然碱晶体样品,溶于适量蒸馏水中。
② 。
③ 。
④计算天然碱晶体中含Na2CO3的质量分数。
-
纯碱(Na2CO3)在生产生活中具有广泛的用途。以下是实验室模拟制碱原理制取Na2CO3的流程图

已知:向饱和食盐水中通入NH3,CO2后发生和反应为NaCl+NH3+CO2+H2O NaHCO3↓+NH4Cl,请回答以下问题:
NaHCO3↓+NH4Cl,请回答以下问题:
(1)粗盐中含有的杂质离子有Ca2+,Mg2+,SO42-等。
精制除杂的步骤顺序a→_______→________→________→b(填字母编号)。
a.粗盐溶解,滤去沉渣.b.加入盐酸调pH;c.加入Ba(OH)2溶液;d.加入Na2CO3溶液;e.过滤
向饱和食盐水中先通入NH3,后通人CO2,理由是_____________________。
(2)灼烧固体A制Na2CO3在_____填字母序号)中进行。
a.坩埚 b.蒸发皿 c.烧杯 d.锥形瓶
证明滤液A中含有NH4+的方法是__________________________________________________________。
对滤液A进行重结晶能够获得NH4HCO3,向pH=13含Na+,K+的溶液中加入少量NH4HCO3。使pH降低,反应的离子方程式____________________________________。
(3)下图装置中常用于实验室制备CO2的是_____(填字母编号);用b示意的装置制备NH3,分液漏斗中盛放的试剂______(填试剂名称),烧瓶内可加入的固体试剂__________(填试剂名称)。
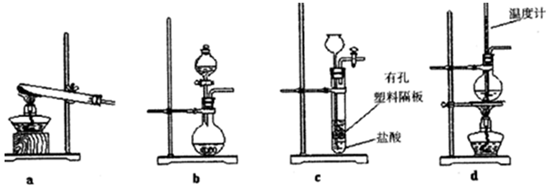
(4)一种天然碱晶体成分是aNa2CO3·bNa2CO3·cH2O,某同学利用下列提供的试剂,设计了如下简单合理测定Na2CO3的质量分数的实骏方案。(仪器自选)请把实验方案填全:供选择的试剂:1.0mol/LH2SO4溶液、1.0mol/L BaCl2溶液、稀氨水、碱石灰、Ca(OH)2溶液、蒸馏水
①称取m1g一定量天然碱晶体样品,溶于适量蒸馏水中。
②_________________________________________________________________。
③_________________________________________________________________。
④计算天然碱晶体中含Na2CO3的质量分数。
-
纯碱(Na2CO3)在生产生活中具有广泛的用途.如图1是实验室模拟制碱原理制取Na2CO3的流程图.
完成下列填空:
已知:粗盐中含有Ca2+、Mg2+、SO42﹣等杂质离子.
(1)精制除杂的步骤顺序是____→___→____→____→____ (填字母编号).
a 粗盐溶解 b 加入盐酸调pH c 加入Ba(OH)2溶液 d 加入Na2CO3溶液 e 过滤
(2)向饱和食盐水中先通入NH3,后通入CO2,理由是______.在滤液a中通入NH3和加入精盐的目的是______.
(3)请在图1流程图中添加两条物料循环的路线.____
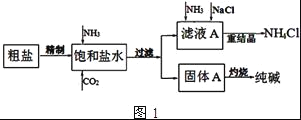
(4)图2装置中常用于实验室制备CO2的是__(填字母编号);用c装置制备NH3,烧瓶内可加入的试剂是___(填试剂名称).
(5)一种天然碱晶体成分是aNa2CO3•bNa2SO4•cH2O,利用下列提供的试剂,设计测定Na2CO3质量分数的实验方案.请把实验方案补充完整:
供选择的试剂:稀H2SO4、BaCl2溶液、稀氨水、碱石灰、Ba(OH)2溶液
①______.
②______.
③______.
④计算天然碱晶体中含Na2CO3的质量分数.
-
纯碱(Na2CO3)在生产生活中具有广泛的用途.如图1是实验室模拟制碱原理制取Na2CO3的流程图.
完成下列填空:
已知:粗盐中含有Ca2+、Mg2+、SO42﹣等杂质离子.
(1)精制除杂的步骤顺序是____→___→____→____→____ (填字母编号).
a 粗盐溶解 b 加入盐酸调pH c 加入Ba(OH)2溶液 d 加入Na2CO3溶液 e 过滤
(2)向饱和食盐水中先通入NH3,后通入CO2,理由是______.在滤液a中通入NH3和加入精盐的目的是______.
(3)请在图1流程图中添加两条物料循环的路线.____
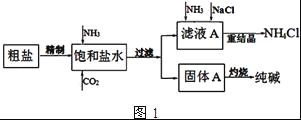
(4)图2装置中常用于实验室制备CO2的是__(填字母编号);用c装置制备NH3,烧瓶内可加入的试剂是___(填试剂名称).
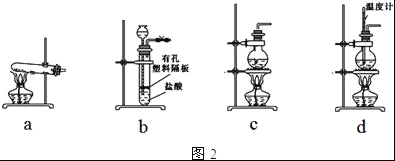
(5)一种天然碱晶体成分是aNa2CO3•bNa2SO4•cH2O,利用下列提供的试剂,设计测定Na2CO3质量分数的实验方案.请把实验方案补充完整:
供选择的试剂:稀H2SO4、BaCl2溶液、稀氨水、碱石灰、Ba(OH)2溶液
①______.
②______.
③______.
④计算天然碱晶体中含Na2CO3的质量分数.
-
侯德榜是我国制碱丁业的先驱,他根据氨碱法制碱的缺点提出用饱和的NaCl溶液、CO2、NH3反应制取纯碱的联合制碱法。某学校课外活动小组根据侯氏制碱法的原理在实验室模拟制碱。请同答下列问题:
(1)写出实验室制取NH3的化学方程式:_______________。
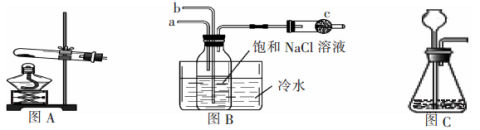
(2)上图B中的a接装置图_________(填图A或图C)
(3)用离子方程式表示装有饱和食盐水的集气瓶中的现象:______________________。
(4)水槽中的冷水的作用除了可以增加气体物质在溶液中的溶解度外还有一个重要作用是:_____________。
(5)图B中c的作用是:_____________。
-
氯气在生产生活中有广泛的用途,制取氯气的途径有多种。完成下列填空:
(1)工业上用电解饱和食盐水制取氯气,氯气在电解池的______极产生;氯气与氢氧化钠反应得到消毒剂次氯酸钠,发生反应的化学方程式为________;向次氯酸钠溶液中加入少量稀盐酸,可以增强消毒效果,这是因为生成了_____(填物质名称)。
(2)实验室制取氯气的化学方程式为MnO2+4HCl(浓)  MnCl2+Cl2↑+2H2O,该反应中,氯气是______(填“氧化”或“还原”)产物;若反应过程中转移了2 mol电子,则在标准状况下可以得到_______L氯气。
MnCl2+Cl2↑+2H2O,该反应中,氯气是______(填“氧化”或“还原”)产物;若反应过程中转移了2 mol电子,则在标准状况下可以得到_______L氯气。
(3)实验室常用排饱和食盐水的方法收集氯气,请用平衡移动原理解释用饱和食盐水而不用水的原因。___________
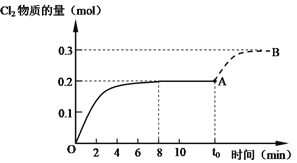
(4)有机化工中会利用反应4HCl(g)+O2(g) 2Cl2(g)+2H2O(g)+Q(Q>0)来产生氯气。向5 L的密闭容器中加入0.5 mol HCl与0.2 mol O2,在一定条件下发生反应,Cl2的物质的量与时间t的关系如图中OA段所示。0~8 min时Cl2的平均反应速率为_________________。t0时刻改变某一条件,Cl2的物质的量变化曲线如图中AB段所示,则t0时改变的条件一定是__________。
2Cl2(g)+2H2O(g)+Q(Q>0)来产生氯气。向5 L的密闭容器中加入0.5 mol HCl与0.2 mol O2,在一定条件下发生反应,Cl2的物质的量与时间t的关系如图中OA段所示。0~8 min时Cl2的平均反应速率为_________________。t0时刻改变某一条件,Cl2的物质的量变化曲线如图中AB段所示,则t0时改变的条件一定是__________。
a.降低温度 b.增大压强 c.加入HCl
-
碳酸氢钠是一种重要的化工原料,在日常生活中也有广泛的用途,侯德榜先生发明了连续生产纯碱与氯化铵的联合制碱工艺,成为近代化学工业的奠基人之一,该反应原理为: 饱和
饱和 .
.
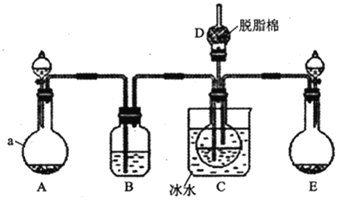
现用如图所示装置和上述原理制取碳酸氢钠晶体,图中夹持装置已略去.
可选用的药品有:①石灰石②生石灰③ 盐酸④稀硫酸⑤浓氨水⑥饱和氯化钠溶液⑦饱和碳酸氢钠溶液
盐酸④稀硫酸⑤浓氨水⑥饱和氯化钠溶液⑦饱和碳酸氢钠溶液
请回答下列问题
(1)仪器a的名称是______.
(2) 中应选用的药品是______
中应选用的药品是______ 填序号
填序号
(3)在实验过程中,应先向C中通入的气体的化学式是______,其原因是______.
(4) 中脱脂棉应浸润的试剂是______
中脱脂棉应浸润的试剂是______ 填写字母编号
填写字母编号
 浓硫酸
浓硫酸  稀硫酸
稀硫酸  氢氧化钠溶液
氢氧化钠溶液  浓硝酸
浓硝酸
(5)该小组同学为了测定C中所得晶体中碳酸氢钠的纯度 假设晶体中不含碳酸盐杂质
假设晶体中不含碳酸盐杂质 ,先将晶体充分干燥后,称量质量为wg,称量质量为wg,然后进行如下图所示实验:
,先将晶体充分干燥后,称量质量为wg,称量质量为wg,然后进行如下图所示实验:

 操作Ⅲ中的方法是______,______,______
操作Ⅲ中的方法是______,______,______
 所得晶体中碳酸氢钠的纯度是______
所得晶体中碳酸氢钠的纯度是______ 不必化简
不必化简
-
碳酸氢钠是一种重要的化工原料,在日常生活中也有广泛的用途,侯德榜先生发明了连续生产纯碱与氯化铵的联合制碱工艺,成为近代化学工业的奠基人之一,该反应原理为: 饱和
饱和 .
.
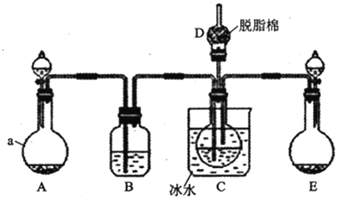
现用如图所示装置和上述原理制取碳酸氢钠晶体,图中夹持装置已略去.
可选用的药品有:①石灰石②生石灰③ 盐酸④稀硫酸⑤浓氨水⑥饱和氯化钠溶液⑦饱和碳酸氢钠溶液
盐酸④稀硫酸⑤浓氨水⑥饱和氯化钠溶液⑦饱和碳酸氢钠溶液
请回答下列问题
(1)仪器a的名称是______.
(2) 中应选用的药品是______
中应选用的药品是______ 填序号
填序号
(3)在实验过程中,应先向C中通入的气体的化学式是______,其原因是______.
(4) 中脱脂棉应浸润的试剂是______
中脱脂棉应浸润的试剂是______ 填写字母编号
填写字母编号
 浓硫酸
浓硫酸  稀硫酸
稀硫酸  氢氧化钠溶液
氢氧化钠溶液  浓硝酸
浓硝酸
(5)该小组同学为了测定C中所得晶体中碳酸氢钠的纯度 假设晶体中不含碳酸盐杂质
假设晶体中不含碳酸盐杂质 ,先将晶体充分干燥后,称量质量为wg,称量质量为wg,然后进行如下图所示实验:
,先将晶体充分干燥后,称量质量为wg,称量质量为wg,然后进行如下图所示实验:

 操作Ⅲ中的方法是______,______,______
操作Ⅲ中的方法是______,______,______
 所得晶体中碳酸氢钠的纯度是______
所得晶体中碳酸氢钠的纯度是______ 不必化简
不必化简

















