-
(14分)煤可以通过气化和液化转变为清洁能源并提高燃烧效率。
煤气化的主要反应是:C(g)+ H2O(g) CO(g)+H2(g)
CO(g)+H2(g)
气化得到的CO和H2可以进一步液化合成甲醇,反应方程式为:
CO(g)+2H2(g) CH3OH(g) ∆H
CH3OH(g) ∆H
(1)若相同温度下CO、H2、CH3OH(g)的燃烧热(∆H)分别为a、b、c,则上述反应的∆H= 。

(2)图1表示CO的转化率与温度、压强之间的关系,图2表示CO的转化率与起始投料比n(H2)/n(CO)、温度的变化关系,曲线I、Ⅱ、Ⅲ对应的温度分别为T1、T2、T3,则T1、T2、T3的大小关系为 ,理由 。测得B(X,60)点氢气的转化率为40%,则X= 。
(3)一定条件下,将2 mol CO和4 mol H2置于容积为2 L固定的密闭容器中发生上述反应,反应达到平衡时H2的物质的量为2 mol,则此时CH3OH(g)的物质的量浓度为 ,平衡常数K= 。下列说法中能说明反应已达到平衡状态的是 (填选项前的字母)。
A.混合气体的平均摩尔质量不变
B.一氧化碳的消耗速率等于甲醇的生成速率
C.CO和H2的物质的量之比保持不变
D.混合气体的密度不变
-
为了更好地解决能源问题,人们一方面研究如何提高燃煤的燃烧效率,另一方面寻找能源,以下做法不能提高燃烧效率的是( )
A.煤的气化与液化 B.液体燃料呈雾状喷出
C.通入大量的空气 D.将煤粉碎
-
(14分)煤炭气化可以提高燃料的利用率,又可以合成新型能源。
(1)煤炭气化时发生的反应为:C(s)+H2O(g) H2(g)+CO(g)。
H2(g)+CO(g)。
①已知:2C (s)+O2 (g)=2CO (g);△H1=–221.0 kJ mol–1
2H2 (g)+O2 (g)=2H2O (g);△H2=–483.6 kJ mol–1
则煤气化反应的△H=________。
②煤气化反应的平衡常数表达式K=________,温度升高,平衡常数________。
(2)水煤气可以合成甲醇:CO(g)+2H2(g) CH3OH(g)。一定条件下,向体积为1 L的密闭容器中充入1 mol CO和3 mol H2,反应达到平衡状态时,CO的平衡转化率为75%。
CH3OH(g)。一定条件下,向体积为1 L的密闭容器中充入1 mol CO和3 mol H2,反应达到平衡状态时,CO的平衡转化率为75%。
①从反应开始到平衡,H2的平均反应速率υ(H2)=________。
②反应达平衡后充入适量氢气并维持H2浓度和容器的温度不变,增大容器的体积,跟原平衡相比较达到新平衡时CO的转化率________(填“增大”、“不变”或“减小”),其原因是________。
③将3.2 g甲醇充分燃烧后的产物通入75 mL2 mol/L的NaOH溶液,所得溶液中离子浓度大小顺序为________。
-
党的十七报告中指出:“加强能源节约和生态环境保护,增强可持续发展的动力.坚持节约资源和保护环境的基本国策,发展环保产业”.下列做法不符合这一要求的是( )
A.将煤液化、气化,提高燃料的燃烧效率
B.安装汽车尾气催化转化装置,使之发生如下反应:4CO+2NO2 4CO2+N2
4CO2+N2
C.在大力推广乙醇汽油的同时,研究开发太阳能汽车和氢燃料电池汽车
D.在水力发电、火力发电、核能发电和风力发电中,要大力发展火力发电
-
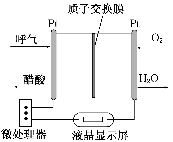
煤直接燃烧的能量利用率较低,为提高其利用率,工业上将煤气化(转变成CO和H2)后再合成乙醇、二甲醚等多种能源。
(1)如图所示是一种酸性燃料电池酒精检测仪,具有自动吹气流 量侦测与控制的功能,非常适合进行现场酒精检测。该电池的负极反应式为______________________。
(2)煤气化所得气体可用于工业合成二甲醚,其反应如下:
2CO(g)+4H2(g) CH3OCH3(g)+H2O(g)。
CH3OCH3(g)+H2O(g)。
同时发生副反应:CO(g)+2H2(g) CH3OH(g);CO(g)+H2O(g)CO2(g)+H2(g)。
CH3OH(g);CO(g)+H2O(g)CO2(g)+H2(g)。
在温度为250 ℃、压强为3.0 MPa时,某工厂按投料比V(H2)∶V(CO) =a进行生产,平衡时反应体系中各组分的体积分数如下表:
| 物质 | H2 | CO | CO2 | (CH3)2O | CH3OH(g) | H2O(g) |
| 体积分数 | 0.54 | 0.045 | 0.18 | 0.18 | 0.015 | 0.03 |
①投料比a=________;
②250℃时反应CO(g)+H2O(g) CO2(g)+H2(g)的平衡常数K=________。
CO2(g)+H2(g)的平衡常数K=________。
-
【化学― 化学与技术】煤炭被人们誉为黑色的金子,它是人类使用的主要能源之一。为了提高煤的利用率,减少有害气体的排放.人们采取了各式各样的方法。
(1)煤的气化和液化可以提高煤的利用率.煤的气化技术的主要产物是_________。煤的液化技术又分为直接液化和间接氧化.将煤隔绝空气加强热得到焦炉气、煤焦油及焦炭等产品的技术称为__________。
(2)煤在燃烧前、后及燃烧过程中均可采取措施减少有害气体的排放。
①在燃烧前,可以采用微生物脱硫技术。原理如下:
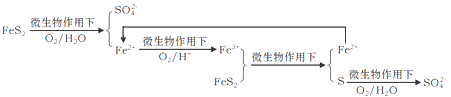
上述过程中Fe2+的作用为__________。写出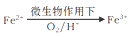 的离子方程式______________。
的离子方程式______________。
②煤在燃烧时,进行脱硫处理,常采用_______燃烧技术,在把煤和脱硫剂加入锅炉燃烧室,使煤与空气在流化过程中充分混合、燃烧,起到固硫作用。常用脱硫剂的主要化学成分为_______(填化学式)。
③煤在燃烧后,烟气净化常采用除尘技术和脱硫、脱硝技术.湿法脱硫、脱硝技术中将烟气通入_______设备,用石灰水淋洗。
-
【化学—选修2:化学与技术】煤炭被人们誉为黑色的“金子”,它是人类使用的主要能源之一。为了提高煤的利用率,减少有害气体的排放,人们采取了各式各样的方法。
(l)煤的气化和液化可以提高煤的利用率。煤的气化技术的主要产物是 。煤的液化技又分为 。将煤隔绝空气加强热得到焦炉气、煤焦油及焦炭等产品的技术称为 。
(2)煤在燃烧前后及燃烧过程中均可采取措施减少有害气体的排放
①在燃烧前,可以采用微生物脱硫技术。原理如图23所示:

图示过程中Fe2+的作用为 。写出 的离子方程式: 。
的离子方程式: 。
②煤在燃烧时,进行脱硫处理,常采用 燃烧技术,再把煤和脱硫剂加入锅炉燃烧室,使煤与空气在流化过程中充分混合、燃烧,起到固硫作用。常用脱硫剂的主要化学成分为 (填化学式)。
③煤在燃烧后,烟气净化常采用除尘技术和脱硫、脱硝技术。湿法脱硫、脱硝技术中将烟气通入 设备,用石灰水淋洗。
-
【化学—选修2:化学与技术】煤炭被人们誉为黑色的“金子”,它是人类使用的主要能源之一。为了提高煤的利用率,减少有害气体的排放,人们采取了各式各样的方法。
(l)煤的气化和液化可以提高煤的利用率。煤的气化技术的主要产物是 。煤的液化技又分为 。将煤隔绝空气加强热得到焦炉气、煤焦油及焦炭等产品的技术称为
(2)煤在燃烧前后及燃烧过程中均可采取措施减少有害气体的排放
①在燃烧前,可以采用微生物脱硫技术。原理如图所示:
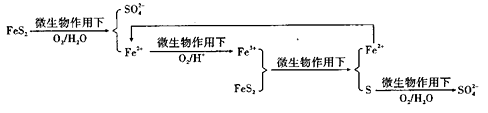
图示过程中Fe2+的作用为 写出 的离子方程式:
的离子方程式:
②煤在燃烧时,进行脱硫处理,常采用 燃烧技术,再把煤和脱硫剂加入锅炉燃烧室,使煤与空气在流化过程中充分混合、燃烧,起到固硫作用。常用脱硫剂的主要化学成分为 (填化学式)。
③煤在燃烧后,烟气净化常采用除尘技术和脱硫、脱硝技术。湿法脱硫、脱硝技术中将烟气通入
设备,用石灰水淋洗。
-
氢气是一种新型的绿色能源,又是一种重要的化工原料。以生物材质(以C计)与水蒸气反应制取H2是一种低耗能,高效率的制H2方法。该方法由气化炉制造H2和燃烧炉再生CaO两步构成。气化炉中涉及的反应有:
Ⅰ.C(s)+H2O(g) CO(g)+H2(g) K1;
CO(g)+H2(g) K1;
Ⅱ.CO(g)+H2O(g) CO2(g)+H2(g) K2;
CO2(g)+H2(g) K2;
Ⅲ.CaO(s)+CO2(g) CaCO3(s) K3;
CaCO3(s) K3;
燃烧炉中涉及的反应为:
Ⅳ.C(s)+O2(g)=CO2;
Ⅴ.CaCO3(s)=CaO(s)+CO2(g)。
(1)氢能被视为最具发展潜力的绿色能源,该工艺制H2总反应可表示为C(s)+2H2O(g)+CaO(s) CaCO3(s)+2H2(g),其反应的平衡常数K=____(用K1、K2、K3的代数式表示)。
CaCO3(s)+2H2(g),其反应的平衡常数K=____(用K1、K2、K3的代数式表示)。
(2)在一容积可变的密闭容器中进行反应Ⅰ,恒温恒压条件下,向其中加入1.0mol炭和1.0mol水蒸气,达到平衡时,容器的体积变为原来的1.25倍,平衡时水蒸气的平衡转化率为_____;向该容器中补充amol炭,水蒸气的转化率将_____(填“增大”、“减小”或“不变”)。
(3)对于反应Ⅲ,若平衡时再充入CO2,使其浓度增大到原来的2倍,则平衡_____移动( 填“向右”、“向左”或“不”);当重新平衡后,CO2浓度___(填“变大”、“变小”或“不变”)。
(4)一种新型锂离子二次电池——磷酸铁锂(LiFePO4)电池。作为正极材料的磷酸铁锂在充、放电时的局部放大示意图如图,写出该电池充电时的阳极电极反应式:______。
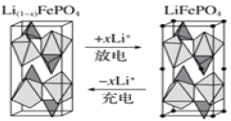
-
氢气是一种新型的绿色能源,又是一种重要的化工原料。以生物材质(以C计)与水蒸气反应制取H2是一种低耗能,高效率的制H2方法。该方法由气化炉制造H2和燃烧炉再生CaO两步构成。气化炉中涉及的反应有:
Ⅰ.C(s)+H2O(g) CO(g)+H2(g) K1;
CO(g)+H2(g) K1;
Ⅱ.CO(g)+H2O(g) CO2(g)+H2(g) K2;
CO2(g)+H2(g) K2;
Ⅲ.CaO(s)+CO2(g) CaCO3(s) K3;
CaCO3(s) K3;
燃烧炉中涉及的反应为:
Ⅳ.C(s)+O2(g)=CO2;
Ⅴ.CaCO3(s)=CaO(s)+CO2(g)。
(1)氢能被视为最具发展潜力的绿色能源,该工艺制H2总反应可表示为C(s)+2H2O(g)+CaO(s) CaCO3(s)+2H2(g),其反应的平衡常数K=____(用K1、K2、K3的代数式表示)。
CaCO3(s)+2H2(g),其反应的平衡常数K=____(用K1、K2、K3的代数式表示)。
(2)在一容积可变的密闭容器中进行反应Ⅰ,恒温恒压条件下,向其中加入1.0mol炭和1.0mol水蒸气,达到平衡时,容器的体积变为原来的1.25倍,平衡时水蒸气的平衡转化率为_____;向该容器中补充amol炭,水蒸气的转化率将_____(填“增大”、“减小”或“不变”)。
(3)对于反应Ⅲ,若平衡时再充入CO2,使其浓度增大到原来的2倍,则平衡_____移动( 填“向右”、“向左”或“不”);当重新平衡后,CO2浓度___(填“变大”、“变小”或“不变”)。
(4)一种新型锂离子二次电池——磷酸铁锂(LiFePO4)电池。作为正极材料的磷酸铁锂在充、放电时的局部放大示意图如图,写出该电池充电时的阳极电极反应式:______。
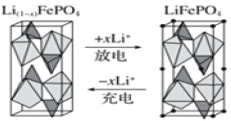
CO(g)+H2(g)
CH3OH(g) ∆H


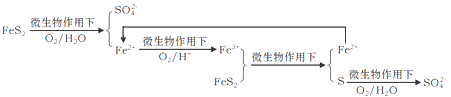
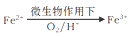 的离子方程式______________。
的离子方程式______________。


