-
废弃物的综合利用既有利于节约资源,又有利于保护环境。实验室利用废旧电池的铜帽(Cu、Zn 总含量约为99%)回收Cu并制备ZnO 的部分实验过程如下:
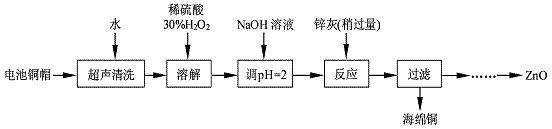
(1)写出铜帽溶解时铜与加入的稀硫酸、30%H2O2反应的离子反应方程式: ;铜帽溶解完全后,需加热(至沸)将溶液中过量的H2O2除去。
(2)为确定加入锌灰(主要成分为Zn、ZnO,杂质为铁及其氧化物)的量,实验中需测定除去H2O2 后溶液中Cu2+的含量。实验操作为:准确量取一定体积的含有Cu2+的溶液于带塞锥形瓶中,加适量水稀释,调节溶液pH=3~4,加入过量的KI,用Na2S2O3标准溶液滴定至终点。上述过程中反应的离子方程式如下:
2Cu2++4I-=2CuI(白色)↓+I2 2S2O32-+I2=2I-+S4O62-
①滴定选用的指示剂为 ,滴定终点观察到的现象为 ;
②某同学称取1.0g电池铜帽进行实验,得到100.00mL含有Cu2+的溶液,量取20.00mL上述含有Cu2+的溶液于带塞锥形瓶中,加适量水稀释,调节溶液pH=3~4,加入过量的KI,用0.1000mol/L Na2S2O3标准溶液滴定至终点。再重复操作实验3次,记录数据如下:
| 实验编号 | 1 | 2 | 3[ | 4 |
| V(Na2S2O3)(mL) | 28.32 | 25.31 | 25.30 | 25.32 |
计算电池铜帽中Cu的质量分数为 ,(结果保留四位有效数字)若滴定前溶液中的H2O2没有除尽,则所测定c (Cu2+)将会 (填“偏高”、“偏低”或“无影响”);
(3)常温下,若向50mL 0.0001mol/L CuSO4溶液中加入50mL0.00022mol/LNaOH溶液,生成了沉淀。已知KSP[Cu (OH)2] =2.0×10-20(mol/L)3,计算沉淀生成后溶液中c(Cu2+)= mol/L;
(4)已知pH>11 时Zn(OH)2 能溶于NaOH溶液生成[Zn(OH)4]2-。下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH 按金属离子浓度为1.0 mol·L-1计算)。
| 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Zn2+ | 5.9 | 8.9 |
实验中可选用的试剂:30%H2O2、1.0 mol·L-1HNO3、1.0 mol·L-1NaOH。由除去铜的滤液制备ZnO的实验步骤依次为:①向滤液中加入适量30% H2O2,使其充分反应;
② ;③过滤;
④ ;⑤过滤、洗涤、干燥;⑥900℃煅烧。
-
废弃物的综合利用既有利于节约资源,又有利于保护环境。实验室利用废旧电池的铜帽(Cu、Zn 总含量约为99%)回收Cu并制备ZnO 的部分实验过程如下:
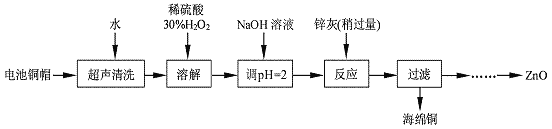
(1)写出铜帽溶解时铜与加入的稀硫酸、30%H2O2反应的离子反应方程式:_________________;铜帽溶解完全后,需加热(至沸)将溶液中过量的H2O2除去。
(2)为确定加入锌灰(主要成分为Zn、ZnO,杂质为铁及其氧化物)的量,实验中需测定除去H2O2 后溶液中Cu2+的含量。实验操作为:准确量取一定体积的含有Cu2+的溶液于带塞锥形瓶中,加适量水稀释,调节溶液pH=3~4,加入过量的KI,用Na2S2O3标准溶液滴定至终点。上述过程中反应的离子方程式如下:
2Cu2++4I-=2CuI(白色)↓+I2 2S2O32-+I2=2I-+S4O62-
①滴定选用的指示剂为___________,滴定终点观察到的现象为_______________;
②某同学称取1.0g电池铜帽进行实验,得到100.00mL含有Cu2+的溶液,量取20.00mL上述含有Cu2+的溶液于带塞锥形瓶中,加适量水稀释,调节溶液pH=3~4,加入过量的KI,用0.1000mol/L Na2S2O3标准溶液滴定至终点。再重复操作实验3次,记录数据如下:
| 实验编号 | 1 | 2 | 3 | 4 |
| V(Na2S2O3)(mL) | 28.32 | 25.31 | 25.30 | 25.32 |
计算电池铜帽中Cu的质量分数为__________,(结果保留四位有效数字)若滴定前溶液中的H2O2没有除尽,则所测定c (Cu2+)将会___________(填“偏高”、“偏低”或“无影响”);
(3)常温下,若向50mL 0.0001mol/L CuSO4溶液中加入50mL0.00022mol/LNaOH溶液,生成了沉淀。已知KSP[Cu (OH)2] =2.0×10-20(mol/L)3,计算沉淀生成后溶液中c(Cu2+)= _____ mol/L;
(4)已知pH>11 时Zn(OH)2 能溶于NaOH溶液生成[Zn(OH)4]2-。下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH 按金属离子浓度为1.0 mol·L-1计算)。
| 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Zn2+ | 5.9 | 8.9 |
实验中可选用的试剂:30%H2O2、1.0 mol·L-1HNO3、1.0 mol·L-1NaOH。由除去铜的滤液制备ZnO的实验步骤依次为:①向滤液中加入适量30% H2O2,使其充分反应;
②_______________________;③过滤;
④______________________;⑤过滤、洗涤、干燥;⑥900℃煅烧。
-
废弃物的综合利用既有利于节约资源,又有利于保护环境。实验室利用废旧电池的铜帽(Cu、Zn 总含量约为99%)回收Cu并制备ZnO 的部分实验过程如下: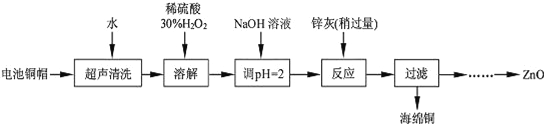
(1)写出铜帽溶解时铜与加入的稀硫酸、30%H2O2 反应的离子反应方程式______________________;铜帽溶解完全后,需加热(至沸)将溶液中过量的H2O2除去。
(2)为确定加入锌灰(主要成分为Zn、ZnO,杂质为铁及其氧化物)的量,实验中需测定除去H2O2 后溶液中Cu2+的含量。实验操作为:准确量取一定体积的含有Cu2+的溶液于带塞锥形瓶中,加适量水稀释,调节溶液pH=3~4,加入过量的KI,用Na2S2O3标准溶液滴定至终点。上述过程中反应的离子方程式如下:2Cu2++4I﹣═2CuI(白色)↓+I2 2S2O32﹣+I2═2I﹣+S4O62﹣
①滴定选用的指示剂为______________,滴定终点观察到的现象为_______________________________;
②某同学称取1.0g电池铜帽进行实验,得到100.00mL含有Cu2+的溶液,量取20.00mL上述含有Cu2+的溶液于带塞锥形瓶中,加适量水稀释,调节溶液pH=3~4,加入过量的KI,用0.1000mol/L Na2S2O3标准溶液滴定至终点。再重复操作实验3次,记录数据如下:
| 实验编号 | 1 | 2 | 3 | 4 |
| V(Na2S2O3)(mL) | 28.32 | 25.31 | 25.30 | 25.32 |
计算电池铜帽中Cu的质量分数为__,(结果保留四位有效数字)若滴定前溶液中的H2O2没有除尽,则所测定c (Cu2+)将会__(填“偏高”、“偏低”或“无影响”);
(3)常温下,若向50mL 0.0001mol/L CuSO4溶液中加入50mL0.00022mol/LNaOH溶液,生成了沉淀。已知KSP[Cu (OH)2]=2.0×10﹣20,计算沉淀生成后溶液中c(Cu2+)=__mol/L;
(4)已知pH>11 时Zn(OH)2 能溶于NaOH溶液生成[Zn(OH)4]2﹣。下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH 按金属离子浓度为1.0mol•L﹣1计算)。
| 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Zn2+ | 5.9 | 8.9 |
实验中可选用的试剂:30%H2O2、1.0mol•L﹣1HNO3、1.0mol•L﹣1NaOH。由除去铜的滤液制备ZnO的实验步骤依次为:①向滤液中加入适量30% H2O2,使其充分反应;
②加入适量的1.0mol•L﹣1NaOH调节pH,产生沉淀;③过滤;
④______________;⑤过滤、洗涤、干燥;⑥900℃煅烧。
-
废弃物的综合利用既有利于节约资源,又有利于保护环境.实验室利用废旧电池的铜帽(Cu、Zn 总含量约为99%)回收Cu并制备ZnO 的部分实验过程如下:
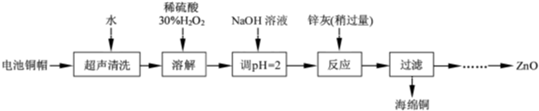
(1)①铜帽溶解时加入H2O2 的目的是________(用化学方程式表示).②铜帽溶解完全后,需将溶液中过量的H2O2 除去.除去H2O2 的简便方法是________.
(2)为确定加入锌灰(主要成分为Zn、ZnO,杂质为铁及其氧化物)的量,实验中需测定除去H2O2 后溶液中Cu2+的含量.实验操作为:准确量取一定体积的含有Cu2+的溶液于带塞锥形瓶中,加适量水稀释,调节溶液pH=3~4,加入过量的KI,用Na2S2O3标准溶液滴定至终点.上述过程中反应的离子方程式如下:摇摇2Cu2++4I-=2CuI(白色)↓+I2 2S2O32-+I2=2I-+S4O62-
①滴定选用的指示剂为________,滴定终点观察到的现象为________.
②若滴定前溶液中的H2O2 没有除尽,所测定的Cu2+含量将会________(填“偏高”、“偏低”或“不变”).
(3)已知pH>11 时Zn(OH)2 能溶于NaOH溶液生成[Zn(OH)4]2-.下表列出了几种离子生成氢氧化物沉淀的pH.
| 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Zn2+ | 5.9 | 8.9 |
实验中可选用的试剂:30%H2O2、1.0mol•L-1HNO3、1.0mol•L-1NaOH.由除去铜的滤液制备ZnO 的实验步骤依次为:
①________;②________;③过滤;④________;⑤过滤、洗涤、干燥;⑥900℃煅烧.
-
废弃物的综合利用既有利于节约资源,又有利于保护环境。实验室利用废旧电池的铜帽(Cu、Zn总含量约为99%)回收Cu并制备ZnO的部分实验过程如图:
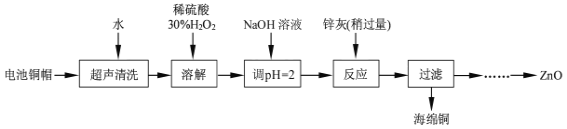
(1)①写出铜帽溶解时铜与加入的稀硫酸、30%H2O2反应的离子反应方程式___。
②铜帽溶解完全后,需将溶液中过量的H2O2除去。除去H2O2的简便方法是___。
(2)为确定加入锌灰(主要成分为Zn、ZnO,杂质为铁及其氧化物)的量,实验中需测定除去H2O2后溶液中Cu2+的含量。
实验操作为:准确量取一定体积的含有Cu2+的溶液于带塞锥形瓶中,加适量水稀释,调节溶液pH=3~4,加入过量的KI,用Na2S2O3标准溶液滴定至终点。上述过程中反应的离子方程式如下:2Cu2++4I-=2CuI↓(白色)+I2,2S2O32-+I2=2I-+S4O62-
滴定选用的指示剂为___,达到滴定终点观察到的现象为___。
(3)常温下,若向50mL0.0001mol/LCuSO4溶液中加入50mL0.00022mol/LNaOH溶液,生成了沉淀。已知KSP[Cu(OH)2]=2.0×10-20(mol/L)3,计算沉淀生成后溶液中c(Cu2+)=__mol/L;
(4)已知pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2-。下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol·L-1计算)。
| 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Zn2+ | 5.9 | 8.9 |
实验中可选用的试剂:30%H2O2、1.0mol·L-1HNO3、1.0mol·L-1NaOH。由除去铜的滤液制备ZnO的实验步骤依次为:①向滤液中加入适量30%H2O2,使其充分反应;
②___;③过滤;④___;⑤过滤、洗涤、干燥;⑥900℃煅烧。
-
废弃物的综合利用既有利于节约资源,又有利于保护环境。实验室利用废旧电池的铜帽(Cu、Zn总含量约为99%)回收Cu并制备ZnO的部分实验过程如下:
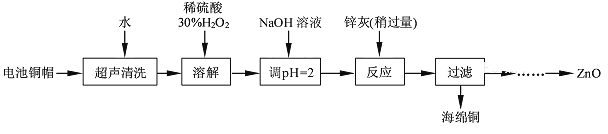
(1)铜帽溶解时加入H2O2的目的是_________________________(用化学方程式表示)。
(2)为确定加入锌灰(主要成分为Zn、ZnO,杂质为铁及其氧化物)的量,实验中需测定除去H2O2后溶液中Cu2+的含量。实验操作为:准确量取一定体积的含有Cu2+的溶液于带塞锥形瓶中,加适量水稀释,调节溶液pH=3~4,加入过量的KI,用Na2S2O3标准溶液滴定至终点。上述过程中反应的离子方程式如下:2Cu2++4I-=2CuI(白色)↓+I2;2S2O32-+I2=2I-+S4O62-。
①滴定选用的指示剂为淀粉溶液,滴定终点观察到的现象为_______________________。
②若滴定前溶液中的H2O2没有除尽,所测定的Cu2+含量将会_______(填“偏高”、“偏低”或“不变”)。
(3)已知pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2-。下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)。
| 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Zn2+ | 5.9 | 8.9 |
实验中可选用的试剂:30%H2O2、1.0 mol·L-1HNO3、1.0 mol·L-1NaOH。由除去铜的滤液制备ZnO的实验步骤依次为:①向滤液中加入适量30%H2O2,使其充分反应;②滴加1.0mol·L-1NaOH,调节溶液pH范围:________;③过滤;④向滤液中滴加1.0mol·L-1NaOH,调节溶液pH范围:___________;⑤过滤、洗涤、干燥;⑥900℃煅烧。
-
废弃物的综合利用既有利于节约资源,又有利于保护环境。实验室利用废旧电池的铜帽(Cu、Zn总含量约为99%)回收Cu并制备ZnO的部分实验过程如下:
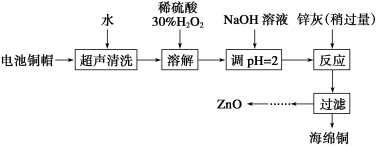
(1)①铜帽溶解时加入H2O2的目的是________________________________________
(用化学方程式表示)。
②铜帽溶解完全后,需将溶液中过量的H2O2除去。除去H2O2的简便方法是_______________________________________________________________。
(2)为确定加入锌灰(主要成分为Zn、ZnO,杂质为铁及其氧化物)的量,实验中需测定除去H2O2后溶液中Cu2+的含量。实验操作为:准确量取一定体积的含有Cu2+的溶液于带塞锥形瓶中,加适量水稀释,调节溶液pH=3~4,加入过量的KI,用Na2S2O3标准溶液滴定至终点。上述过程中发生反应的离子方程式如下:
2Cu2++4I-=2CuI(白色)↓+I2
2S2O32—+I2=2I-+S4O62—
①滴定选用的指示剂为__________,滴定终点观察到的现象为__________________。
②若滴定前溶液中的H2O2没有除尽,所测定的Cu2+含量将会________(填“偏高”、“偏低”或“不变”)。
(3)已知pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2-。下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)。
| 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Zn2+ | 5.9 | 8.9 |
、实验中可选用的试剂:30% H2O2、1.0 mol·L-1 HNO3、1.0 mol·L-1 NaOH。
由除去铜的滤液制备ZnO的实验步骤依次为
①______________________________________;
②________________________________________;
③过滤;
④_________________________________________;
⑤过滤、洗涤、干燥;
⑥900 ℃煅烧。
-
废弃物的综合利用既有利于节约资源,又有利于保护环境。实验室利用废弃旧电池的铜帽(Zn、Cu总含量约为99%)回收铜并制备ZnO的部分实验过程如下:
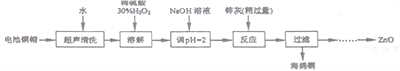
(1)①铜帽溶解时加入H2O2的目的是___________________(用化学方程式表示)。
②铜帽溶解后需将溶液中过量H2O2除去。除去H2O2的简便方法是_________________。
(2)为确定加入锌灰(主要成分为Zn、ZnO,杂质为铁及其氧化物)含量,实验中需测定除去H2O2后溶液中Cu2+的含量。实验操作为:准确取一定体积的含有Cu2+ 的溶液于带塞锥形瓶中,加适量水稀释,调节pH=3~4,加入过量KI,用Na2S2O3标准溶液滴定至终点。上述过程中的离子方程式如下:2Cu2++4I-=2CuI(白色)↓+I2 I2+2S2O32-=2I-+S4O62-
①滴定选用的指示剂为_____________,滴定终点观察到的现象为_________________。
②若滴定前溶液中H2O2没有除尽,所测定的Cu2+的含量将会__________(填“偏高”“ 偏低”“ 不变”)。
(3)已知pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2-。下表列出了几种离子生成氢氧化物沉淀pH(开始沉淀的pH按金属离子浓度为1.0mol·L-1计算)
| 开始沉淀的pH | 完全沉淀的pH |
| Fe3+ | 1.1 | 3.2 |
| Fe 2+ | 5.8 | 8.8 |
| Zn2+ | 5.9 | 8.9 |
实验中可选用的试剂:30% H2O2、1.0 mol·L-1 HNO3、 1.0 mol·L-1NaOH。
由除去铜的滤液制备ZnO的实验步骤依次为:
①向滤液中加入___________使其充分反应;②滴加1.0 mol·L-1的氢氧化钠,调节3.2≤pH<5.9,使___________沉淀完全;③过滤;④向滤液中滴加1.0 mol·L-1的氢氧化钠,调节pH为________≤pH≤_______,使Zn2+沉淀完全,⑤过滤、洗涤、干燥;⑥900℃煅烧。
-
实验室利用废弃旧电池的铜帽(Zn、Cu总含量约为99%)回收Cu并制备ZnO的部分实验过程如图所示:
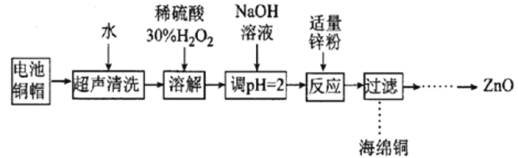
下列叙述错误的是
A.合理处理废弃旧电池的铜帽既有利于节约资源,又有利于保护环境
B.“溶解”操作中可用酸性条件下不断鼓入O2代替H2O2
C.加入锌粉反应的离子为Cu2+
D.“过滤”操作后直接将溶液蒸发结晶、高温灼烧得到ZnO
-
废弃物的综合利用有利于节约资源、保护环境。实验室利用废旧电池的铜帽(主要成分为Cu、Zn)制备CuSO4·5H2O的部分实验步骤如图:
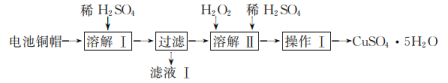
下列说法错误的是( )
A.“溶解I”中,为加快溶解速率,可将铜帽粉碎
B.“滤液I”中,溶质的主要成分为ZnSO4
C.“溶解II”过程中,有大量的气体产生
D.“操作I”需要用到酒精灯玻璃棒等仪器