-
本题为《化学反应原理(选修4)》
(1)t℃时,将2molSO2和1molO2通入体积为2L的恒温恒容密闭容器中,发生如下反应:2SO2 (g)+O2(g) 2SO3(g),△H=-196.6kJ·mol-1。2min时反应达到化学平衡状态,此时测得反应物O2还剩余0.8mol,填写下列空白:
2SO3(g),△H=-196.6kJ·mol-1。2min时反应达到化学平衡状态,此时测得反应物O2还剩余0.8mol,填写下列空白:
① 从反应开始到化学平衡状态,生成SO3的平均反应速率为_____;此时反应物O2的转化率是___________;
② 下列叙述能证明该反应已达到化学平衡状态的是______(填标号,下同);
A.容器内压强不再发生变化
B. SO2的体积分数不再发生变化
C. 容器内气体原子总数不再发生变化
D. 相同时间内消耗2nmol SO2的同时消耗n molO2
③t℃时,若将4mol SO2和2mol O2的混合气体通入上述恒温恒容密闭容器中,反应重新达到平衡时SO2的转化率与① 比较_______(填“增大”、“不变”或“减小”)。
(2)今有常温下的下列溶液:
①0.1mol/LFeC13 溶液呈_______(填“酸性”、“中性”或“碱性”);
② 实验测得0.1mol/LNaHCO3溶液pH>7,则NaHCO3的电离程度_______水解程度(填“大于”、“等于”或“小于”)。
③ 在0.10mol/L硫酸铜溶液中加入氢氧化钠稀溶液充分反应有浅蓝色氢氧化铜沉淀生成,当溶液的pH=8时,c(Cu2+)=_________(已知Ksp[Cu(OH)2]=2.2×10-2O)。
(3)①事实证明,原电池中发生的反应通常是放热反应。利用下列反应可以设计为原电池的是_________;
A. C(s)+H2O(g)=CO(g)+H2(g) △H>0
B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) △H<0
C.2H2(g)+O2(g)=H2O(l)△H<0
② 以KOH溶液为电解质溶液,依据所选反应设计一个原电池,其正极反应式是________;
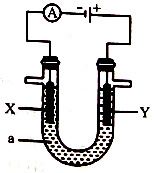
③ 电解原理在工业上有着广泛的应用。下图所示电解池中,a为CuSO4溶液,X和Y为惰性电极,则Y电极附近溶液的pH变化是_______(填“增大”“不变”或“减小”)。
-
t℃时,将2molSO2和1molO2通入体积为2L的恒温恒容密闭容器中,发生如下反应:
2SO2(g)+ O2(g) 2SO3(g),△H=-196.6 kJ/mol.2 min时反应达到化学平衡,此时测得反应物O2还乘余0.8 mol,请填写下列空白:
2SO3(g),△H=-196.6 kJ/mol.2 min时反应达到化学平衡,此时测得反应物O2还乘余0.8 mol,请填写下列空白:
(1)从反应开始到达化学平衡,生成SO3的平均反应速率为 ;平衡时SO2转化率为 。
(2)下列叙述能证明该反应已达到化学平衡状态的是(填标号 ,下同) 。
,下同) 。
A.溶器内压强不再发生变化
B.SO2的体积分数不再发生变化
C.容器内气体原子总数不再发生变化
D.相同时间内消耗2nmolSO2的同时消耗nmolO2
E.相同时间内消耗2nmolSO2的同时生成nmolO2
(3)反应达到化学平衡后,以下操作将引起平衡向正反方向移动并能提高SO2转化率的是 。
A.向容器中通入少量O2 B.向容器中通入少量SO2
C.使用催化剂 D.降低温度
E.向容器中通入少量氦气(已知:氦气和SO2、O2、SO3都不发生反应)
(4)t2℃时,若将物质的量之比n(SO2):n(O2)=1:1的混合气体通入一个恒温恒压的密闭容器中,反应达到平衡时,混合气体体积减少了20%,SO2的转化率为 。
-
(10分)t℃时,将2molSO2和1molO2通入体积为2L的恒温恒容密闭容器中,发生如下反应:2SO2(g)+O2(g) 2SO3(g),△H=-196.6kJ/mol. 2min时反应达到化学平衡,此时测得反应物O2还乘余0.8mol,请填写下列空白:
2SO3(g),△H=-196.6kJ/mol. 2min时反应达到化学平衡,此时测得反应物O2还乘余0.8mol,请填写下列空白:
(1)从反应开始到达化学平衡,生成SO3的平均反应速率为________;平衡时SO2转化率为________。
(2)下列叙述能证明该反应已达到化学平衡状态的是(填标号,下同)________。
A.溶器内压强不再发生变化
B.SO2的体积分数不再发生变化
C.容器内气体原子总数不再发生变化
D.相同时间内消耗2nmolSO2的同时消耗nmolO2
E.相同时间内消耗2nmolSO2的同时生成nmolO2
(3)反应达到化学平衡后,以下操作将引起平衡向正反方向移动并能提高SO2转化率的是________。
A.向容器中通入少量O2
B.向容器中通入少量SO2
C.使用催化剂
D.降低温度
E.向容器中通入少量氦气(已知:氦气和SO2、O2、SO3都不发生反应)
(4)t2℃时,若将物质的量之比n(SO2):n(O2)=1:1的混合气体通入一个恒温恒压的密闭容器中,反应达到平衡时,混合气体体积减少了20%。SO2的转化率为________。
-
t℃时,将2molSO2和1molO2通入体积为2L的恒温恒容密闭容器中,发生如下反应:
2SO2(g)+ O2(g) 2SO3(g),△H=-196.6 kJ/mol.2 min时反应达到化学平衡,此时测得反应物O2还乘余0.8 mol,请填写下列空白:
2SO3(g),△H=-196.6 kJ/mol.2 min时反应达到化学平衡,此时测得反应物O2还乘余0.8 mol,请填写下列空白:
(1)从反应开始到达化学平衡,生成SO3的平均反应速率为 ;平衡时SO2转化率为 。
(2)下列叙述能证明该反应已达到化学平衡状态的是(填标号 ,下同) 。
,下同) 。
A.溶器内压强不再发生变化
B.SO2的体积分数不再发生变化
C.容器内气体原子总数不再发生变化
D.相同时间内消耗2nmolSO2的同时消耗nmolO2
E.相同时间内消耗2nmolSO2的同时生成nmolO2
(3)反应达到化学平衡后,以下操作将引起平衡向正反方向移动并能提高SO2转化率的是 。
A.向容器中通入少量O2 B.向容器中通入少量SO2
C.使用催化剂 D.降低温度
E.向容器中通入少量氦气(已知:氦气和SO2、O2、SO3都不发生反应)
(4)t2℃时,若将物质的量之比n(SO2):n(O2)=1:1的混合气体通入一个恒温恒压的密闭容器中,反应达到平衡时,混合气体体积减少了20%,SO2的转化率为 。
-
t℃时,将2molSO2和1molO2通入体积为2L的恒温恒容密闭容器中,发生如下反应:2SO2(g)+O2(g) 2SO3(g),△H=-196.6kJ/mol. 2min时反应达到化学平衡,此时测得反应物O2还乘余0.8mol,请填写下列空白:
2SO3(g),△H=-196.6kJ/mol. 2min时反应达到化学平衡,此时测得反应物O2还乘余0.8mol,请填写下列空白:
(1)从反应开始到达化学平衡, O2的平均反应速率为___________;平衡时SO2物质的量为___________。
(2)下列叙述不能证明该反应已达到化学平衡状态的是(填标号,下同)___________。
A.容器内压强不再发生变化
B.SO2的体积分数不再发生变化
C.容器内气体原子总数不再发生变化
D.相同时间内消耗2nmolSO2的同时消耗nmolO2
E.相同时间内消耗2nmolSO2的同时生成nmolO2
(3)反应达到化学平衡后,以下操作将引起SO3产率降低的是___________。
A.向容器中通入少量O2
B.向容器中通入少量SO2
C.使用催化剂
D.升高温度
E.向容器中通入少量氦气(已知:氦气和SO2、O2、SO3都不发生反应)
(4)t2℃时,若将等物质的量的SO2和O2的混合气体通入一个恒温恒压的密闭容器中,反应达到平衡时,混合气体体积减少了10%。SO2的转化率为___________。
-
简答题(7分)t℃时,将2molSO2和1molO2通入体积为2L的恒温恒容密闭容器中,发生如下反应:2SO2(g)+O2(g) 2SO3(g),ΔH= -196.6kJ/mol。2min时反应达到化学平衡,此时测得反应物O2还剩余0.8mol,请填写下列空白:
2SO3(g),ΔH= -196.6kJ/mol。2min时反应达到化学平衡,此时测得反应物O2还剩余0.8mol,请填写下列空白:
(1)从反应开始到达化学平衡,生成SO3的平均反应速率为 ;平衡时SO2浓度为 ;
(2)下列叙述能证明该反应已达到化学平衡状态的是(填标号) ;
A.容器内气体的总压强不再发生变化
B.SO2的体积分数不再发生变化
C.容器内气体原子总数不再发生变化
D.相同时间内消耗2nmolSO2的同时消耗nmolO2
E.相同时间内消耗2nmolSO2的同时生成nmolO2
-
将2molSO2和1molO2分别置于相同体积的甲乙两密闭容器中发生反应2SO2+O2(g) 2SO3(g),并达到平衡。在这过程中,甲容器保持恒温恒容,乙容器保持恒温恒压,达到平衡时,下列说法正确的是( )
2SO3(g),并达到平衡。在这过程中,甲容器保持恒温恒容,乙容器保持恒温恒压,达到平衡时,下列说法正确的是( )
A.达到平衡所需的时间为:甲>乙 B.甲的转化率>乙的转化率
C.混合气体中SO3的含量为:甲>乙 D.气体的总物质的量:甲<乙
-
将2molSO2和1molO2混合置于体积可变,压强恒定的密闭容器中,在一定温度下发生如下反应:2SO2(g)+O2(g) 2SO3(g) △H<0,当反应进行到时间t1点时达到平衡状态,测得混合气体总物质的量为2.1mol.试回答下列问题:
2SO3(g) △H<0,当反应进行到时间t1点时达到平衡状态,测得混合气体总物质的量为2.1mol.试回答下列问题:
(1)若平衡时,容器体积为aL,写出该反应的平衡常数为:K=__________(用含a的代数式表示)
(2)反应进行到t1时,SO2的体积分数为_______________;
(3)若在t1时充入一定量的氩气(Ar),SO2的物质的量将________(填“增大”、“减小”或“不变”);
(4)若在t1时升温,重新达到平衡状态,新平衡混合物中气体的总物质的量____2.1mol(填“<”、“>”或“=”),简单说明原因:____________。
(5)若t1达到平衡后,保持容器的体积不再变化。再加入0.2molSO2、0.1molO2和1.8molSO3,此时v逆________v正 (填“<”、“>”或“=”)。
(6)一定温度下,在三个容积相同的恒容密闭容器中按不同方式投入反应物,发生反应2SO2(g)+O2(g) 2SO3(g)(正反应放热),测得反应的相关数据如下:
2SO3(g)(正反应放热),测得反应的相关数据如下:
| 容器1 | 容器2 | 容器3 |
| 反应温度T/K | 700 | 700 | 800 |
| 反应物投入量 | 2 mol SO2、1 mol O2 | 4 mol SO3 | 2 mol SO2、1 mol O2 |
| 平衡v正(SO2)/ mol·L-1·s-1 | v1 | v2 | v3 |
| 平衡c(SO3)/mol·L-1 | c1 | c2 | c3 |
| 平衡体系总压强p/Pa | p1 | p2 | p3 |
| 物质的平衡转化率α | α1(SO2) | α2(SO3) | α3(SO2) |
| 平衡常数K | K1 | K2 | K3 |
用“<”、“>”或“=”填入下列横线上:
c2______2c1,v1______v2;K1_____K3,p2____2p3;α1(SO2)_____α3(SO2);α2(SO3)+α3(SO2)_______1
-
将2molSO2和1molO2混合置于体积可变,压强恒定的密闭容器中,在一定温度下发生如下反应:2SO2(g)+O2(g) 2SO3(g) △H<0,当反应进行到时间t1点时达到平衡状态,测得混合气体总物质的量为2.1mol.试回答下列问题:
2SO3(g) △H<0,当反应进行到时间t1点时达到平衡状态,测得混合气体总物质的量为2.1mol.试回答下列问题:
(1)若平衡时,容器体积为aL,写出该反应的平衡常数为:K=__________(用含a的代数式表示)
(2)反应进行到t1时,SO2的体积分数为_______________;
(3)若在t1时充入一定量的氩气(Ar),SO2的物质的量将________(填“增大”、“减小”或“不变”);
(4)若在t1时升温,重新达到平衡状态,新平衡混合物中气体的总物质的量____2.1mol(填“<”、“>”或“=”),简单说明原因:____________。
(5)若t1达到平衡后,保持容器的体积不再变化。再加入0.2molSO2、0.1molO2和1.8molSO3,此时v逆________v正 (填“<”、“>”或“=”)。
(6)一定温度下,在三个容积相同的恒容密闭容器中按不同方式投入反应物,发生反应2SO2(g)+O2(g) 2SO3(g)(正反应放热),测得反应的相关数据如下:
2SO3(g)(正反应放热),测得反应的相关数据如下:
| 容器1 | 容器2 | 容器3 |
| 反应温度T/K | 700 | 700 | 800 |
| 反应物投入量 | 2 mol SO2、1 mol O2 | 4 mol SO3 | 2 mol SO2、1 mol O2 |
| 平衡v正(SO2)/ mol·L-1·s-1 | v1 | v2 | v3 |
| 平衡c(SO3)/mol·L-1 | c1 | c2 | c3 |
| 平衡体系总压强p/Pa | p1 | p2 | p3 |
| 物质的平衡转化率α | α1(SO2) | α2(SO3) | α3(SO2) |
| 平衡常数K | K1 | K2 | K3 |
用“<”、“>”或“=”填入下列横线上:
c2______2c1,v1______v2;K1_____K3,p2____2p3;α1(SO2)_____α3(SO2);α2(SO3)+α3(SO2)_______1
-
将2molSO2和1molO2混合置于体积可变,压强恒定的密闭容器中,在一定温度下发生如下反应:2SO2(g)+O2(g) 2SO3(g);△H<0,当反应进行到时间t1点时达到平衡状态,测得混合气体总物质的量为2.1mol。试回答下列问题:
2SO3(g);△H<0,当反应进行到时间t1点时达到平衡状态,测得混合气体总物质的量为2.1mol。试回答下列问题:
(1)反应进行到t1时,SO2的体积分数为__;
(2)若在t1时充入一定量的氩气(Ar),SO2的物质的量将__(填“增大”、“减小”或“不变”);
(3)若在t1时升温,重新达到平衡状态,新平衡混合物中气体的总物质的量_2.1mol(填“<”、“>”或“=”),简单说明原因:__。
(4)若t1达到平衡后,保持容器的体积不再变化。再加入0.2molSO2、0.1molO2和1.8molSO3,此时v逆_v正(填“<”、“>”或“=”)
2SO3(g),△H=-196.6kJ·mol-1。2min时反应达到化学平衡状态,此时测得反应物O2还剩余0.8mol,填写下列空白:
