-
(10分)工业上综合利用黄铜矿(CuFeS2)制备净水剂高铁酸钠(Na2FeO4)、铜及其化合物的工业流程如下图所示:
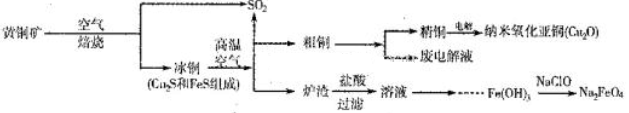
(1)冶炼铜的反应为8CuFeS2+21O2 8Cu+4FeO+2Fe2O3+16SO2。若中CuFeS2铁元素的化合价为+2,1molCuFeS2参与反应转移电子的物质的量为_______ mol。
8Cu+4FeO+2Fe2O3+16SO2。若中CuFeS2铁元素的化合价为+2,1molCuFeS2参与反应转移电子的物质的量为_______ mol。
(2)利用炉渣(含Fe2O3、FeO、SiO2、Al2O3)制备高铁酸钠的方法为:
①用稀盐酸浸取炉渣,过滤;
②向滤液中加入足量H2O2溶液,再加入足量NaOH溶液,过滤,将沉淀洗涤、于燥得Fe(0H)3;
③Fe(OH)3与NaClO和NaOH反应,生成高铁酸钠。
a.写出制取高铁酸钠的化学方程式:______________________;
b.验证炉渣中含有FeO必要的化学试剂为________________________。
(3)制备纳米氧化亚铜(Cu2O)时用铜棒和石墨做电极,饱和食盐水做电解质,电解反应为2Cu+H2O Cu2O+H2↑。铜棒上发生的电极反应式为_________________________________________。(5)直接排放含SO2的烟气会形成酸雨,危害环境。用NaOH溶液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如下表:
Cu2O+H2↑。铜棒上发生的电极反应式为_________________________________________。(5)直接排放含SO2的烟气会形成酸雨,危害环境。用NaOH溶液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如下表:
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 1:91 |
| pH(25℃) | 8.2 | 7.2 | 6.2 |
当吸收液呈中性时,溶液中离子浓度由大到小的顺序为是________________。
-
利用工业炼铜后的炉渣(含Fe2O3、FeO、SiO2、Al2O3),制备无机高分子絮凝剂聚合氯化铝和净水剂高铁酸钠(Na2FeO4)。其工艺流程如下(部分操作和条件略):
Ⅰ.用稀盐酸浸取炉渣,过滤;
Ⅱ.向滤液中加入过量NaClO溶液,调pH约为3,过滤;
Ⅲ.溶液进行减压蒸发等操作,甩干后送入聚合炉中进行高温聚合,……得到聚合氯化铝。
Ⅳ.将Ⅱ中得到沉淀洗涤、干燥,再与NaClO和NaOH反应,生成高铁酸钠。
(1)稀盐酸溶解Fe2O3的离子方程式是 。
(2)验证炉渣中含有FeO必要的化学试剂为 。
(3)已知:生成氢氧化物沉淀的pH
| 物质 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 |
| 开始沉淀时 | 1.5 | 3.4 | 6.3 |
| 完全沉淀时 | 2.8 | 4.7 | 8.3 |
①步骤Ⅱ中加入过量NaClO,反应的离子方程式是 。
②根据表中数据解释步骤Ⅱ中,调pH约为3的目的是 。
(4)该工业流程存在缺点,在步骤Ⅱ伴随着有氯气产生,此反应方程式是 。
(5)步骤Ⅲ中在减压蒸发与甩干操作之间,还需进行的操作是 。
(6)在步骤Ⅳ中,若该反应生成166 g Na2FeO4转移3 mol电子,则参加反应的还原剂和氧化剂的物质的量之比是 。
-
(16分)高铁酸钠(Na2FeO4)具有很强的氧化性,广泛应用于净水、电池工业等领域。以粗FeO(含有CuO、Al2O3和SiO2等杂质)制备高铁酸钠的生产流程如下,回答下列问题:
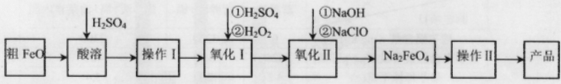
已知:NaClO不稳定,受热易分解。
(1)粗FeO酸溶过程中通入水蒸气(高温),其目的是__________________________。
(2)操作I目的是得到高纯度FeSO4溶液,则氧化I中反应的离子方程式为_________。
(3)本工艺中需要高浓度NaClO溶液,可用Cl2与NaOH溶液反应制备
①Cl2与NaOH溶液反应的离子方程式为_________________。
②在不同温度下进行该反应,反应相同一段时间后,测得生成NaClO浓度如下:
| 温度/℃ | 15 | 20 | 25 | 30 | 35 | 40 | 45 |
| NaClO浓度/mol·L-1 | 4.6 | 5.2 | 5.4 | 5.5 | 4.5 | 3.5 | 2 |
请描述随温度变化规律________________________________________________________。
其原因为____________________________________________________________________。
(4)工业也常用电解法制备Na2FeO4,其原理为Fe+2OH-+2H2O电解FeO42-+3H2↑。请用下列材料设计电解池并在答题卡的方框内画出该装置。

可选材料:铁片、铜片、碳棒、浓NaOH溶液、浓HCl等
其阳极反应式为:________________________________。
-
铁及其化合物在日常生活、生产中应用广泛。
(1)高铁酸钠(Na2FeO4)是水处理过程中的一种新型净水剂,工业上利用NaClO 和NaOH的混合溶液将Fe(OH)3氧化性制备高铁酸钠,反应的离子反应方程式为 ;高铁酸钠能用作新型净水剂的原理是 ;
(2)氧化铁红颜料跟某些油料混合,可以制成防锈油漆。以黄铁矿为原料制硫酸产生的硫酸渣中含Fe2O3、SiO2、Al2O3、MgO等,用硫酸渣制备铁红(Fe2O3)的过程如下:
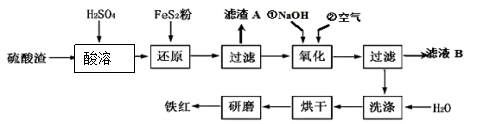
①酸溶过程中发生反应的化学方程式为 , , ;“滤渣A”主要成份的化学式为 。
②还原过程中加入FeS2的目的是将溶液中的Fe3 +还原为Fe2 +,而本身被氧化为H2SO4,请写出该反应的离子方程式 ;
③氧化过程中,O2、NaOH与Fe2+反应的离子方程式为 。
④为了确保铁红的质量和纯度,氧化过程需要调节溶液的pH的范围是 ,
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
| 开始沉淀pH | 2.7 | 3.8 | 7.6 | 9.4 |
| 完全沉淀pH | 3.2 | 5.2 | 9.7 | 12.4 |
如果pH过大,可能引起的后果是 。
-
铁及其化合物在日常生活、生产中应用广泛。
(1)高铁酸钠(Na2FeO4)是水处理过程中的一种新型净水剂,工业上利用NaClO 和NaOH的混合溶液将2Fe(OH)3氧化性制备高铁酸钠,反应的化学方程式为 ;高铁酸钠能用作新型净水剂的原理是 ;
(2)氧化铁红颜料跟某些油料混合,可以制成防锈油漆。以黄铁矿为原料制硫酸产生的硫酸渣中含Fe2O3、SiO2、Al2O3、MgO等,用硫酸渣制备铁红(Fe2O3)的过程如下:
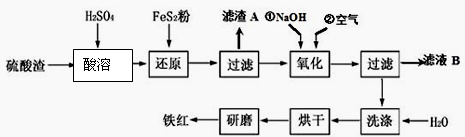
①酸溶过程中发生反应的化学方程式为 , , ;“滤渣A”主要成份的化学式为 。
②还原过程中加入FeS2的目的是将溶液中的Fe3 +还原为Fe2 +,而本身被氧化为H2SO4,请写出该反应的离子方程式 ;
③氧化过程中,O2、NaOH与Fe2+反应的离子方程式为 。
④为了确保铁红的质量和纯度,氧化过程需要调节溶液的pH的范围是 ,
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
| 开始沉淀pH | 2.7 | 3.8 | 7.6 | 9.4 |
| 完全沉淀pH | 3.2 | 5.2 | 9.7 | 12.4 |
如果pH过大,可能引起的后果是 。
-
高铁酸钠(Na2FeO4)具有很强的氧化性,是一种新型的绿色净水消毒剂。工业上可以通过次氯酸钠氧化法制备高铁酸钠,生产过程如下:
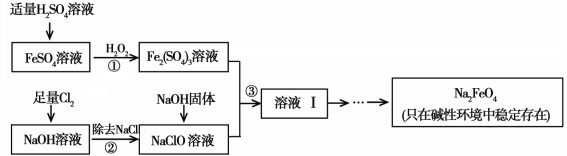

(1)高铁酸钠中铁元素的化合价为 ,次氯酸钠的电子式是________。
(2)步骤①反应的离子方程式是 。
(3)从溶液I中分离出Na2FeO4后,还有副产品Na2SO4 、NaCl,则步骤③中反应的离子方程式为 。
(4)工业上还可用电解浓NaOH溶液的方法制Na2FeO4,其工作原理如图所示:
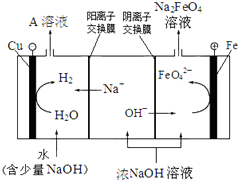
阳极的电极反应式为 。可循环使用的物质是 。
(5)计算Na2FeO4的消毒效率(以单位质量得到的电子数表示)约是氯气的________倍,
-
高铁酸钠(Na2FeO4)具有很强的氧化性,是一种新型的绿色净水消毒剂。工业上以菱铁矿(主要成分是FeCO3及少量SiO2)为原料制备高铁酸钠生产过程如下:
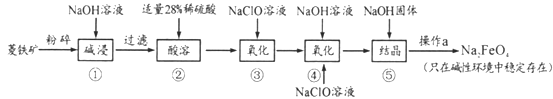
(1)Na2FeO4中铁元素的化合价为___,高铁酸钠用于杀菌消毒时的化学反应类型为____(填“氧化还原反应”、“复分解反应”或“化合反应”)。
(2)按照上述流程,步骤①中碱浸时能否用较便宜的Ca(OH)2替代NaOH_____(填“能”或“不能”),理由是___________。
(3)步骤②中28%的稀硫酸需要用98%的浓硫酸配制,配制时所需玻璃仪器除量筒外,还____(填字母序号)。步骤③中检验Fe2+全部转化成Fe3+的方法是:__________。
A.容量瓶 B.烧杯 C.烧瓶 D.玻璃棒 E.酸式滴定管;
(4)步骤④中除生成Na2FeO4外,还有NaCl生成,其离子方程式为_________;己知步骤⑤是向Na2FeO4溶液中继续加入氢氧化钠固体得到悬浊液,则操作a的名称为_____。
(5)理论上,每获得0.5mol的FeO42-消耗 NaClO的总质量为_____。
-
高铁酸钠(Na2FeO4)具有很强的氧化性,是一种新型的绿色净水消毒剂。工业上以菱铁矿(主要成分是FeCO3及少量SiO2)为原料制备高铁酸钠生产过程如下:
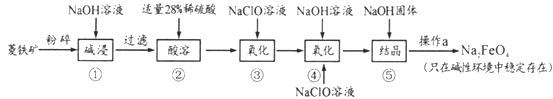
(1)Na2FeO4中铁元素的化合价为___,高铁酸钠用于杀菌消毒时的化学反应类型为____(填“氧化还原反应”、“复分解反应”或“化合反应”)。
(2)按照上述流程,步骤①中碱浸时能否用较便宜的Ca(OH)2替代NaOH_____(填“能”或“不能”),理由是___________。
(3)步骤②中28%的稀硫酸需要用98%的浓硫酸配制,配制时所需玻璃仪器除量筒外,还____(填字母序号)。步骤③中检验Fe2+全部转化成Fe3+的方法是:__________。
A.容量瓶 B.烧杯 C.烧瓶 D.玻璃棒 E.酸式滴定管;
(4)步骤④中除生成Na2FeO4外,还有NaCl生成,其离子方程式为_________;己知步骤⑤是向Na2FeO4溶液中继续加入氢氧化钠固体得到悬浊液,则操作a的名称为_____。
(5)理论上,每获得0.5mol的FeO42-消耗 NaClO的总质量为_____。
-
铁及其化合物在生产和生活中有广泛的应用。
Ⅰ、高铁酸钠(Na2FeO4)是一种新型净水剂,工业上制备高铁酸钠的反应原理为:
Fe(OH)3 + NaClO + NaOH →Na2FeO4 + X + H2O(未配平), 则X的电子式为_______ ,反应中被氧化的物质是_________(写化学式)。
Ⅱ、铁红颜料跟某些油料混合,可以制成防锈油漆。工业制硫酸产生的硫酸渣中主要含Fe2O3、SiO2、Al2O3、MgO等,用硫酸渣制备铁红(Fe2O3)的过程如下:
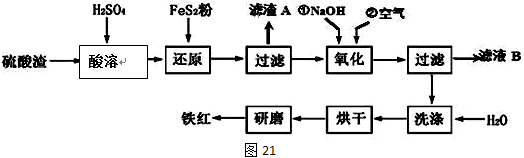
已知:
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
| 开始沉淀pH | 2.7 | 3.8 | 7.6 | 9.4 |
| 完全沉淀pH | 3.2 | 5.2 | 9.7 | 12.4 |
已知FeS2是一种黄色难溶于水的固体。
(1)酸溶过程中Fe2O3与稀硫酸反应的化学方程式为______________________;
“滤渣A”主要成份的化学式为__________________。
(2)还原过程中加入FeS2的目的是将溶液中的Fe3+还原为Fe2+,而本身被氧化为H2SO4,写出该反应的离子方程式_________________。
(3)为确保铁红的质量和纯度,氧化过程中加NaOH调节溶液pH的范围是____;如果加NaOH调节溶液pH=a,则滤液B中c(Fe3+)=____mol/L(25℃时,Ksp[Fe(OH)3]=4×10﹣38)
(4)以甲醚、空气、氢氧化钾溶液为原料,石墨为电极可以构成燃料电池。该电池负极的电极反应式为________________ 。
-
高铁酸钠(Na2FeO4)具有很强的氧化性,是一种比氯气更好的净水消毒剂。工业上可以通过次氯酸钠氧化法制备高铁酸钠,生产过程如下,回答下列问题:

(1)氯气作净水消毒剂是因为它溶于水生成了________,它有强的氧化性,能杀菌消毒。
(2)步骤②反应的离子方程式是________。
(3)从溶液Ⅰ中分离出Na2FeO4后,还有副产品Na2SO4 、NaCl,则步骤③中反应的离子方程式为________。
(4)将一定量的Na2FeO4投入到pH不同的污水中(污水中其余成分均相同),溶液中Na2FeO4浓度变化如图曲线Ⅰ、Ⅱ所示,试推测曲线II比曲线I对应的污水pH________(填“高”或“低”)。
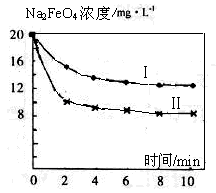
(5)通过计算得知Na2FeO4的消毒效率(以单位质量得到的电子数表示)约是氯气的_____倍

8Cu+4FeO+2Fe2O3+16SO2。若中CuFeS2铁元素的化合价为+2,1molCuFeS2参与反应转移电子的物质的量为_______ mol。
Cu2O+H2↑。铜棒上发生的电极反应式为_________________________________________。(5)直接排放含SO2的烟气会形成酸雨,危害环境。用NaOH溶液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如下表:









