-
控制、治理氮氧化物对大气的污染是改善大气质量的重要方面.
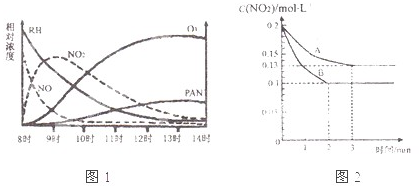
(1)光化学烟雾白天生成,傍晚消失,其主要成分为RH(烃)、NO、NO2、O3、PAN(CH3COOONO2),某地早上至中午这些物质的相对浓度变化如图1所示,则下列叙述合理的是______.(填字母)
a.早上8时交通繁忙期,光化学烟雾的主要成分为RH、NO
b.14时,光化学烟雾的主要成分为O3、PAN
c.PAN、O3由RH和NO直接反应生成
d.PAN直接由O3转化生成
(2)火力发电厂的燃煤排烟中含大量的氮氧化物(NOx),可利用甲烷和NOx在一定条件下反应消除其污染,则CH4与NO2反应的化学方程式为______.
(3)在一密闭容器中发生反应2NO2 ⇌2NO+O2,反应过程中NO2的浓度随时间变化的情况如图2所示.请回答:
①依曲线A,反应在前3min内氧气的平均反应速率为______.
②若曲线A、B分别表示的是该反应在某不同条件下的反应情况,则此条件是______(填“浓度”、“压强”、“温度”或“催化剂”).
③曲线A、B分剐对应的反应平衡常数的大小关系是KA______KB.(填“>”、“<”或“=”)
(4)一定温度下,在一密闭容器中N2O5可发生下列反应:
2N2O5(g)⇌4NO2(g)+O2(g)I
2NO2(g)⇌2NO(g)+O2(g)II
则反应I的平衡常数表达式为______.若达平衡时,c(NO2)=0.4mol•L-1,c(O2)=1.3mol•L-1,则反应II中NO2的转化率为______,N2O5(g)的起始浓度应不低于______mo1•L-1.
-
为有效控制雾霾,各地积极采取措施改善大气质量。有效控制空气中氮氧化物、碳氧化物和硫氧化物显得尤为重要。
(1)在汽车排气管内安装催化转化器,可将汽车尾气中主要污染物转化为无毒的大气循环物质。
已知:① N2(g) + O2(g)  2NO(g) △H1=+180.5 kJ·mol-1
2NO(g) △H1=+180.5 kJ·mol-1
② C和CO的燃烧热(△H)分别为-393.5 kJ·mol-1和-283 kJ·mol-1
则2NO(g) + 2CO(g)  N2(g) + 2CO2(g)的△H = kJ·mol-1
N2(g) + 2CO2(g)的△H = kJ·mol-1
(2)将0.20 mol NO和0.10 mol CO充入一个容积为1L的密闭容器中,反应过程中物质浓度变化如图所示。
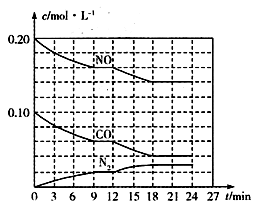
①CO在0-9min内的平均反应速率v(CO)=_______________ mol·L﹣1·min﹣1 (保留两位有效数字);第12 min时改变的反应条件可能为________。
A.升高温度 B.加入NO C.加催化剂 D.降低温度
②该反应在第24 min时达到平衡状态,CO2的体积分数为__________(保留三位有效数字),化学平衡常数K=___________(保留两位有效数字)。
(3)烟气中的SO2可用某浓度NaOH溶液吸收得到Na2SO3和NaHSO3混合溶液,且所得溶液呈中性,该溶液中c(Na+)= (用含硫微粒浓度的代数式表示)。
(4)通过人工光合作用能将水与燃煤产生的CO2转化成HCOOH和O2。已知常温下0.1 mol·L﹣1的HCOONa溶液pH =10,则HCOOH的电离常数 =___________________。
=___________________。
-
氮氧化物(用NOx表示)是大气污染的重要因素,根据NOx的来源和性质特点,已开发出多种化学治理其污染的方法。
(1)汽车尾气中的NO2是城市大气污染的主要污染物之一。在日光照射下,NO2发生一系列光化学烟雾的循环反应,从而不断产生O3,加重空气污染。反应过程为①2NO2→2NO+2O,②2NO+O2→2NO2,③O+O2→O3。下列关于该反应过程及生成物的叙述正确的是____(填序号)。
A.NO2起催化作用
B.NO起催化作用
C.NO2只起氧化作用
D.O3与O2互为同素异形体
(2)汽车尾气中的CO来自于____,NO来自于____。
(3)汽车尾气中的CO、NOx可在适宜温度下采用催化转化法处理,使它们相互反应生成参与大气循环的无毒气体。写出NO被CO还原的化学方程式:_____。
(4)工业尾气中氮氧化物常采用碱液吸收法处理。NO2被烧碱溶液吸收时,生成两种钠盐,其物质的量之比为1∶1,该反应的离子方程式为____;1molNO2被完全吸收时,转移电子的物质的量为____。NO与NO2按物质的量之比1∶1被足量NaOH溶液完全吸收后只得到一种钠盐,该钠盐的化学式为____。
-
化学在改善大气质量、污水处理和实现垃圾资源化方面发挥了重要的作用。
⑴吸烟释放的烟雾含有烟碱、一氧化碳、醛类、苯并芘等多种有害物质,其中_____会使人对烟草成瘾;
⑵天然水必须经过除去_____________和杀菌消毒的处理才能饮用;
⑶下列方法符合垃圾资源化原则的是_____________A.废旧轮胎露天焚烧 B. 采用生物技术使有机垃圾生产沼气 C. 废旧塑料深埋地下
⑷废旧电池不能填埋、不能焚烧,必须单独收集和处理,因为它含有_____________会对环境造成污染。
-
近年全国各地雾霾严重,为有效控制雾霾,各地积极采取措施改善大气质量。研究并有效控制空气中氮氧化物、碳氧化物等污染物是一项重要而艰巨的工作。
I.氮氧化物的研究
(1)一定条件下,将2molNO与2molO2置于恒容密闭容器中发生反应: 2NO(g)+O2(g)  2NO2(g),下列状态能说明该反应达到化学平衡的是_______
2NO2(g),下列状态能说明该反应达到化学平衡的是_______
A.混合气体的密度保持不变 B.NO的转化率保持不变
C.NO和O2的物质的量之比保持不变 D.O2的消耗速率和NO2的消耗速率相等
(2)已知反应:2NO(g)  N2(g)+O2(g) ΔH<0,在不同条件时N2的体积分数随时间(t)的变化如图所示。根据图象可以判断曲线R1、R2对应的是下列反应条件中的______ (填字母序号)。
N2(g)+O2(g) ΔH<0,在不同条件时N2的体积分数随时间(t)的变化如图所示。根据图象可以判断曲线R1、R2对应的是下列反应条件中的______ (填字母序号)。
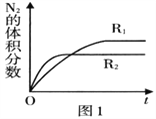
A.压强 B.温度 C.催化剂
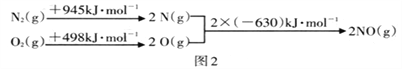
根据如图中的能量变化数据,计算反应:2NO(g)  N2(g)+O2(g) 的ΔH=__________
N2(g)+O2(g) 的ΔH=__________
II.碳氧化物的研究
(3)CO和H2在一定条件下可以合成甲醇:CO(g)+2H2(g) CH3OH(g) ΔH<0,现在体积为1L的恒容密闭容器(如图甲)中通入1molCO和2molH2,测定不同时间、不同温度(T)下容器中CO的物质的量,如下表:
CH3OH(g) ΔH<0,现在体积为1L的恒容密闭容器(如图甲)中通入1molCO和2molH2,测定不同时间、不同温度(T)下容器中CO的物质的量,如下表:

请回答:
T1_____ T2(填“>”或“<”或“=”)。已知T2℃时,第20min时容器内压强不再改变,此时H2的转化率为_________ 。
(4)已知:Ksp[Al(OH)3]=1×10-33,Ksp[Fe(OH)3]=3×10-39,pH=7.1时Mn(OH)2开始沉淀。室温下,除去MnSO4溶液中的Fe3+、Al3+(使其浓度均小于1×10-6 mol·L-1),需调节溶液pH范围为________。
-
二氧化硫和氮的氧化物是常用的化工原料,但也是大气的主要污染物。综合治理其污染是环境化学当前的重要研究内容之一。
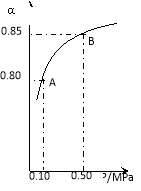
(1)硫酸生产中,SO2催化氧化生成SO3 :
:
2SO2(g)+O2(g) 2SO3(g)
2SO3(g)
某温度下,SO2的平衡转化率(a)与体系总压强(p)的关系如右图所示。
根据图示回答下列问题:
①将2.0mol SO2和1.0mol O2置于10L密闭容器中,反应达平衡后,
体系总压强为0.10MPa。该反应的平衡常数等于_______。
②若改在容器中加入1.0 mol SO2、0.5mol O2和amol SO3,保持温度不变反应达 平衡后,体系总压强也为0.10MPa,则a=_________mol。SO2的平衡转化率为_________________。[
平衡后,体系总压强也为0.10MPa,则a=_________mol。SO2的平衡转化率为_________________。[
③平衡状态由A变到B时.平衡常数K(A)_______K(B)(填“>”、“<”或“=”)。
(2)用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)=4NO(g)+C02(g) +2H20(g) △H=-574 kJ·mol-1
+2H20(g) △H=-574 kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H20(g) △H=-1160 kJ·mol-1
若用标准状况下4.48L CH 4还原NO2至N2整个过程中,放出的热量为______kJ。
4还原NO2至N2整个过程中,放出的热量为______kJ。
-
二氧化硫和氮的氧化物是常用的化工原料,但也是大气的主要污染物。综合治理其污染是环境化学当前的重要研究内容之一。
硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g) 2SO3(g)
2SO3(g)
某温度下,SO2的平衡转化率(a)与体系总压强(p)的关系如右图所示。根据图示回答下列问题: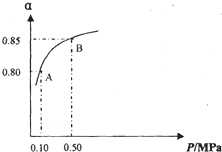
(1)将2.0mol SO2和1.0molO2置于10L密闭容器中,反应达平衡后,体系总压强为0.10MPa。该反应的平衡常数等于___________。
(2)若改在容器中加入1.0 mol SO2、0.5mol O2和amol SO3,保持温度不变反应达平衡后,体系总压强也为0.10MPa,则a=_________mol。SO2的平衡转化率为_________________。
(3)平衡状态由A变到B时,平衡常数K(A)____ ______K(B)(填“>”、“<”或“=”)。
-
雾霾主要由二氧化硫、氮氧化物和可吸入颗粒物这三项组成。2014年,习近平在北京考察时指出:应对雾霾污染、改善空气质量的首要任务是控制PM2.5,要从压减燃煤、严格控车、调整产业等方面采取重大举措。
(1)空气质量报告中不涉及的污染物是__________ ;
A.SO2 B. NO2 C. CO2 D. 可吸入颗粒物
(2)在催化剂作用下,一氧化氮与一氧化碳反应,生成无毒物质,可解决汽车尾气对环境污染,其化学方程式是_______;反应类型是_______(填“氧化还原反应”或“非氧化还原反应”);汽车燃油改燃气有利于环境保护,汽车最理想的清洁燃料是________;
(3)下列关于雾霾天气的说法,错误的是__________;
A.可吸入颗粒物是加重雾霾天气污染的罪魁祸首
B. 霾可导致呼吸道疾病、脑血管疾病、鼻腔炎症等
C. 雾霾天外出最好戴过滤效果好的口罩
D. 发电厂的煤经脱硫处理对减少雾霾无影响
-
控制和治理SO2、NOx是减少酸雨和光化学烟雾的有效途径。
(1)烟气脱琉是大气污染防治研究的热点。脱硫过程涉及的反应如下:
SO2(g)+H2O(l)+HC1O(aq) H2SO4(aq)+HCl(aq) △H=a kJ•mol-1;
H2SO4(aq)+HCl(aq) △H=a kJ•mol-1;
Ca(ClO)2(aq)+H2SO4(aq)  CaSO4(s)+2HClO(aq) △H=b kJ•mol-1。
CaSO4(s)+2HClO(aq) △H=b kJ•mol-1。
则脱疏反应:Ca(ClO)2(aq)+ 2SO2(g) + 2H2O(l) CaSO4(s)+ H2SO4(aq) + 2HClO(aq)的△H=______(用含a、b的代数式表示) kJ•mol-1。
CaSO4(s)+ H2SO4(aq) + 2HClO(aq)的△H=______(用含a、b的代数式表示) kJ•mol-1。
(2)100℃时,向一个1 L的恒容密闭容器中充入0.2 mol NO2,发生反应:2NO2(g) N2O4(g) △H<0。测得不同时间时容器中NO2的浓度如下表所示。
N2O4(g) △H<0。测得不同时间时容器中NO2的浓度如下表所示。
| 时间/min | 0 | t1 | t2 | t3 | t4 |
| c(NO2)/mol·L-1 | 0.2 | 0.16 | 0.13 | 0.12 | 0.12 |
①在0~t3时间段内,N2O4的平均反应速率为______mol•L-1•min-1,NO2的平衡转化率为________。
②100℃时,该反应的平衡常数K=____________。
-
(1)为了改善空气质量,必须控制大气中二氧化硫、氮氧化物、烟尘等污染物的排放量.为控制大气中二氧化硫的排放,常采取的措施是对化石燃料进行________.对汽车加装尾气催化净化装置,使其中的有害气体NO、CO转化为无害气体,该反应的化学方程式为________.
(2)人类产生的垃圾应进行分类回收、集中处理,即便如此,仍会剩余不少垃圾,因此必须对剩余垃圾进一步处理,除卫生填埋外,还有一种能够改变垃圾的组成、结构使其体积减小、充分利用其所具有的能量并使之无害化的处理方式,这种垃圾的处理方式是________技术.






