-
常温下,向20mL 0.2mol/L H2A溶液中滴加0.2 mol/L NaOH溶液。有关微粒的物质的量变化如图(其中I代表H2A,II代表HA-,III代表A2-,横坐标表示加入NaOH的体积)。根据图示判断,下列说法正确的是( )
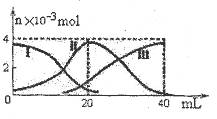
A.当V(NaOH)=20mL时, 溶液中离子浓度大小关系:
C(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)
B.HA-的电离程度小于水解程度
C.滴加过程中当溶液呈中性时,V(NaOH)<20mL
D.当V(NaOH)=40mL时, 向所得溶液加水稀释的过程中pH增大
-
常温下,向20mL 0.2mol/L H2A溶液中滴加0.2 mol/L NaOH溶液。有关微粒的物质的量变化如图(其中I代表H2A,II代表HA-,III代表A2-,横坐标表示加入NaOH的体积)。根据图示判断,下列说法正确的是
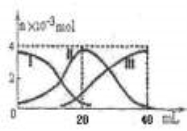
A.当V(NaOH)=40mL时,c (Na+)+ c(H+)=2 c(A2-)+c(OH-)
B.当V(NaOH)=20mL时,溶液中离子浓度大小关系: c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)
C.滴加过程中当溶液呈中性时,V(NaOH)<20mL
D.HA-的电离程度小于水解程度
-
常温下,向20 mL 0.2 mol /L H2A溶液中滴加0.2 mol /L NaOH溶液。有关微粒的物质的量变化如图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-)所示。根据图示判断,下列说法正确的是
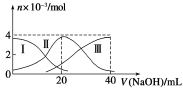
A.当V(NaOH)=20 mL时,溶液中离子浓度大小关系:c(Na+)>c(HA-)>c(A2-) >c(H+) >c(OH-)
B.等浓度的NaOH溶液与H2A溶液按2∶1混合后,其溶液中水的电离程度比纯水大
C.NaHA溶液中:c(OH-)=c(H+)+c(HA-)+2c(H2A)
D.向上述加入20 mL NaOH溶液后所得溶液中再加入水的过程中,pH可能减少
-
常温下,向20 mL 0.2 mol/L H2A溶液中滴加0.2 mol/L NaOH溶液。有关微粒的物质的量变化如图(其中I代表H2A,II代表HAˉ,III代表A2ˉ)。根据如图图示判断,下列说法正确的是
A. 当V(NaOH)=20mL时,溶液中离子浓度大小关系:c(Na+)>c(A2ˉ)>c(H+)>c(HAˉ)>c(OHˉ)
B. 等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水的大
C. 当V(NaOH)=30 mL时,溶液中存在以下关系:2c(H+)+3c(H2A)+c(HAˉ)= c(A2ˉ)+2c(OHˉ)
D. 向NaHA溶液加入水的过程中,pH可能增大也可能减小
-
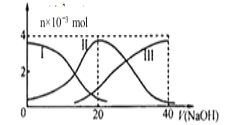
常温下,向20 mL 0.2 mol·L-1 H2A溶液中滴加0.2 mol·L-1 NaOH溶液,有关微粒的物质的量变化如图,根据图示判断,下列说法正确的是( )
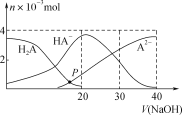
A. 在P点时,c(H2A)+c(HA-)+c(A2-)+c(OH-)=c(Na+)+c(H+)
B. 当V(NaOH)=20 mL时,c(OH-)=c(H+)+c(HA-)+2c(H2A)
C. 当V(NaOH)=30 mL时,3c(Na+)=2[c(HA- )+c(A2-)+c(H2A)]
D. 当V(NaOH)=40 mL时,c(Na+)>c(A2-)>c(HA-)>c(H2A)>c(OH-)>c(H+)
-
常温下,向20 mL 0.2 mol·L-1 H2A溶液中滴加0.2 mol·L-1 NaOH溶液,有关微粒的物质的量变化如图,根据图示判断,下列说法错误的是( )
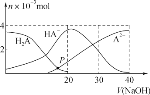
A.在P点时,c(H2A)+c(HA-)+c(A2-)+c(OH-)=c(Na+)+c(H+)
B.当V(NaOH)=20 mL时,c(OH-)=c(H+)+c(HA-)+2c(H2A)
C.当V(NaOH)=30 mL时,2c(Na+)=3[c(HA-)+c(A2-)+c(H2A)]
D.当V(NaOH)=40 mL时,c(Na+)>c(A2-)>c(HA-)>c(H2A)>c(OH-)>c(H+)
-
Ⅰ.已知:H2A的A2-可表示S2-、S 、S
、S 、Si
、Si 或C
或C 等离子。
等离子。
(1)常温下,向20 mL 0.2 mol·L-1 H2A溶液中滴加0.2 mol·L-1 NaOH溶液。有关微粒物质的量变化如图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-)。请根据图示填空:
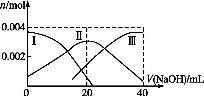
①当V(NaOH)=20 mL时,溶液中离子浓度大小关系: 。
②等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水 (填“大”“小”或“相等”),欲使NaHA溶液呈中性,可以向其中加入 。
(2)若H2A为硫酸:t℃时,有pH=2的稀硫酸和pH=11的NaOH溶液等体积混合后溶液呈中性,则该温度下水的离子积常数KW= 。
Ⅱ.已知:在25 ℃时 H2O H++OH- KW=10-14
H++OH- KW=10-14
CH3COOH H++CH3COO- Ka=1.8×10-5
H++CH3COO- Ka=1.8×10-5
(3)醋酸钠水解的平衡常数Kh的表达式为 ,具体数值= ,当升高温度时,Kh将 (填“增大”“减小”或“不变”)。
(4)0.5 mol·L-1醋酸钠溶液pH为m,其水解的程度(已水解的醋酸钠与原有醋酸钠的比值)为a;1 mol·L-1醋酸钠溶液pH为n,水解的程度为b,则m与n的关系为 ,a与b的关系为 。(填“大于”“小于”或“等于”)
Ⅲ.(5)25 ℃时,将a mol·L-1的氨水与b mol·L-1盐酸等体积混合,反应后溶液恰好显中性,则a b(填“大于”“小于”或“等于”)。用a、b表示NH3·H2O的电离平衡常数为 。
b(填“大于”“小于”或“等于”)。用a、b表示NH3·H2O的电离平衡常数为 。
-
常温下,向20mL 0.2mol•L-1H2A溶液中滴加0.2mol•L-1NaOH溶液.有关微粒的物质的量(n)变化如图.(其中I表示H2A,Ⅱ代表HA-、Ⅲ代表A2-.).根据图示判断,当V (NaOH)=20mL时,溶液中各粒子浓度的大小顺序正确的是( )
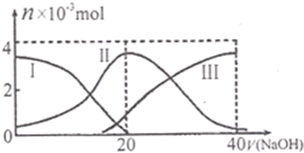
A.c(Na+)>c(HA-)>c(OH-)>c(H2A)>c(H+)>c(A2-)
B.c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)>c(H2A)
C.c(Na+)>c(H+)>c(HA-)>c(A2-)>c(OH-)>c(H2A)
D.c(Na+)>c(OH-)>c(HA-)>c(H2A)>c(H-)>c(A2-)
-
常温下,向20mL 0.2mol/LH2A溶液中滴加0.2 mol/L NaOH溶液。有关微粒的物质的量变化如图(其中I代表H2A,Ⅱ代表HA-,Ⅲ代表A2-)所示。根据图示判断,下列说法正确的是
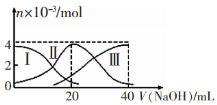
A.当V(NaOH)=20 mL时,溶液中离子浓度大小关系: c(Na+)>c(HA-)>c(A2-)>c(H+)>c(OH-)
B.等浓度的NaOH溶液与H2A溶液按体积2:1混合后,其溶液中水的电离程度比纯水大
C.NaHA溶液中:c(OH-)=c(H+)+c(HA-)+2c(H2A)
D.向上述加入20 mL NaOH溶液后所得溶液中再加入水的过程中,pH可能减少
-
常温下,向20mL 0.2mol/LH2A溶液中滴加0.2 mol/L NaOH溶液。有关微粒的物质的量变化如图(其中I代表H2A,Ⅱ代表HA-,Ⅲ代表A2-)所示。根据图示判断,下列说法正确的是
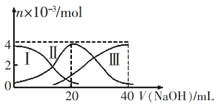
A.当V(NaOH)=20 mL时,溶液中离子浓度大小关系: c(Na+)>c(HA-)>c(A2-)>c(H+)>c(OH-)
B.等浓度的NaOH溶液与H2A溶液按体积2:1混合后,其溶液中水的电离程度比纯水大
C.NaHA溶液中:c(OH-)=c(H+)+c(HA-)+2c(H2A)
D.向上述加入20 mL NaOH溶液后所得溶液中再加入水的过程中,pH可能减少









